2020届高三模拟预测卷(全国Ⅰ卷) 化学部分试题
2020 届高三模拟预测卷(全国Ⅰ卷) 化学部分
【满分:100 分】
可能用到的相对原子质量:H—1 Li—7 B—11 C—12 N—14 O—16 P—31
7.据报道,新冠肺炎传播途径包括飞沫和气溶胶传播。在新冠肺炎防疫中普遍使用的医用外科口罩
的结构如图所示。下列说法不合理的是( )
A.耳带的主要材料为聚氨酯类纤维和聚酯类纤维,这是些都为合成高分子材料
B.鼻夹可以采用过胶铝条,主要体现了铝的硬度适中和延展性好
C.过滤层由于缝隙小和静电作用,可以过滤吸附气溶胶中的颗粒和病毒
D.口罩在使用后不要用手直接接触外层,并直接丢弃避免被感染
8.硫酸亚铁铵 4 4 22 2NH Fe SO 6H O 又称摩尔盐,常用于医药、冶金、电镀等领域。室温下关
于硫酸亚铁铵溶液的说法正确的是( )
A.与 3 3Na K HCO NO 、 、 、 可以大量共存
B.可使酸性高锰酸钾溶液褪为无色
C.溶液中水电离出的 +Hc 可能为 9 11.0 10 mol L
D.向其中滴加 2Ba(OH) 溶液可能发生的离子反应为:
2 2 2
4 4 2 4 3 22NH Fe 2Ba 4OH 2SO Fe(OH) 2BaSO 2NH H O
9.某有机物的结构简式为 。下列关于该有机物的说法正确的是
( )
A.分子式为 17 12 5C H O
B.能发生加成、氧化反应,不能发生取代反应
C.苯环上的一溴代物有 6 种
D.1 mol 该有机物在一定条件下和 2H 反应,最多消耗 8 mol 2H
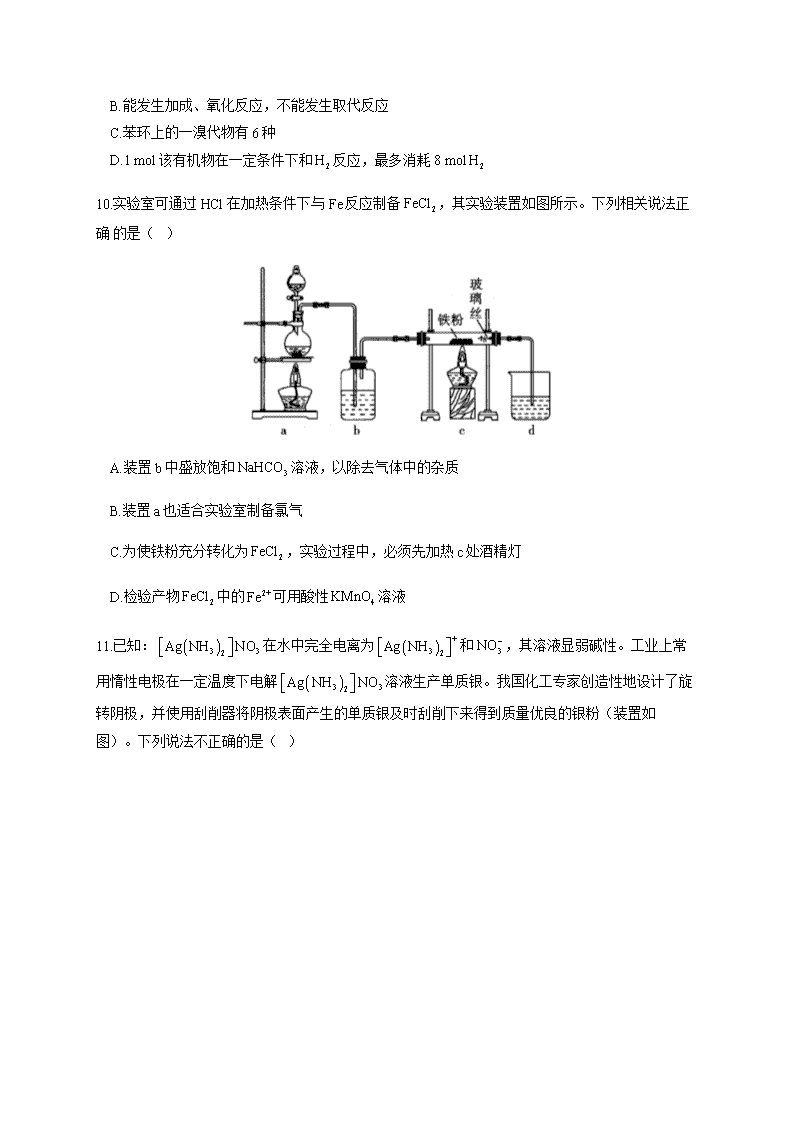
10.实验室可通过 HCl 在加热条件下与 Fe 反应制备 2FeCl ,其实验装置如图所示。下列相关说法正
确 的是( )
A.装置 b 中盛放饱和 3NaHCO 溶液,以除去气体中的杂质
B.装置 a 也适合实验室制备氯气
C.为使铁粉充分转化为 2FeCl ,实验过程中,必须先加热 c 处酒精灯
D.检验产物 2FeCl 中的 2+Fe 可用酸性 4KMnO 溶液
11.已知: 3 32Ag NH NO 在水中完全电离为 3 2Ag NH
和 3NO ,其溶液显弱碱性。工业上常
用惰性电极在一定温度下电解 3 32Ag NH NO 溶液生产单质银。我国化工专家创造性地设计了旋
转阴极,并使用刮削器将阴极表面产生的单质银及时刮削下来得到质量优良的银粉(装置如
图)。下列说法不正确的是( )
A.直流电源的 b 极为负极,电极 A、B 均为阳极
B.旋转阴极的电极反应式为 3 32Ag NH e Ag 2NH
C.每转移 0.4 mol 电子,在 A、B 两极上共产生 22.24 L O
D.装置工作一段时间后,电解池中可得到一种氮肥
12.短周期主族元素 X、Y、Z、W 的原子序数依次增大,Y、W 同主族,Z、W 同周期,X、Y、Z
三种元素形成一种化合物 M,25℃时, 10.1 mol L 的 M 溶液中
12OH
1.0 10
H
c
c
。下列说法正确
的是( )
A.简单离子半径:Y
H2S,故 C 错误;Y 分别与 Z、W 形成的具有漂白性的化合物为 Na2O2、SO2,
故 D 正确。
13.答案:A
解析:第一反应终点生成 NaHA,存在质子守恒: 2
2OH H H A Ac c c c ,A 错误;该
滴定实验过程第二反应终点显碱性,选择酚酞作指示剂,B 正确;由 W 点知: 2H A H HA 的
2.3
1 H 1.0 10K c ,Y 点 HA 的电离常数 9.7
2 H 1.0 10K c ,叠加求得 7.41.0 10K ,C
正确;因为 2H A 是弱电解质,溶液存在电离平衡,改变条件,平衡移动,所以,pH 相同的 2H A 溶
液与盐酸稀释相同倍数后, 2H A 溶液的 pH 小于盐酸的 pH,D 正确。
26.答案:(1)分液漏斗(1 分);平衡气压,使液体顺利流下(2 分)
(2) 2 4 2 2NaNO NH Cl N NaCl 2H O
△
(3 分)
(3)ACDB(CB 互换不扣分)(4 分)
(4)温度升高,化学反应速率加快(1 分);温度升高使化学平衡正向移动(其他合理答案均
可)(1 分)
(5) 146 100%17
b
a
(3 分)
解析: 由信息①锶位于周期表第五周期第ⅡA 族,可知锶的化学性质活泼,与氧气、水等均易反
应; ②氮化锶遇水极易水解生成氢氧化锶和氨气,说明制备时必须保持干燥;③实验室用饱和氯
化铵溶液和亚硝酸钠溶液共热制备氮气,说明了反应的产物是氯化钠、氮气和水。
(1)通过橡皮管将分液漏斗与蒸馏烧瓶相连,可起到平衡烧瓶和漏斗内压强,确保液体顺利流下
的作用。
(3)观察装置,A 装置产生氮气,由于含有水蒸气,故必须干燥,然后与锶发生反应,由于锶和
氮化锶都易与水蒸气反应,故要加一个干燥装置,防止空气中的水蒸气进入 D 装置,故答案为
ACDB。
(4)当吸收氮的作用减缓时将温度提高到 700~750℃,可使 Sr 反应完全,故从速率和平衡的角 度
分析,可能的原因是温度升高,化学反应速率加快或平衡正向移动。
(5)浓硫酸增重的质量就是 3NH 的质量,根据反应 3 2 3Sr N ~ 2NH ,可得氮化锶的质量为 146 g17
b ,
故纯度为 146 100%17
b
a
。
27.答案:(1)① 2 3H SiO (1 分)② B(2 分)
(2) 3.1 6.0a (2 分)
(3) 201.25 10 (2 分)
(4) 3+
3 2 3 4Y 3NH H O Y (OH ) 3NH (3 分)
(5)蒸发结晶时,向溶液中持续通入 HCl 气体(或在 HCl 气流中加热蒸干)(2 分)
(6)电解法好,同时能得到工业原料 2Cl (或热还原法好,操作简单,不产生有毒气体)(2 分)
解析:(1)①根据已知信息 i 和流程中“ 2BeCl ”可知,钇矿石的化学式可改写为
2 3 2Y O FeO 2BeO 2SiO ,则铁元素的化合价为+2。根据已知信息 ii 知,BeO 是两性氧化物,所
以钇矿石和 NaOH 共熔后加水溶解,“滤液Ⅰ”的主要成分为 2 2Na BeO 和 2 3Na SiO ,钇元素和铁
元素留在“滤渣Ⅰ”中。 2 2Na BeO 和 2 3Na SiO 中加入过量盐酸发生反应生成
2 2 3BeCl H SiO NaCl、 、 , 2 3H SiO 不溶于水,过滤后“滤液Ⅱ”的主要成分为如
2BeCl NaCl HCl、 、 ,“滤液Ⅱ”的主要成分为 2 3H SiO 。
②“滤液Ⅱ”中加入过量试剂 A 后过滤得到 2Be O H 沉淀,根据已知信息 ii 可知 2Be O H 具有两
性,能与强碱发生反应,所以选择弱碱氨水沉淀 2+Be ,故选 B。
(2)向含钇元素和铁元素的“滤渣Ⅰ”中加入稀盐酸溶解,得到含 3 3YCl FeCl、 (共熔过程中铁
元素被氧气氧化为+3 价)的溶液,滴加氨水调节 pH a 后过滤,“滤液Ⅰ”中含有钇元素,所以
该操作的目的是除去溶液中的 3+Fe 使其转化为 3Fe OH 沉淀,但不能使 3+Y 转化为沉淀,结合已
知信息 iii 可知,a 的取值范围为 3.1 6.0a 。
(3)平衡常数
3
w
33 3 143 3
20w w
233 3 3+ 3 -
3sp
H OH 1 10
1.25 10Y(OH) 8.0 10Y Y Y OH
K
c c K KK
c c c c K
。
(4)“滤液Ⅲ”的主要成分是 3 4YCl NH Cl、 ,加入氨水后生成 3Y(OH) ,化学反应方程式为
3 3 2 3 4YCl 3NH H O Y (OH ) 3NH Cl ,根据离子方程式的拆分规则可写出离子方程式。
(5)根据已知信息 ii 可知, 2+Be 易水解,为抑制 2+Be 水解需要在酸性环境中加热蒸干溶液才能得
到 2BeCl 固体。不产生有毒气体,且操作简单,因此热还原法好。)
(6) 2NaCl BeCl 混合熔融盐发生的反应为 2 2BeCl Be Cl
电解
,得到 Be 的同时还有 2Cl 生成,
2Cl 是常用的工业原料,因此电解法好。 (热还原法制备 Be 的反应为 22K BeCl Be 2KCl
熔融
,
不产生有毒气体,且操作简单,因此热还原法好。)
28.答案:(1) 1
2 5 2 2 2C H OH(l) 3H O(l) 2CO (g) 6H (g) Δ 348.0 kJ molH g (3 分)
(2)3.9(2 分)
(3)①不是(1 分);② 1 11.4 mol L ht
g g (2 分);③0.8(2 分)
(4)①CD(2 分);② 4 2 3 3 2BH H 3H O H BO 4H (2 分)
解析:(1)由已知氢气与乙醇的燃烧热化学方程式,再依据盖斯定律可得:
1
2 5 2 2 2C H OH( l) 3H O(1) 2CO (g) 6H (g) Δ 348.0 kJ molH g 。
(2)为了使容器温度保持不变,容器内反应放出的热量应该等于吸收的热量,由此计算得出
2
2
H O 3.9O
n
n
。
(3)①由图像可知反应物乙醇的含量为零,所以,两个反应均不是可逆反应,②由氢原子与碳原
子守恒,可以求出反应经过 t 小时后,容器中生成氢气的物质的量是 2.8 mol,由此,容器中生成
氢气的平均反应速率 1 1
2
1.4H mol L hv t
g g 。③1 150 K 时,测得容器中 2H 0.36Y ,
2H O 0.45Y ,此时,CO 与 2CO 的物质的量分数相等,由平衡常数表达式计算平衡常数 K 等于
0.8。
(4)①由方程式可知,只有一种气体( 2H ),加入 2H ,在恒容密闭容器中,平衡正向移动, 2H
的转化率增大,故 A 错误;容器中 Na 为固体,加固体对平衡无影响,平衡不移动,故 B 错误; C
项与 D 项的描述是正确的。②由水解信息,可推知: 4 2 3 3 2BH H 3H O H BO 4H 。
35.答案:(1)HP>H。
(2) 2+Mn 的价层电子排布式为 53d ,3d 能级达到半充满稳定结构, 2+Fe 的价层电子排布式为
63d ,所以 2+Fe 再失去一个电子所需要的能量较小。
(3)基态 P 原子的价层电子排布式为 2 33s 3p ,由此可得其价层电子排布图,其电子占据最高能级
为 3p,电子云轮廓图为哑铃形。
(4) 4 6P O 、 4 10P O 都是分子晶体,相对分子质量越大,分子间作用力越大,熔点越高,故 4 10P O 的
熔点高。
(5) 3PO 中 P 的价层有 3 对电子,3 对电子都是成键电子,没有孤电子对,故 3PO 的空间构型呈
平面三角形。
(6)观察图像知,磷化硼晶胞中,8 个 P 原子位于立方体顶点,6 个 P 原子位于面心,4 个 B 原子
位于体内,故 1 个磷化硼晶胞中含 4 个 P 原子。由图示可知,磷化硼的晶胞参数为 cma ,
3
A
4 (11 31)a d N
。若以晶胞前左下磷原子的位置为坐标原点,则两个硼原子坐标分别为
4 4 4
a a ay
, , 、 3 3
4 4 4
a a ax
, , ,利用勾股定理,x 和 y 原子间的距离等于
2 2 2
3 3
A A
1 1 1 3 1 3 2 2 4 (11 31) 21cm cm cm 2 cm4 4 4 4 4 4 2 2a a d N d N
。
36.答案:(1)羟基、溴原子(2 分);NaOH(水)溶液,加热(2 分);消去反应(1 分)
(2) (1 分);3(2 分)
(3) 2 4
2 3 3 2 2
H SOHC CCH OH CH CHClCOOH CH CHClCOOCH C CH H O 浓V
(2 分)
(4) (2 分)
(5)
(3 分)