化学(理)卷·2019届贵州省遵义四中高二上学期第一次月考(2017
遵义四中 2017~2018 学年度高二第一次月考
化学(理科)试卷
时间:90 分钟 满分:100 分
出题人:申妮 审核人:卢胜雄
可能用到的相对原子质量:H-1 C-12 N-14 O-16 I-127 Mg-24 Al-27 Zn-65
考生注意:将试题答案填写在答题卡上,只交答题卡。
第 I 卷:选择题(42 分)
一、单项选择题(共 12 小题,每题 2 分,共 24 分。每题只有一个选项是正确的)
1、下列关于化学反应与能量的说法,正确的是( )
A.放热反应都能自发进行,吸热反应需要在加热的条件下才能进行
B.在化学反应中,反应物的总能量总是等于生成物的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.只有化学反应中才有能量的变化
2、胡锦涛同志在十七大报告中指出,应加强能源资源节约和生态环境保护,增强可持续发
展能力。下列行为与之不相符的是( )
A.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
B.将作物秸秆通过化学反应转化为乙醇用作汽车燃料
C.使用资源节约型、环境友好型的生物降解塑料包装
D.大量使用化学肥料,提高农作物的产量和质量
3、对于 Zn(s) + H2SO4(aq) ═ ZnSO4(aq) + H2(g) △H=?的化学反
应,下列叙述不正确的是 ( )
A.反应过程中能量关系如图所示,则该反应的△H<0
B.热化学反应方程式中的ΔH 与反应方程式的计量数有关
C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有 32.5 g 锌溶解时,正极放出气体一
定为 11.2 L
4、下列热化学方程式中的ΔH 能表示物质燃烧热的是( )
A.2 CO(g) + O2(g) = 2 CO2(g) ΔH = —566 kJ·mol—1
B.C2H4(g) + 3 O2(g) = 2 CO2(g) + 2 H2O(l) ΔH = —1411 kJ·mol—1
C.2 H2(g) + O2(g) = 2 H2O(l) ΔH = —571.6 kJ·mol—1
D.H2(g) + O2(g) = H2O(g) ΔH = —184.6 kJ·mol—1
5、已知 H+(aq) + OH—(aq) = H2O(l) △H = —57.3 kJ·mol—1。用 10 mL 0.55 mol/L NaOH 溶
液与 10 mL 0.5 mol/L 的盐酸做中和热的测定实验,下列说法正确的是( )
A . 若 将 0.5 mol/L 的 盐 酸 换 为 0.5 mol/L 醋 酸 溶 液 反 应 , 所 测 得 的 中 和 热 △ H <
—57.3kJ/mol
B.使用环形玻璃搅拌棒可使反应物混合均匀,加快反应速率,减小实验误差
C.为了使反应充分,可以向酸中分次加入碱或者向碱中分次加入酸
D.用铜丝代替玻璃棒搅拌,会使中和热测定中△H 偏小
6、将 4 mol A 和 2 mol B 放入 2 L 密闭容器中发生反应:2A (g)+B(g) 2C(g);ΔH<0,
2
1
第 3 题图
4 s 后反应达到平衡状态,此时测得 C 的浓度为 0.6 mol/L。下列说法正确的是( )
A.4 s 内,v(B)=0.15 mol/(L·s)
B.4 s 后平衡状态下,c(A)∶c(C)=2∶1
C.达到平衡状态时,若只升高温度,则 C 的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则 A 的转化率增大
7、根据碘与氢气反应的热化学方程式
(1)I2 (g) + H2 (g) 2 HI (g) ΔH1 = —9.48 kJ/mol
(2)I2 (s) + H2(g) 2 HI (g) ΔH2 = ?
下列判断正确的是( )
A.反应(2)的反应物总能量比反应(1)的反应物总能量高
B.反应(1)的产物比反应(2)的产物稳定
C.ΔH1 <ΔH2
D.碘单质由固态到气态,放出热量
8、在一定条件下,CO 和 CH4 燃烧的热化学方程式分别为:
2 CO (g) + O2(g) = 2 CO2 (g) △H = —566 kJ/mol
CH4 (g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) △H = —890 kJ/mol
由 1 mol CO 和 3 mol CH4 组成的混和气在上述条件下完全燃烧时,释放的热量为( )
A.2953 kJ B.2912 kJ C.3236 kJ D.3867 kJ
9、对于一定条件下进行反应 2A(g)+ 2B(g) C(g)ΔH>0,改变下列条件可以提
高反应物活化分子百分数,加快化学反应速率,平衡正向移动的是( )
A.增大压强 B.升高温度 C.增大 A 的浓度 D.加入催化剂
10、下列实验操作不正确的是( )
实验目的 实验操作
A 验证化学反应中的能量变化 将 NO2 球浸泡在冰水,热水中观察颜色变化
B
探究相同条件下,溶液温度对反应速率的
影响
在两支试管中各加入 5 mL 0.1 mol/L 的 Na2S2O3 和 5 mL
0.1 mol/L 的 H2SO4 溶液,再分别放入冷水、热水中 ,
记录出现浑浊所需时间
C
探究相同条件下,溶液浓度对反应速率的
影响
在两支试管中各加入 4 mL 0.01 mol/L 的 KMnO4 酸性溶
液,再分别加入 0.1 mol/L H2C2O4 溶液 2 mL、0.2 mol/L
H2C2O4 溶液 2 mL,分别记录溶液褪色所需时间
D
探究相同条件下,溶液浓度对化学平衡移
动的影响
在两支试管中各加入 5 mL 0.1 mol/L 的 K2Cr2O7 溶液,
再分别 3—10 滴浓硫酸和 10—20 滴 6 mol/L NaOH 溶液,
观察溶液颜色变化
11、无水氯化铝是一种重要的催化剂,工业上由 Al2O3 制备无水氯化铝的反应为
2 Al2O3 (s) +6 Cl2 (g) 4 AlCl3 (g)+3 O2 (g) ΔH>0。下列分析错误的是( )
A.减小反应体系的体积,增大压强,反应速率加快
B.加入碳粉,平衡向右移动,原因是碳与 O2 反应,降低了生成物的浓度且放出热量
C.电解熔融的 Al2O3 和 AlCl3 均能得到单质铝
D.升高温度,平衡正向移动
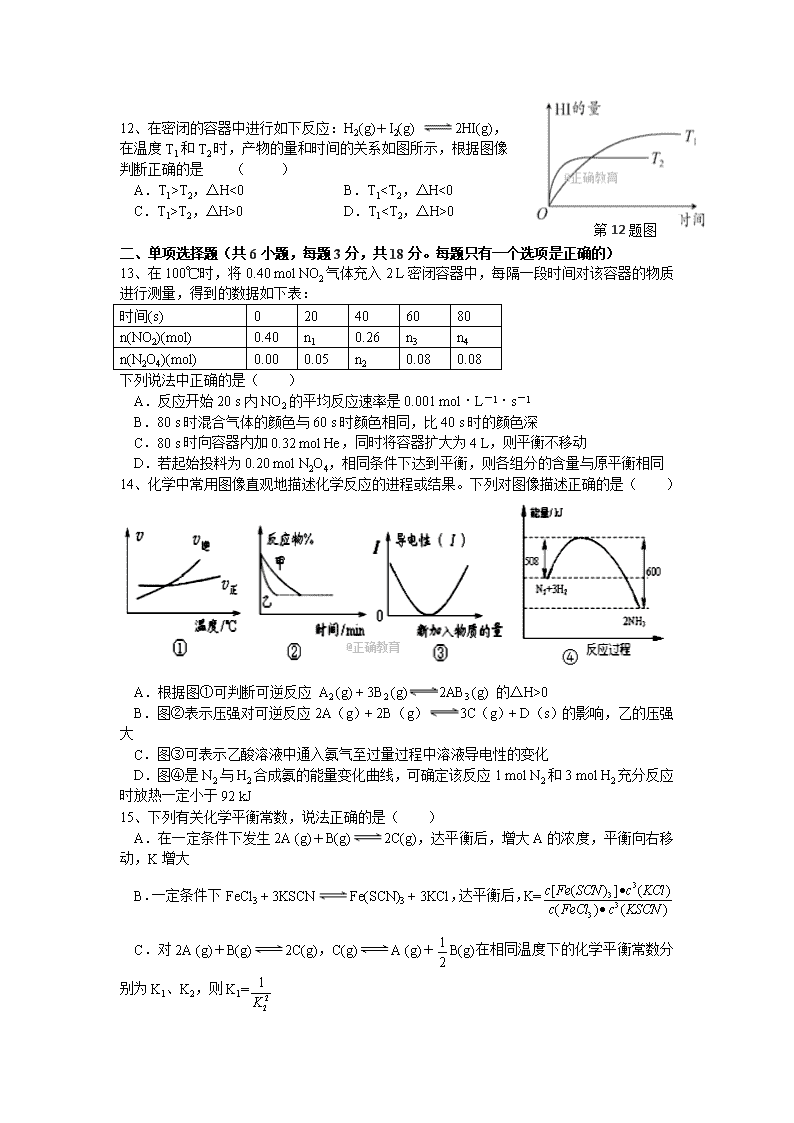
12、在密闭的容器中进行如下反应:H2(g)+I2(g) 2HI(g),
在温度 T1 和 T2 时,产物的量和时间的关系如图所示,根据图像
判断正确的是 ( )
A.T1>T2,ΔH<0 B.T1
T2,ΔH>0 D.T10
二、单项选择题(共 6 小题,每题 3 分,共 18 分。每题只有一个选项是正确的)
13、在 100℃时,将 0.40 mol NO2 气体充入 2 L 密闭容器中,每隔一段时间对该容器的物质
进行测量,得到的数据如下表:
时间(s) 0 20 40 60 80
n(NO2)(mol) 0.40 n1 0.26 n3 n4
n(N2O4)(mol) 0.00 0.05 n2 0.08 0.08
下列说法中正确的是( )
A.反应开始 20 s 内 NO2 的平均反应速率是 0.001 mol·L-1·s-1
B.80 s 时混合气体的颜色与 60 s 时颜色相同,比 40 s 时的颜色深
C.80 s 时向容器内加 0.32 mol He,同时将容器扩大为 4 L,则平衡不移动
D.若起始投料为 0.20 mol N2O4,相同条件下达到平衡,则各组分的含量与原平衡相同
14、化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述正确的是( )
A.根据图①可判断可逆反应 A2 (g) + 3B2 (g) 2AB3 (g) 的ΔH>0
B.图②表示压强对可逆反应 2A(g)+ 2B(g) 3C(g)+ D(s)的影响,乙的压强
大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.图④是 N2 与 H2 合成氨的能量变化曲线,可确定该反应 1 mol N2 和 3 mol H2 充分反应
时放热一定小于 92 kJ
15、下列有关化学平衡常数,说法正确的是( )
A.在一定条件下发生 2A (g)+B(g) 2C(g),达平衡后,增大 A 的浓度,平衡向右移
动,K 增大
B.一定条件下 FeCl3 + 3KSCN Fe(SCN)3 + 3KCl,达平衡后,K=
C.对 2A (g)+B(g) 2C(g),C(g) A (g)+ B(g)在相同温度下的化学平衡常数分
别为 K1、K2,则 K1=
)()(
)(])([
3
3
3
3
KSCNcFeClc
KClcSCNFec
•
•
2
1
2
2
1
K
第 12 题图
D.在一定条件下 2A (g)+B(g) 2C(g),某时刻 ,平衡逆向移动
16、有文献报道,硫在空气中燃烧时,燃烧产物中 SO3 体积比约占 5% ~ 6%(2SO2 (g)+O2(g)
2SO3(g) △H<0),而硫在纯氧气中燃烧时,其产物中的 SO3 体积比约占 2% ~ 3%,
解释这一事实的理由正确的是( )
A.在空气中燃烧时,硫的燃烧热小,化学平衡向有利于生成 SO3 的方向移动
B.纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成 SO3 的方向移动
C.在硫燃烧的过程中,对于 SO3 的生成,温度的影响大于氧气浓度的影响
D.没有使用催化剂
17、将 1 mol A2 和 1 mol B2 通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发
生反应:2A2(g)+B2(g) 2A2B(g)。反应达到平衡时 A2B 为 0.3 mol。若此时移走 0.5 mol
A2 和 0.5 mol B2,则重新达到平衡后,A2B 的物质的量 ( )
A.小于 0.15 mol B.等于 0.15 mol
C.大于 0.15 mol,小于 0.3 mol D.等于 0.3 mol
18、在体积为 2 L 的恒容密闭容器中发生反应 xA(g)+yB(g) zC(g),图甲表示 200 ℃时
容器中 A、B、C 物质的量随时间的变化,图乙表示不同温度下平衡时 C 的体积分数随起始
n(A): n(B)的变化关系。则下列结论正确的是( )
A.200 ℃时,向容器中充入 2 mol A 和 1 mol
B,达到平衡时,A 的体积分数小于 0.5
B.由图乙可知,反应 xA(g)+yB(g) zC(g)的
ΔH<0,且 a=2
C.若在图甲的平衡状态下,再向体系中充入 He,
重新达到平衡前 v(正)>v(逆)
D.200 ℃,达到平衡时,n(B)=n(C),因此可判定其他任意条件下,当 n(B)=n(C)时,该
反应达平衡
第 II 卷:非选择题(58 分)
三、非选择题(本大题共 4 小题,共 58 分,请将答案写在答题卡对应的位置上)
19、(9 分)化学反应过程中,不仅有物质的变化,同时还
伴随着能量的变化。
(1)图Ⅰ是 1molNO 2 和 CO 反应生成 CO2 和 NO 过程中能
量变化示意图,请写出 NO2 和 CO 反应的热化学方程式:
_____
(2)甲烷的燃烧热是 890 kJ/mol,请写出甲烷燃烧热的热化
学方程式:
(3)已知断裂 1 mol 化学键所需的能量(kJ):H—H 键为
KBcAc
Cc <)(
)()(2
2
•
第 18 题图
436 ,Cl—Cl 键为 243,H—Cl 为 431,请写出 H2 与 Cl2 生成 HCl(g)的热化学方程式:
_______________________________________________
20、(14 分) 哈伯因发明了由氮气和氢气合成氨气的方法而获得 1918 年诺贝尔化学奖.现
将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
(1)氢气和氮气反应生成氨气(在 2 s 内)的反应速率 v(H2)=
若此时已达平衡,则可求得平衡常数为 。(用分数表示)
(2)右图表示合成 NH3 反应在某段时间 t0→t6 中改变单一条件
反应速率与反应过程的曲线图
①在下列到达化学平衡的时间段中,NH3 的
体积分数最高的一段时间是(填写下列序号,下同 ) ,
N2 转化率最高的一段时间是,
化学平衡常数最大的一段时间是
A. t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
②由图可推知合成 NH3 反应的焓变△H 0(填“>”或“<”)。
③t3 时改变的条件是。
21、(16 分)下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ测定化学反应速率
该同学利用如图装置测定化学反应速率。
(1)请写出圆底烧瓶中进行的离子反应方程式:
。
(2)除如图所示的实验用品、仪器外,还需要的一件实验仪器是
__________。
(3)若在 2 min 时收集到 224 mL(已折算成标准状况)气体,可计
算出该 2 min 内 H+的反应速率,而该测定值比实际值明显偏小,其
原因是 。
(4)试简述测定该反应的化学反应速率的其他方法:
_____________________________________________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2 S2O32— = S4O62—+2I-,其中 Na2S2O3 溶液均足量)
体积 V/mL实验序号
Na2S2O3 溶液 淀粉溶液 碘水 水
时间/s
① 10.0 2.0 4.0 0.0 t1
② 8.0 2.0 4.0 2.0 t2
③ 6.0 2.0 4.0 Vx t3
(5)该实验进行的目的是 ,淀粉溶液的作用是 ,表中
物质 N2 H2 NH3
起始时 5 mol/L 3 mol/L 0
2s 末 2 mol/L
第 21 题图
第 20 题图
Vx=mL,通过比较 t1、t2、t3 大小,试推测该实验结论:
___________________________________________________________________________。
22、(19 分)随着科学技术的发展和环保要求的不断提高,CO2 的捕集利用技术成为研究的
重点。
(1)NH3 和(NH4)2CO3 已经被用作工业捕碳剂,它们与 CO2 可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) (NH4)2HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2(NH4)2HCO3(aq)△H3
①△H3 与△H1、△H2 之间的关系是:△H3=_____________________________
②为研究温度对(NH4)2CO3 捕获 CO2 效率的影响,在某温度 T1 下,将一定量的
(NH4)2CO3 溶液置于密闭容器中,并充入一定量的 CO2 气体(用氮气作为稀释剂),在
t 时刻,测得容器中 CO2 气体的浓度。然后分别在温度为 T2、T3、T4、T5 下,保持其它初始
实验条件不变,重复上述实验,经过相同时间测得 CO2 气体浓度,得到趋势图(见图 1).则
△H3______0(填>、=或<)。在 T3 前后容器内 CO2 气体浓度呈现如图Ⅰ所示的变化趋势,
其原因是_______________________________________________________________________
______________________________________________________________________(3 分)
③利用反应Ⅲ捕获 CO2,提高 CO2 吸收量的措施有
(写出 2 个)。
(2)目前国际空间站处理 CO2 的一个重要方法是将 CO2 还原,所涉及的反应方程式为:
CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0
①平衡常数表达式为:__________________________
②若升高温度时,下列物理量如何变化(填“增大”、“减小”或“不变”)
ν 正 KH2 转化率___________
③相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
c(CO2)/mol·L—1 c(H2)/mol·L—1 c(CH4)/mol·L—1 c(H2O)/mol·L—1
平衡Ⅰ a b c d
平衡Ⅱ m n x y
请写出 a、b、c、d 与 m、n、x、y 之间的关系:__________________________
22 题 图
Ⅰ
Ru
遵义四中 2017~2018 学年度高二第一次月考
化学(理科)答案
一、选择题(2 分一个)
1—5 CDDBB 6—10 DCABA 11—12 CB
二、选择题(3 分一个)
13—18 DDCCAA
三、非选择题
19、(2 分一个)
(1)NO2(g) + CO(g)= CO2(g) + NO(g)△H=—234 kJ/mol
(2)CH4(g) + 2O2(g)= CO2(g) + 2 H2O(l)△H=—890 kJ/mol
(3)H2(g) + Cl2(g)= 2HCl(g) △H=—183 kJ/mol(合理即可)
20、(1)0.5 mol·L–1·s–1 1/84(mol/L)-2
(2) A A A
(3) <
(4)加入催化剂
21、(1)SO32- + 2H+ = SO2↑ +H2O
(2)秒表
(3)SO2 部分溶于水
(4)测定一定时间内 Na2SO3 浓度的变化量(合理即可)
(5)探究 Na2S2O32- 浓度对化学反应速率的影响
检验碘单质
4
22、(无特殊标明,2 分一空)(1)① 2△H2—△H1
②<
(3 分)
③降低温度;增加(NH4)2CO3 的浓度(合理即可)
(2)①
②增大 减小 减小
③
)()(c
)()(
2
4
2
2
2
4
HcCO
OHcCHcK •
•=