- 2021-04-17 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【40套试卷合集】四川省成都经开区实验中学2019-2020学年化学高一上期末模拟试卷含答案
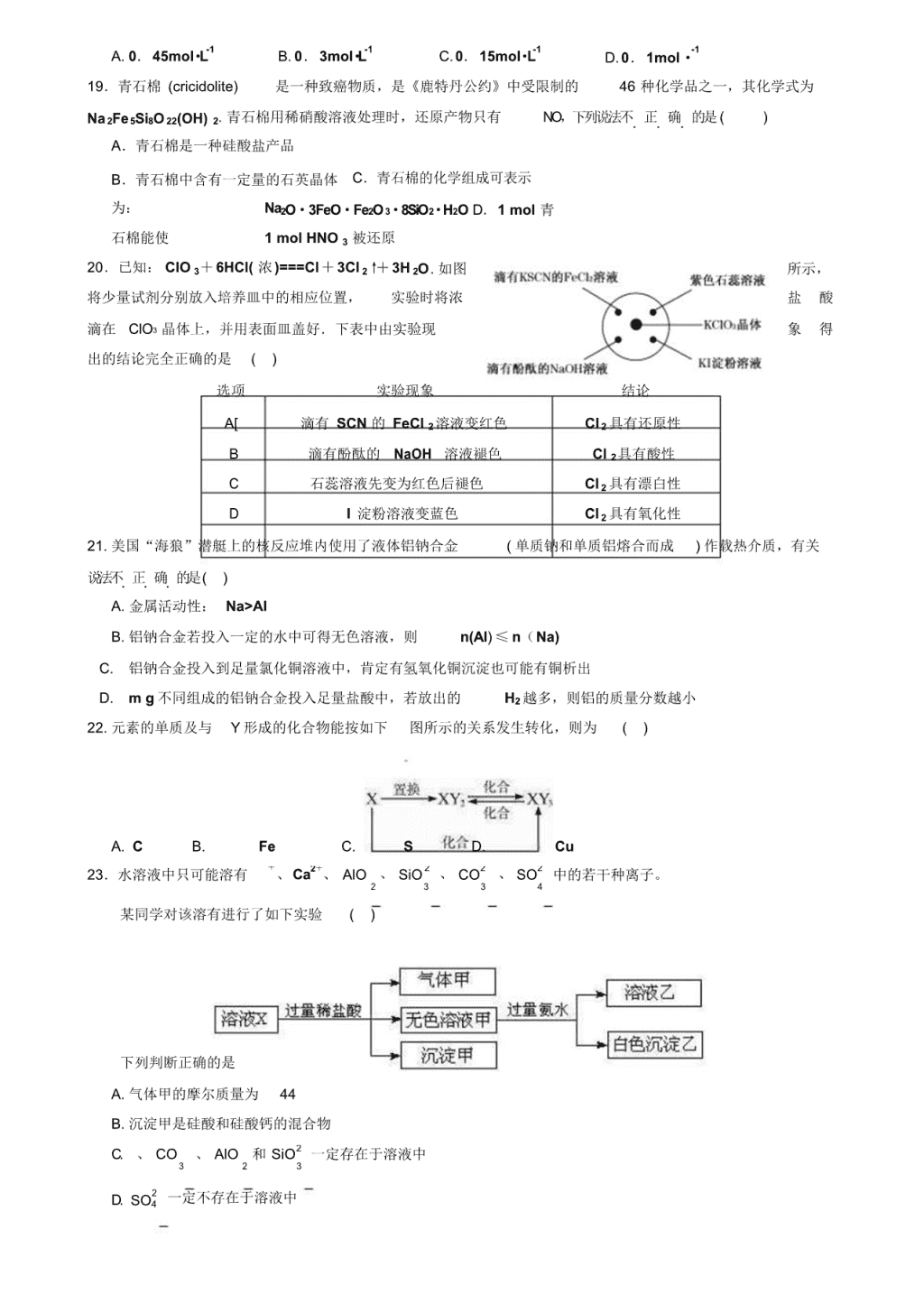
2019-2020 学年高一上化学期末模拟试卷含答案 (可能用到的相对原子质量: H— 1 0—16 Na— 23 Al —27 Fe— 56 Si— 28) I 卷(选择题 共 50 分) 一、选择题(在下列各题的四个选项中, 只有一项 ..是最符合题意的,请将答案 涂在答题卡上;每小题 2 分,共 50 分) 1.下列物质是电解质的为 ( ) A.氨气 B .硫酸钡 C .水玻璃 D .硝酸钾溶液 2. “84”消毒液在日常生活中使用广泛, 该消毒液无色, 有漂白作用。 它的有效成分是下列物质中的 ( ) A. NaOH B. NaClO C. MnO 4 D. Na2O 2 3.铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是 A. Fe2(SO4)3 B. 稀 HNO3 C.AgNO3 D. 稀 H2SO4 4.下列物质不能..通过化合反应直接制得的是 ( ) A.FeCl2 B.NaHCO3 C.H2SiO3 D.Fe(OH)3 5.有些科学家提出硅是“ 21 世纪的能源”。下列关于硅的说法不正确...的是 ( ) A.高纯度的单质硅被广泛用于制作计算机芯片、制造太阳能电池 B.硅可由二氧化硅 还原制得 C.常温时硅与水、空 气和酸不反应,但能与氢氟酸反应D.自然界硅元素的 贮量丰富,并存在大量的单质硅 6.下列物质既能与盐酸反应又能与 NaOH 溶液反应的是 ( ) ① FeO ②SiO 2 ③ Al 2O3 ④NaHSO 4 ⑤AlCl 3 ⑥NH 4HCO 3 A.③⑥ B.②③ C.①③ D.④⑤ 7.设 NA 表示阿伏加德罗常数,下列叙述正确的是 ( ) A.78 g Na2O2 与足量水充分反应时电子转移数为 2NA B.1mol Na 完全转化为 Na2O2 时,失去的电子数目为 2NA C. 4℃、 101.3kPa 时, 54mL H2O 中含有的分子数为 3NA D. 2L1mol/L Na2SO4溶液中离子总数为 3NA 8. 下列关于试剂保存正确的是 ( ) A. 用无色玻璃试剂瓶保存氯水 B. 用玻璃瓶保存氢氟酸 C. NaOH 溶液保存在带玻璃塞的广口瓶中 D. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 9.下列说法中不正确的是 ( ) A. 实验室制 Fe(OH)2 时应将汲有 NaOH 溶液的胶头滴管伸入 FeSO4 溶液液面下,缓缓挤出碱液 B. 镁铝合金的硬度和熔点都比纯铝和纯镁大 C. 结晶形和无定形二氧化硅统称硅石 D. 常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而常温耐腐蚀 10.用一种试剂证明生石灰中含有石灰石和石英,下列试剂适宜的是 ( ) A.盐 酸 B.硫酸 C . NaOH 溶液 D .氯化钠溶液 11. 下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是 ( ) 3 +SO4 3 4 =2Fe ①活性炭 ②过氧化钠 ③氯水 ④Al(OH)3 胶体 ⑤臭氧 A.①③④ B .②③⑤ C .①②③④ D .①②③④⑤ 12. 某溶液中只含 有 Na+、CO 2-、Cl-,检验该溶液中 Cl-的方法正确的是 A. 加入足量稀 HNO3 酸化的 AgNO3 溶液 B. 先加入足量 BaCl2 溶液,过滤,再加入 AgNO3 溶液 C. 先加入足量稀 H2 SO4,再加入 AgNO3 溶液 D. 先加入稀盐酸,再加入 AgNO3 溶液 13.下列反应的离子方程式正确的是 ( ) 2+ A. 铁粉投醋酸溶液中 Fe+2H+ =Fe +H2↑ + - - B. Cl2溶于水: Cl2+ H2O=2H +Cl +ClO C. 氢氧化钡溶液中滴加硫酸氢钠溶液至恰好为中性: Ba2+ 2- - +2OH +2H + =BaSO4↓ +2H2O D. 向饱和澄清石灰水中加入纯碱溶液: Ca(OH)2+CO3 14. 下列各组离子一定能大量共存的是 ( ) A. 在含大量 Fe3+的溶液中: NH4 +、Na+、Cl-、 SCN- B. 在强碱溶液中: Na+、 +、AlO2 -、 CO 2- - =CaCO3↓ +2OH 2- + 2+ 2+ - C. 在有 SO4 存在的溶液中: Na 、Mg 、Ca 、I D. 在酸性溶液中: +、MnO -、 Fe2+、 Cl- 15.下列离子方程式正确的是 ( ) A. 小苏打溶液中加入少量的澄清石灰水: HCO 3 -+ Ca 2+ + OH - ↓ +H == CaCO 3 2O + 3+ 2+ B. 磁性氧化铁在盐酸中长期浸泡: Fe3O4+8H =2Fe +Fe +4H2O C. 向 Ca(ClO) 2 溶液中通入过量的 CO 2:Ca2+ +2ClO +CO 2+H 2O=CaCO 3↓ +2HClO D. 向 FeO中加入足量稀硝酸: FeO+2H+ 2+ +H2O 16. FeCl 3 、CuCl 2 的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是 ( ) A. 加入 SCN 溶液一定不变红色 B. 溶液中一定含 Fe2+ C. 溶液中一定含 Cu2+ D. 剩余 固体中一定含 Cu 17.某学生在实验室做了 4 个实验: (1)在 NaAlO2 溶液中通入 CO2 至过量 ( 2)向 NaAlO2溶液中逐滴加盐酸至过量 (3)向盐酸中逐滴加 NaAlO2 溶液至过量 ( 4)向 NaOH 溶液中逐滴加 AlCl3溶液至过量 并根据以上实验 只画出下列 3 种图像(纵坐标为沉淀物质的量,横坐标为所加入物质的物质的量) 。实验 与图像对应关系正确的是 a b c A. (1)和 a B. (2)和 a C. ( 3)和 c D. (4)和 b 3+浓度为 0. 1mol·L-1, SO 2-浓度为 0.3mol·L-1,则混合液中镁 18.硫酸镁和硫酸铝溶液等体积混合后, Al 4 离了的浓度为 2 - - L + 2 2 A. 0.45mol·L-1 B. 0.3mol·L-1 C.0.15mol·L-1 D.0.1mol·-1 19.青石棉 (cricidolite) 是一种致癌物质,是《鹿特丹公约》中受限制的 46 种化学品之一,其化学式为 Na 2Fe5Si8O 22(OH) 2. 青石棉用稀硝酸溶液处理时,还原产物只有 NO,下列说法不.正.确.的是( ) A.青石棉是一种硅酸盐产品 B.青石棉中含有一定量的石英晶体 C.青石棉的化学组成可表示 为: Na2O·3FeO·Fe2O 3·8SiO2·H2O D.1 mol 青 石棉能使 1 mol HNO 3 被还原 20.已知: ClO 3+6HCl( 浓)===Cl+3Cl 2↑+3H 2O. 如图 所示, 将少量试剂分别放入培养皿中的相应位置, 实验时将浓 盐 酸 滴在 ClO3 晶体上,并用表面皿盖好.下表中由实验现 象 得 出的结论完全正确的是 ( ) 选项 实验现象 结论 A[ 滴有 SCN 的 FeCl 2 溶液变红色 Cl 2 具有还原性 B 滴有酚酞的 NaOH 溶液褪色 Cl 2具有酸性 C 石蕊溶液先变为红色后褪色 Cl 2 具有漂白性 D I 淀粉溶液变蓝色 Cl 2 具有氧化性 21. 美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金 ( 单质钠和单质铝熔合而成 ) 作载热介质,有关 说法不.正.确.的是( ) A. 金属活动性: Na>Al B. 铝钠合金若投入一定的水中可得无色溶液,则 n(Al) ≤ n(Na) C. 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 D. m g 不同组成的铝钠合金投入足量盐酸中,若放出的 H2 越多,则铝的质量分数越小 22. 元素的单质及与 Y 形成的化合物能按如下 图所示的关系发生转化,则为 ( ) A. C B. Fe C. S D. Cu 23.水溶液中只可能溶有 +、Ca2+、 AlO 、 SiO 2 、 CO2 、 SO2 中的若干种离子。 2 3 3 4 某同学对该溶有进行了如下实验 ( ) 下列判断正确的是 A. 气体甲的摩尔质量为 44 B. 沉淀甲是硅酸和硅酸钙的混合物 C. 、 CO 、 AlO 和 SiO2 一定存在于溶液中 3 2 3 D. SO4 一定不存在于溶液中 2 - +2SO4 24.向 100 mL 0.1 mol ·L-1 硫酸铝铵 [NH 4Al(SO4)2]溶液中逐滴滴入 0.1 mol -1 L·Ba(OH)2 溶液。随着 Ba(OH)2 溶 液体积 V 的变化,沉淀总物质的量 n 的变化如右图所示。则下列说法中正确的是 ( ) A.a 点对应的沉淀只有 BaSO4 B.c 点溶液铝元素以 AlO - 的形式存在 C.b 点 发 生 反 应 的 离 子 方 程 式 是 : Al3+ 2 - 2+ +2Ba +3OH = Al(OH)3↓ +2BaSO4↓ D.c 点加入 Ba(OH)2 溶液的体积为 200 mL 25.将质量为 m g 的铁粉, 溶于 100mL 4mo·l L - 1 HNO 3 溶液 ( 过量 ) ,充分反应后所得还原产物为 0.05mol NO ,再向所得溶液中加入足量的 NaOH 溶液至沉淀完全,则沉淀质量为 ( ) A.5.52g B . (m+6.8)g C .(m+2.55)g D .(m+12.0)g II 卷(非选择题 共 50 分) 26.(7 分 ) 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。 (1)碳酸氢钠的俗称是 ,溶于水时 (填“吸热”或“放热” ),其水溶液显 性(填“酸” 、“碱”或“中” )。 (2)碳酸氢钠可治疗胃酸( 0.2%~0.4%的盐酸)过多,反应的离子方程式为 。等 物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成 CO2 的量, 前者 后者(填“>”、“<”或“=”) 27.(12 分)硫酸亚铁晶体( FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。 实验步骤如下: 请回答下列问题: (1)证明步骤①滤液中含有 Fe2+的方法是 , 该过程涉及的离子反应为: , 。 (2)若向步骤①滤液中加入足量 NaOH 溶液,则出现白色沉淀、迅速变为灰绿色、最后变为红褐色,原 因是(用化学方程式解释) 。 (2)步骤②加入过量 H2O2 的目的: 。 (3)步骤③中反应的离子方程式: 。 (4)步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量。若实验无损耗,则每片 补血剂含铁元素的质量 g 。(用含 a 的式子表示) 28.(7 分) 下图各物质中, A、B、C 是常见金属单质,甲、乙、丙是气体且乙是有颜色的气体(图中有 些反应的产物和反应的条件没有全部标出) 。 请根据以上信息回答下列问题: ( 1)写出下列物质的化学式: H ,B ,F ( 2)写出有关反应的离子方程式: 反应① 反应② 29. (12 分)瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热, 产 生了一种黄绿色、 刺激性气味的气体——氯气。 某学生使 用这一原理设计如图所示的实验装置, 并且利 用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应) ,据此回答下列问题: (1) A 中所盛试剂是 ,B 中发生反应的化学方程式是 。 (2)漂白粉将在 U 形管中产生,其化学方程式是 。 (3)此实验结果所得漂白粉中 Ca(ClO)2 含量太低,经分析并查阅资料发现,主要原因是在 U 形管中存在 两个其他反应降低了 Ca(ClO)2百分含量: ① 温 度 较 高 时 氯 气 与 消 石 灰 反 应 生 成 Ca(ClO3)2 , 为 避 免 此 反 应 的 发 生 , 可 采 取 的 措 施 是 。 ② 挥 发 的 HCl 为 也 会 降 低 Ca(ClO)2 的 百 分 含 量 , 则 应 采 取 的 措 施 是 。 (4)某同学准备在 D 中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是 ( 填字母 ) _ A .氢氧化钠 溶液 B .碳酸钠浓溶液 C .浓硫酸 ( 5)漂粉精同盐酸作用产生氯气: Ca(ClO)2+4HCl =CaC2l+2Cl2↑ +2H2O,该反应中每生成 1mol Cl2,转移电 子的物质的量为 mol,被氧化的 HCl的物质的量为 mol。 30. ( 6 分) 某混合物由 Fe、Si、Al 组成,取该混合物 16.7g 与足量的稀硫酸反应,放出 0.35mol 氢气, 若将等质量的上述混合物和足量的 NaOH 溶液反应,也放出相同物质的量的氢气。则混合物中各物质的物 质的 量 n(Fe) 为 mol,n(Si)为 mol, n(Al)为 mol。 -1 3 31.(6 分)在由 Fe、 Fe2O3 组成的混合物中加入 200mL2mo·l L 的盐酸,恰好使混合物完全溶解,并放出 448mL 气体(标准状况) ,此时向溶液中加入 SCN 溶液无明显现象,求反应前混合物中 Fe、Fe2O3 的物质 的量 n(Fe)为 mol, n(Fe2O3)为 mol。 26.(7 分) (1)小苏打 吸热 碱(各 1 分) (2) HCO — + +H =CO2↑ +H2O (2 分), = (2 分) ( 7 分) ( 1)Fe( OH ) 3 Al FeCl2 (各 1 分) 28. ( 2)2Na+2H 2O=2Na + +2OH - +H 2↑; (2 分) 2Al+2OH - - +2H 2O=2 AlO 2 +3H 2↑ (2 分) 30.(6 分) 0.2 0.1 0.1 (各 2 分) 31.(6 分) 0.08 0.06 (各 3 分) + + 2019-2020 学年高一上化学期末模拟试卷含答案 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷 1~3 页,第Ⅱ卷 4~6 页。全卷共 100 分,考试时间为 90 分钟。 可能用到的相对原子质量: H— 1 C —12 N —14 O —16 Na —23 Mg —24 Al —27 Cl —35.5 第Ⅰ卷(选择题 共 49 分) 一、选择题:(本大题包括 17 小题,每小题 2 分,共 34 分)每小题只有.一.个.. 选项符合题意。 1.对危险化学品要在包装标签上印有警示性标志,氢氧化钠溶液应选用的标志是 A B C D 2.下列各组物质,按单质、化合物、混合物顺序排列的是A.铁、干冰、冰 水混合物 B.氮气、生石灰、小苏打 C.液氯、烧碱、碘酒 D.氯气、空气、漂粉精 3.下列说法中正确的是 A.氯化钾溶液在电流作用下电离成 - 和 Cl B.氧化还原反应的本质是有化合价的升降 C.依据丁达尔效应可将分散系分为溶液、胶体 与浊液 D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 4.下列物质转化关系中,需要加入氧化剂才能实现的是 - 2+ 2+ 3+ - A.Na2O2 →O2 B.MnO4 →Mn C.Fe → Fe D.CO2→HCO3 5.用 NA 表示阿伏伽德罗常数的值,下列说法正确的是 A.在标 准状况下, 11.2 L H 2O 中含有的分子数为 0.5 N A B.32 g O 2 所含的原子数为 2 N A C .1 mol/L NaCl 溶液中含有的 Na 的数为 NAD.1 mol Na 2O2 中离子总数为 4 N A 6.下列属于电解质的是 A.NaCl 溶液 B.蔗糖 C.CuSO4·5H2O D.CO2 7.“纳米材料”是粒子直径为 1~ 100 nm(纳米)的材料,纳米碳就是其中的一 种。若将纳米碳均匀 地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能透过滤纸 ④不能透过滤纸 ⑤能产生丁达尔效应 ⑥静置后,会析出黑色沉淀 A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥ 8.下列操作正确的是 A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 B.金属钠着火时,立即用水灭火 C.蒸发操作时,应使混合物中 的水分完全蒸干后,才能停止加热 + + 2 D.用托盘天平称取 5.85 g NaCl 固体 9.下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是 + + - 2- 2+ + 2- 2- A.Na、 、Cl 、CO3 B.Cu 、Na 、SO4 、CO3 2+ + - 2- + + - - C.Ba 、 、Cl 、SO4 D. 、Na、HCO3 、NO3 10.下列离子方程式的书写正确的是 2- A.实验室用大理石和稀盐酸制取 CO2:CO3 +2H = CO2↑+ H2O + - B.向 H2O 中加入 Na2O2 固体: 2Na2O2+2H2O= 2 Na+2OH +2O2↑ - C.氯气与水反应: Cl 2+H2O= 2H +Cl - + ClO - - D.SiO2 与 NaOH 溶液反应: SiO2+2OH = SiO3 +H2O 11.下列有关物质的性质或用途的说法中,正确的是 ① 氯气具有漂白性, 可以使有色布条褪色 ② 明矾在水中能生成 Al(OH) 3 胶体, 可用作净水剂 ③ Si 可用于制造光导纤维 ④ SiO 2、Na2CO3 和 CaCO3 可用于制玻璃 ⑤ 水玻璃可用于生产防火材料⑥ 铁红常用作红色油漆和涂料 A.①②③⑤ B.②④⑤⑥ C.③④⑤⑥ D.①③④⑥ 12.下列有关实验操作不能..达到相应目的的是 A.干燥 Cl 2 B.分离汽油与食盐溶 液 C.实验室制取少量蒸馏水 D.比较Na2CO3与 NaHC3O的稳 定性 13.下列由相关实验现象所推出的结论正确的是 2- A.向某溶液中加入 BaCl 2 溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有 SO4 B.向某溶液中加入 CCl4,CCl4 层显紫色,证明原溶液中存在 I 2 2- C.向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,则溶液中一定含有 CO3 D.向一定浓度的 Na2SiO3 溶液中通入适量 CO2 气体,出现白色沉淀,说明 H2SiO3 的酸性强于 H2CO3 3+ 2+ 3+ - 14.在含有 Fe 、Fe 、Al 、Cl 的稀溶液中,加入足量的 Na2O2 固体,充分反应后再加入过量的稀盐 酸,溶液中离子数目变化最小的是 3+ - 3+ 2+ - 3+ A.Al 、Cl B.Al C.Fe 、 Cl D.Fe 15.下列说法中正确的是A.单质铝在空气中比较耐腐蚀, 所以铝是不活泼金属 B.铁与水蒸气在高温下的反应产物 为 Fe2O3 和 H2 C.Na2CO3 固 体中含有的少量 NaHCO3,可用加热法除去 D.钠在不同条件下与氧气的反应,产物只得到 Na2O 16.下列说法中不正.确..的是 A.钠保存在石蜡油或煤油中 B .氯水保存在棕色试剂瓶中 C.保存 FeSO4 溶液需加入少量铁粉 D.实验室盛装 NaOH溶液的试剂瓶用玻璃塞 + + + + + + - 3+ + - 3+ 17.某溶液中含有大量的下列离子:离子、 NH4 、Cl 和 Al ,经测定离子、 NH4 、 Cl 和 Al 的物质的 量浓度之比为 2∶ 1∶5∶ 2,则离子可能是 - A.OH D.Ag+ 二、选择题: (本大题包括 5 小题,每小题 3 分,共 15 分)每小题只有一个选项符合题意。 18.某废液中含有 Ba2 、 Ag+和 Cu2+,用 ①Na CO 溶液、② NaOH 溶液、③盐酸三种试剂将它们逐一沉 2 3 淀.并加以分离,加入试剂的正确顺序是 ... A.② - ① - ③ B.① - ②- ③ C.③ - ②- ① D.③ - ①- ② 19.下列关于 CO 和 CO2 说法正确的是 A.质量相等时,分子数之比 7∶11 B .同温同压下,密度之比 7∶11 C. 物质的量相同时,体积之比 1∶ 1 D .原子数相同时,物质的量之比 2∶ 3 20.下列说法中正确的是A.摩尔是化 学上常用的一个物理量 B.0.5 mol Na 2CO3 中含有的 Na 的数目是 3.01 ×10 C.瓦斯中甲烷与氧气的质量比为 1∶ 4 时极易爆炸,此时其体积比(相同条件下)为 1∶ 2 D.相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之 比是 1∶ 3 21.将 NaOH 溶液逐滴加入到用盐酸酸化的 AlCl 3 溶液中,若用 y 轴表示 Al(OH) 3 沉淀的量, x 轴表示 NaOH 溶液的体积,下列图象正确的是 A B C D 22.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配 平): - MnO 4 + Fe 2+ + H = Mn 2+ 3+ Fe H 2O 下列说法正确的是 - 3+ 2+ 2+ A.MnO4 是氧化剂, Fe 是还原产物 B .Mn 的还原性强于 Fe C.离子方程式中按物质顺序的化学计量数是: 1、5、 8、1、 5、4 D.生成 1 mol 水时,转移 2.5 mol 电子 第Ⅱ卷(非选择题 共 51 分) 三、填空题(本题包括 2 个小题,共 12 分): 23.(6 分)分析下列反应: 3S+6 OH = 2 2S+ 2SO3+ 3H2O,据此作答: ( 1)用双线桥标出该反应中电子的转移方向和数目: 3S +6 OH = 2 2S+ 2SO3+3H2O ( 2)该反应的氧化产物是 。 ( 3)该反应的氧化剂与还原剂的质量比是 。 (4)当消耗 0.3 mol S 时,则转移的 电子数是 。 -B.Na+ C.NO3 23 24.(6 分)电子工业常用 30%的 FeCl 3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用 FeCl 3溶 液做腐蚀液与 Cu 反应生成 CuCl2 和 FeCl 2。 ( 1)写出该反应的化学方程式 。 ( 2)印刷电路的废腐蚀液含有大量 CuCl 2、FeCl2 、FeCl 3,任意排放会造成环境污染及资源的浪费。 通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为 FeCl 3 溶液,作为腐蚀液原料循环使用。 Ⅰ、步骤②需加入的试剂 A 是 (填化学式) ; Ⅱ、步骤③通入的气 体 B 是 (填化学式) ,写出该反应的离子方程式: 四、实验、探究题(本大题包括 2 个小题,共 18 分) 25.(9 分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: ( 1)该浓盐酸的物质的量浓度为 mol/L 。 盐 酸 ( 2)某学生欲用上述浓盐酸和蒸馏水配制 250 mL 物质的量浓度 为 0.7 mol/L 稀盐酸。 ①该学生用量筒量取 mL 上述浓盐酸进行配制; ②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还 分子式: HCl 相对分子质量: 36.5 密度: 1.2g/cm 3 HCl 质量分数: 36.5% ③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。 A、用量筒量取浓盐酸时俯视凹液面 B、未恢复 到室温就将溶液注入容量瓶并进行定容 C、容量 瓶用蒸馏水洗后未干燥D、定容时仰视液面 E、未洗涤烧杯和玻璃棒 ( 3)若在标准状况下,将 a L HCl 气体溶于 1 L 水中,所得溶液密度为 d g/mL ,则此溶液的物质的 量浓度为 mol/L 。 a. 36.5a b. 1000ad 22.4(a c. ad 1)d 36.5a d. 1000ad 22.4 36.5a 22400 36.5a 22400 26.(9分)某学习小组设计了如图所示的实验方案来制取次 氯酸钠和探究氯水的性质。 图中:①为氯气发生装置;②试管里盛有 15 mL 8% NaOH 溶 液,并置于冰水浴中;③试管里是滴有酚酞的 NaOH 溶液;④为尾 气吸收装置。请填写下列空白: ( 1)实验前必须对整套装置进行的操作是 ; ( 2)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加查看更多