- 2021-04-17 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年江苏省无锡市高二下学期期末考试 化学(Word版)
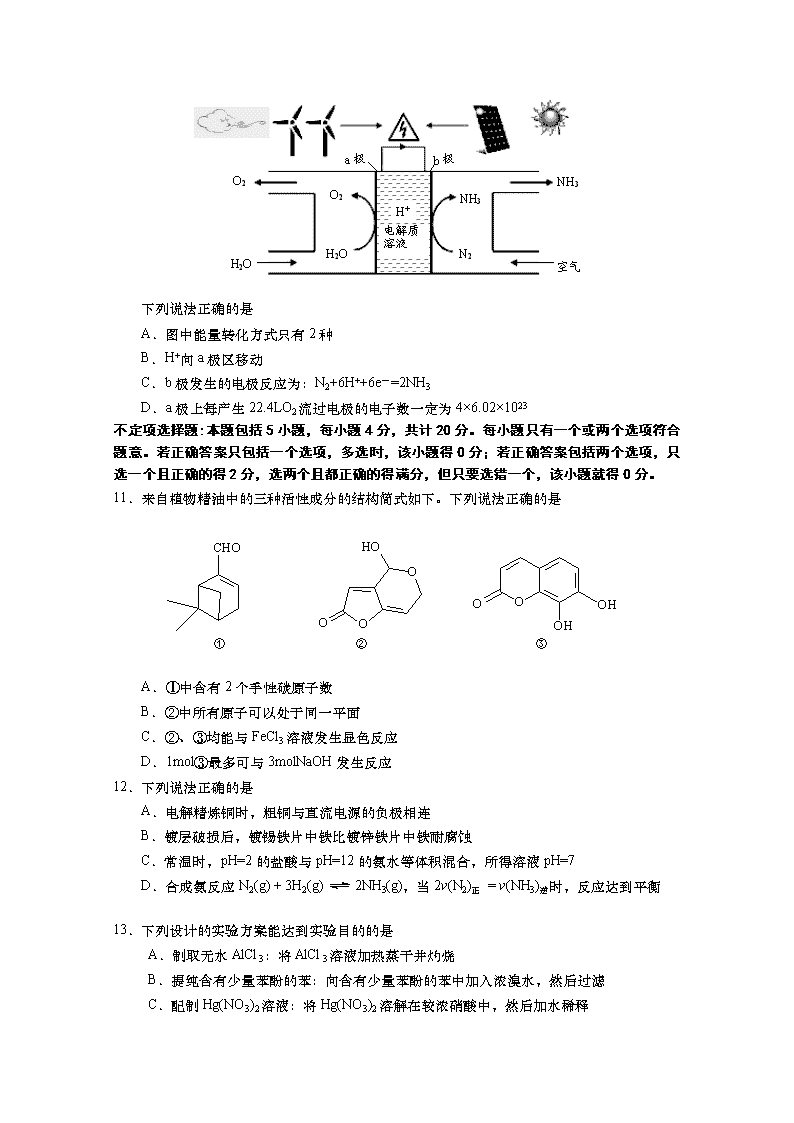
2017-2018学年江苏省无锡市高二下学期期末考试 化 学 试 题 选 择 题 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1.化学与生产生活密切相关。下列做法有利于环境保护和可持续发展的是 A.大量生产和销售超薄塑料购物袋,方便日常生活 B.大力推广新能源汽车,建设绿色低碳的交通体系 C.将废铅蓄电池拆解后的铅泥和废硫酸作深埋处理 D.加大煤、石油等化石能源的开采,满足发展需求 2.下列有关化学用语表示正确的是 A.甲苯的结构简式:C7H8 B.钢铁吸氧腐蚀正极的电极反应式:O2+2H2O+4e-=4OH- C.碳酸的电离方程式:H2CO3 = H+ + HCO3- D.Na2S溶液中S2-水解的离子方程式:S2-+2H2O H2S +2OH- 3. 下列反应中H>0,S>0的是 A.CaCO3 (s)= CaO(s) + CO2(g) B.NH3(g) + HCl(g) = NH4Cl(s) C.4Fe(OH)2(s)+O2(g)+2H2O(l) =4Fe(OH)3(s) D.任何温度下均能自发进行2H2O2(l) = 2H2O(l) +O2(g) 4.下列有关物质的性质与用途具有对应关系的是 A.FeCl3溶液具有酸性,可用于脱除燃气中H2S B.苯酚能使蛋白质变性,可用于制取酚醛树脂 C.FeS固体呈黑色,可用于除去废水中Cu2+、Hg2+等重金属 D.NaHCO3能与Al2(SO4)3溶液反应,可用作泡沫灭火器原料 5.苯与Br2发生取代反应时能量与反应进程如下图所示。下列说法正确的是 反应进程 能量 45.2kJ/mol (中间体) ② ① A.①、②两步均放出能量 B.FeBr3可以改变反应的焓变 C.FeBr3不能改变反应的活化能 D.FeBr3可以加快该反应速率 6.下列指定反应的离子方程式正确的是 A.Cl2通入水中:Cl2 + H2O H+ + Cl-+HClO B.CaCO3加入醋酸中:CO+ 2H+ = CO2↑ + H2O C.用惰性电极电解MgCl2溶液:2Cl-+2H2O H2↑+ Cl2↑ +2OH- D.酸性KMnO4溶液滴入FeSO4溶液中:MnO+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O 7.下列说法正确的是 A.糖类、油脂和蛋白质均是天然高分子 B.C4H9Cl与C4H10O均只有4种同分异构体 C.盐析可提纯蛋白质并保持其生理活性 D.石油裂解可得到苯、甲苯、二甲苯及苯酚 8.依据下列热化学反应方程式作出的判断正确的是 ① CH4(g) + O2(g)= CO (g)+ 2H2O(g) H1 = a kJ·mol-1 ② CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g) H2 = b kJ·mol-1 ③ C (s)+ O2 (g) = CO (g) H3= c kJ·mol-1 ④ H2 (g)+ O2 (g)=H2O (l) H4 =d kJ·mol-1 A.a>b B.a + c<b C.2CO (g)+O2 (g) =2CO2 (g)的H =(b-a)kJ·mol-1 D.CO (g) + H2O (g)=CO2 (g)+H2 (g)的H =(b-a-d)kJ·mol-1 9.向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应2CO(g)+2NO(g)2CO2(g)+N2(g) H<0,直至达平衡。下列说法错误的是 编号 条件 起始物质的量/mol 温度/℃ 容积或压强 CO(g) NO (g) CO2 (g) N2 (g) ① 600 维持恒容 0.2 0.2 0 0 ② 700 维持恒容 0.1 0.1 0.1 0.05 ③ 600 维持恒容 0.4 0.4 0 0 ④ 600 维持恒压 0.4 0.4 0 0 A.平衡时N2的浓度:①>② B.平衡时CO的正反应速率:①<② C.NO的平衡转化率:③>① D.平衡时容器内气体总压:④>③>①>② 10.2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示: 空气 NH3 NH3 N2 O2 H2O O2 H2O a极 b极 H+ 电解质 溶液 下列说法正确的是 A.图中能量转化方式只有2种 B.H+向a极区移动 C.b极发生的电极反应为:N2+6H++6e-=2NH3 D.a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.来自植物精油中的三种活性成分的结构简式如下。下列说法正确的是 A.①中含有2个手性碳原子数 B.②中所有原子可以处于同一平面 C.②、③均能与FeCl3溶液发生显色反应 D.1mol③最多可与3molNaOH发生反应 12.下列说法正确的是 A.电解精炼铜时,粗铜与直流电源的负极相连 B.镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀 C.常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7 D.合成氨反应N2(g) + 3H2(g)2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡 13.下列设计的实验方案能达到实验目的的是 A.制取无水AlCl3:将AlCl3溶液加热蒸干并灼烧 B.提纯含有少量苯酚的苯:向含有少量苯酚的苯中加入浓溴水,然后过滤 C.配制Hg(NO3)2溶液:将Hg(NO3)2溶解在较浓硝酸中,然后加水稀释 D.除去MgCl2溶液中混有的少量FeCl3:向混有FeCl3的MgCl2溶液中加入足量MgCO3,微热并充分搅拌,然后过滤 14.H2C2O4为二元弱酸。常温下0.1mol·L-1 NaHC2O4溶液(pH约为4)中指定微粒的物质的量浓度关系错误的是 A.c(Na+)= c(HC2O)+c(C2O)+c(H2C2O4) B.c(HC2O4-)>c(H2C2O4)>c(C2O) C.c(Na+)+c(H+)= c(HC2O)+ c(C2O)+c(OH-) D.c(H2C2O4)+c(H+) = c(C2O)+c(OH-) ● 0 N 1000 1200 1400 1600 1800 裂解温度/K 平衡时物质的量分数 M ● H2S H2 S2 15.硫化氢裂解制取氢气的反应为2H2S(g)2H2(g)+S2(g)。向恒容密闭容器中充入一定量的H2S气体,测得体系中气体的平衡组成与温度的关系如右图所示。下列说法正确的是 A.该反应平衡常数随温度升高而增大 B.M点时容器内气体总压强比N的大 C.M点时,H2S的平衡转化率为50% D.维持M点温度不变,向容器中再充入0.2molH2S、 0.2molH2、0.1molS2(g),则v(正) = v(逆) 非选择题 16.(12分)回答下列问题: (1)用“>”或“<”填写下表。 第一电离能 熔点 沸点(同压) 键能 P ▲ S MgO ▲ CaS CF4 ▲ SiCl4 H-Cl ▲ H-Br (2)一种制取NH2OH的反应为2NO2-+4SO2 + 6H2O+ 6NH3 = 4SO+6NH4++2NH2OH。 ①N、H、O的电负性从小到大的顺序为 ▲ 。 ②NH3分子的空间构型为 ▲ 。 ③NH2OH极易溶于H2O,除因为它们都是极性分子外,还因为 ▲ 。 (3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为 ▲ (不考虑空间构型)。 17.(15分)化合物I是一种用于制备抗高血压药物阿替洛尔的中间体。其合成路线流程图如下: (1)I中含氧官能团名称是 ▲ 和 ▲ 。 (2)B→C的反应类型是 ▲ 。 (3)已知B的分子式为C9H10O2,写出B的结构简式: ▲ 。 (4)写出同时满足下列条件的E的一种同分异构体的结构简式: ▲ 。 ①含有二个苯环; ②能与NaHCO3反应生成CO2; ③分子中有5种不同化学环境的氢。 (5)以流程图中化合物A为原料可通过四步转化制备化合物。请用课本上学过的知识在横线上补充①~④的反应试剂和反应条件(样式:)。 (6)请写出以C2H5OH和为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 18.(12分)FeCl3蚀刻液由FeCl3和盐酸等组成,可用于蚀刻铜及铜合金等。 (1)加入盐酸可抑制Fe3+及生成的Cu2+的水解, Fe3+水解的离子方程式为 ▲ 。 (2)FeCl3溶液蚀刻铜的化学方程式为 ▲ 。 (3)测定某废蚀刻液中Cu2+含量的实验步骤如下:量取25.00mL废蚀刻液,加入足量的NH4HF2(掩蔽Fe3+,消除干扰 2l����������������������������������������������������������������������������������������������������������������������������),加入稍过量KI溶液(2Cu2++4I-=2CuI↓+ I2),在暗处静置5min,然后用0.02000mol·L-1Na2S2O3标准溶液滴定(I2+2S2O=2I-+S4O),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。 ①不加NH4HF2会导致测得的铜的含量 ▲ (填:“偏高”“偏低”或“不变”)。 ②通过计算确定该废蚀刻液中铜的含量(单位g·L-1,写出计算过程)。 19.(15分)醋酸是常见的弱酸,氨水是常见的弱碱。 (1)25℃时,用0.1000mol·L-1盐酸滴定25.00mL0.1000mol·L-1氨水的滴定曲线如题19图-1所示。 题19图-1 A V(HCl)/mL pH pH=5.12 pH=9.24 反应终点 ● ● a b c 12.5 ①滴定时,可选用 ▲ (填“甲基橙”或“酚酞”)作指示剂; 锥形瓶中水的电离程度: a点 ▲ b点(填“>”“<”或“=”)。 ②滴定至反应终点前,溶液中发生反应的离子方程式为 ▲ 。 ③滴定至a点处,锥形瓶中NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为 ▲ 。 ④滴定至c点处,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为 ▲ 。 题19图-2 2.88 4.75 7.0 8.87 a b d ● c ● ● ● pH 浓度对数值 (2)25℃时,用HCl或NaOH调节醋酸的pH,配得一组c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1溶液,溶液中H+、OH-、CH3COO-及CH3COOH浓度的对数值(lgc)与pH关系如题19图-2所示: ①图中表示H+的线是 ▲ (填小写字母);0.1 mol·L-1CH3COONa溶液的pH约为 ▲ (保留2位小数)。 ②反应CH3COOHCH3COO-+ H+的电离常数的对数值lgK= ▲ (填数值)。 20.(14分)镉(Cd)是一种用途广泛的金属,也是对人体健康威胁最大的有害元素之一。 (1)1.00gCdS固体完全燃烧生成CdO固体和SO2气体放出2.75kJ的热量,该反应的热化学方程式为 ▲ 。 (2)常温下,Ksp(CdCO3) = 4.0×10-12,Ksp[Cd(OH)2] = 3.2 ×10-14,则溶解度(mol·L-1)较大的是 ▲ [填“CdCO3”或“Cd(OH)2”];若向含112mg·L-1 Cd2+的废水加碱调pH至9.0,达到平衡时,溶液中c(Cd2+)= ▲ 。 (3)一种鳌合絮凝剂的制备及其用于去除含镉废水中Cd2+的原理如下: ①聚丙酰胺的单体的结构简式为 ▲ 。 ②使用鳌合絮凝剂处理某含镉废水,镉去除率与pH的关系如题20图-1所示。在强酸性条件下,pH越小除镉效果越差,其原因是 ▲ 。 pH 镉去除率/% 量筒 溢流 万用表 铁粉 活性炭 污染 土壤 题20图-1 题20图-2 (4)一种用电动力学修复被镉污染的土壤的装置如题20图-2所示。 ①实验前铁粉需依次用NaOH溶液、稀硫酸及蒸馏水洗涤,其目的是 ▲ 。 ②实验过程中铁粉上发生的电极反应为 ▲ 。 ③活性炭的作用是 ▲ 。 21. (12分) 碳酸乙烯酯广泛用作电池电解质、酯类合成的中间体等。一种由CH2=CH2、CO2及O2为原料,在铁、铜及碘化物催化下的制备碳酸乙烯酯的反应如下: (1)Fe2+基态核外电子排布式为 ▲ 。 (2)写出一种与CO2互为等电子体的阴离子: ▲ 。 (3)碳酸乙烯酯中碳原子杂化轨道类型为 ▲ ;1mol碳酸乙烯酯分子中含键数目为 ▲ 。 (4)FeO晶胞结构如题21图-1所示,晶体中与每个Fe2+紧邻的Fe2+有 ▲ 个;一种由Sn、Cu、Fe及S组成的化合物的晶胞结构如题21图-2所示。该化合物的化学式为 ▲ 。 题21图-1 题21图-2 化学参考答案 单项选择题:本题包括10 小题, 每小题2 分, 共计20 分。 1.B 2.B 3.A 4.D 5.D 6.A 7.C 8.A 9.D 10.C 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.A 12.D 13.CD 14.BC 15.AC 16.(12分) (1)> > < >(共4分,每空各1分) (2)①H N O(2分) ②三角锥(2分) ③NH2OH与H2O之间可以形成氢键(2分) (3)(2分) 17.(15分) (1)醚键(1分) 羧基(1分) (2)取代反应(1分) (3)(1分) (4)(2分) (5)(共4分,每空各1分) (6) (5分) 18.(12分) (1)Fe3++3H2O Fe(OH)3+3H+(2分) (2)2FeCl3 + Cu = 2FeCl2 + CuCl2(2分) (3)①偏高(2分) ② 2Cu2+ ~ I2 ~2S2O32- n(Cu2+)=0.02000mol·L-1×20.00mL×10-3L·mL-1=4.000×10-4mol(2分) m(Cu2+)=4.000×10-4mol×64g·mol-1=2.560×10-2g(2分) 含量为:=1.024g·L-1(2分) 19.(15分) (1)①甲基橙(1分) <(2分) ②NH3·H2O + H+= NH4++ H2O(2分) ③c(NH3·H2O) <c(Cl-) <c(NH4+)(2分) ④c(NH4+) <c(H+)<c(Cl-) (2分) (2)①c(2分) 8.87(2分) ②-4.75(2分) 20.(14分) (1)2CdS(s) + 3O2(g) = 2CdO(s) +2SO2(g) ΔH =-792kJ·mol-1(2分) (2)Cd(OH)2(2分) 3.2×10-4 mol·L-1(2分) (3)①CH2=CHCONH2(1分) ②H+与-NH2及-NH-上的氮原子结合,抑制了鳌合絮凝剂的活性(2分) (4)①除去铁粉表面油污和铁锈(2分) ②Fe -2e-= Fe2+(1分) ③作电池正极并吸附迁移至该极周围的Cd2+等阳离子(2分) 21.(12分) (1)[Ar]3d6 或1s22s22p63s23p63d6(2分) (2)N3-、SCN-等(2分) (3)sp2和sp3 (2分) 10mol或6.02×1024(2分) (4)12(2分) SnCu2FeS4(2分)查看更多