2017-2018学年河南省商丘市第一高级中学高二下学期期末考试化学试题(Word版)
商丘一高2017—2018学年第二学期期末考试
高二化学试卷
命题人 :张军凯 审题人 :李慧
说明:
1、本份试卷满分100分,考试时间90分钟。答案请写到答题卷的相应位置,写在试卷上不得分。
2、共20题:Ⅰ卷选择题共16小题,每小题3分,共48分,每小题只有一个选项符合题目要求;Ⅱ卷共4大题,共52分。
3、可能用到的原子量:H-1 O-16 Na-23 S-32 Ag-108 Cu-64
第Ⅰ卷 选择题(共54分)
一、选择题:(每小题只有一个选项符合题意,共18小题,每小题3分)
1.对中国古代著作涉及化学的叙述,下列解读错误的是
A. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B. 《黄白第十六》中“曾青涂铁,铁赤如铜”,“曾青”是指可溶性铜盐
C. 《天工开物》中“凡石灰,经火焚炼用”里的“石灰”指的是Ca(OH)2
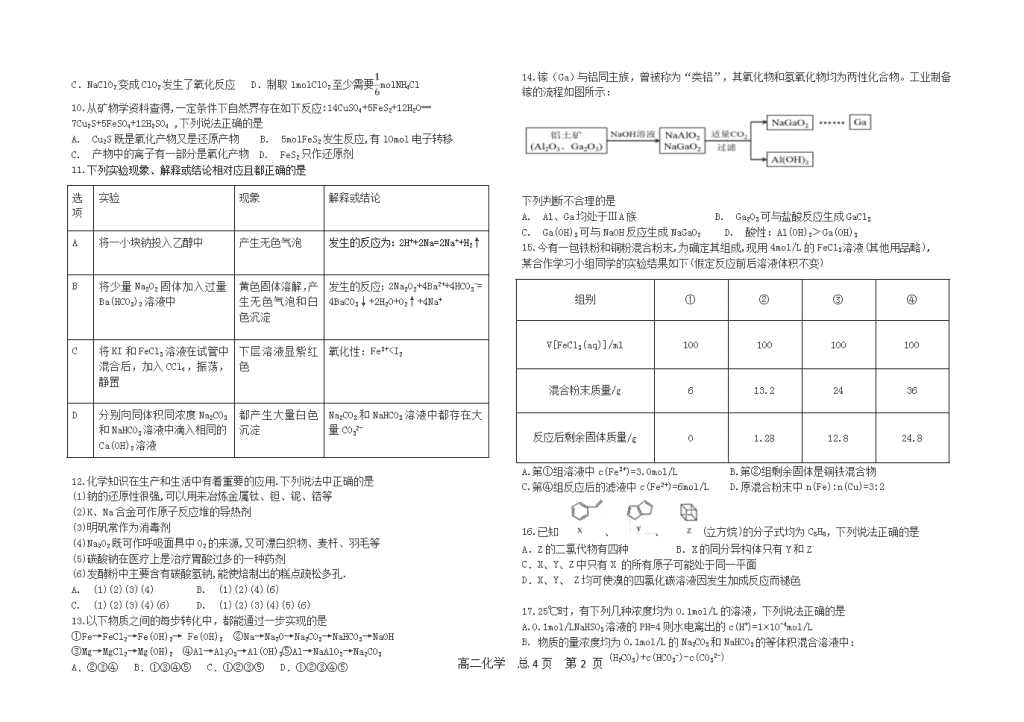
D. 《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油
2.向胶体中加入电解质能使胶体发生聚沉。使一定量的胶体在一定时间内开始聚沉所需电解质的浓度称作“聚沉值”,电解质的“聚沉值”越小其凝聚力越大;实验证明,凝聚力主要取决于和胶粒带相反电荷的离子所带的电荷数。某胶体遇氯化镁溶液或石膏水易发生聚沉,而遇食盐水或Na2SO4溶液不易发生聚沉,则下列有关说法正确的是
A.Na+使此胶体发生聚沉的“聚沉值”等于Ca2+、Mg2+
B.该胶体分散质微粒带正电荷
C.该胶体遇氯化钡溶液或Fe(OH)3胶体可发生聚沉
D.该胶体的微粒直径为10—7cm~10—9cm
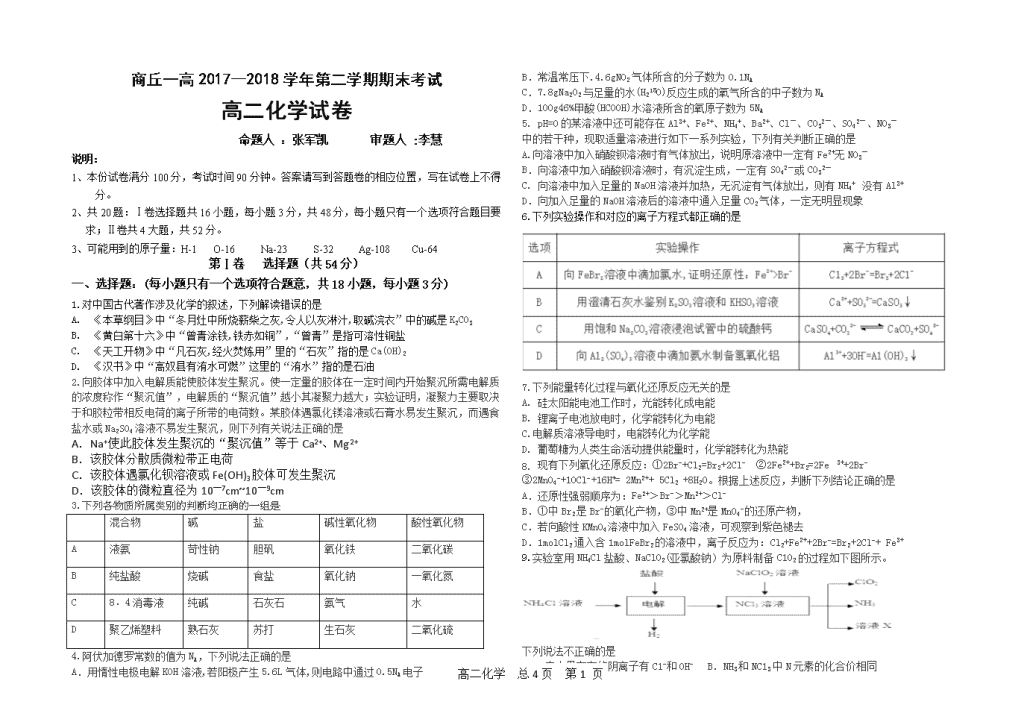
3.下列各物质所属类别的判断均正确的一组是
混合物
碱
盐
碱性氧化物
酸性氧化物
A
液氨
苛性钠
胆矾
氧化铁
二氧化碳
B
纯盐酸
烧碱
食盐
氧化钠
一氧化氮
C
8﹒4消毒液
纯碱
石灰石
氨气
水
D
聚乙烯塑料
熟石灰
苏打
生石灰
高二化学 总4页 第1 页
二氧化硫
4.阿伏加德罗常数的值为NA,下列说法正确的是
A.用惰性电极电解KOH溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
B.常温常压下.4.6gNO2气体所含的分子数为0.1NA
C.7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为NA
D.100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
5. pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-
中的若干种,现取适量溶液进行如下一系列实验,下列有关判断正确的是
A.向溶液中加入硝酸钡溶液时有气体放出,说明原溶液中一定有Fe2+无NO3-
B.向溶液中加入硝酸钡溶液时,有沉淀生成,一定有SO42-或CO32-
C. 向溶液中加入足量的NaOH溶液并加热,无沉淀有气体放出,则有NH4+ 没有Al3+
D.向加入足量的NaOH溶液后的溶液中通入足量CO2气体,一定无明显现象
6.下列实验操作和对应的离子方程式都正确的是
7.下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化为电能
C.电解质溶液导电时,电能转化为化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化为热能
8. 现有下列氧化还原反应:①2Br−+Cl2=Br2+2Cl− ②2Fe2++Br2=2Fe 3++2Br−
③2MnO4−+10Cl−+16H+= 2Mn2++ 5Cl2 +8H2O。根据上述反应,判断下列结论正确的是
A.还原性强弱顺序为:Fe2+﹥Br−﹥Mn2+﹥Cl−
B.①中Br2是Br−的氧化产物,③中Mn2+是MnO4−的还原产物,
C.若向酸性KMnO4溶液中加入FeSO4溶液,可观察到紫色褪去
D.1molCl2通入含1molFeBr2的溶液中,离子反应为:Cl2+Fe2++2Br−=Br2+2Cl−+ Fe3+
9.实验室用NH4Cl盐酸、NaClO2(亚氯酸钠)为原料制备C1O2的过程如下图所示。
下列说法不正确的是
A.X中大量存在的阴离子有C1-和OH- B.NH3和NC13中N元素的化合价相同
C.NaClO2变成ClO2发生了氧化反应 D.制取lmolClO2至少需要molNH4Cl
10.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4 ,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物 B. 5molFeS2发生反应,有l0mol电子转移
C. 产物中的离子有一部分是氧化产物 D. FeS2只作还原剂
11.下列实验现象、解释或结论相对应且都正确的是
选项
实验
现象
解释或结论
A
将一小块钠投入乙醇中
产生无色气泡
发生的反应为:2H++2Na=2Na++H2↑
B
将少量Na2O2固体加入过量Ba(HCO3)2溶液中
黄色固体溶解,产生无色气泡和白色沉淀
发生的反应:2Na2O2+4Ba2++4HCO3-=
4BaCO3↓+2H2O+O2↑+4Na+
C
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+
② > ① > ④
B.在KHS溶液中有:c(H+) +c(K+) =c(OH-) +c(HS-) +c(S2-)
C.c(H2S)从大到小的顺序是:① > ④ > ③ > ②
D.在H2S和KHS混合溶液中有:c(H2S) +c(HS-) +c(S2-) = 2c(K+)
第Ⅱ卷 非选择题(共46分)
二. 填空题(每空2分)
19.黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2作__________(填“催化剂”“氧化剂” 或“还原剂”,下同)。该转化过程中NO的作用是________。
②写出图1中Fe3+与FeS2反应的离子方程式:________________________。
(2)FeS2氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2 所示。
①加入NaNO2 发生反应:2H++3NO2-=NO3-+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为________mol。
②加入NaNO2、KI 发生反应:4H++2NO2-+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__________________。
20.甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g) CO(g)+3H2(g) △H>0
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4
H2O
CO
H2
3.0 mol·L-1
8.5 mol·L-1
2.0 mol·L-1
2.0 mol·L-1
(1)则此时正、逆反应速率的关系是V正__________V逆。(填“>”“<”“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号
温度/℃
压强/kPa
CH4初始浓度/mol·L-1
H2O初始浓度/ mol·L-1
1
360
P
2.00
6.80
2
t
101
2.00
6.80
3
360
101
2.00[]
6.80
(2)表中t=_________,P=_________;设计实验2、3的目的是____________;
实验l、2、3中反应的化学平衡常数的大小关系是_____(用K1、K2、K3表示)
(3)—定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物, 一段时间后达到平衡。
容器
甲
乙
反应物投入量
1molCH4、 1molH2O
amolCH4、 amolH2O、b molCO、 c molH2
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率v(H2)=__________,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________________。
21. 我国每年产生的废旧铅蓄电池约330万吨,从含铅废料(PbSO4、PbO2、PbO等)中回高二化学 总4页 第3 页
收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:
(1)铅蓄电池放电时,PbO2作_______极。
(2)过程 I ,己知:PbSO4、PbCO3的溶解度(20℃)见图 1; Na2SO4、Na2CO3的溶解度见图2。
①根据图1写出过程I的离子方程式:_____________。
②生产过程中的温度应保持在40℃。若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低; ii._____________(请你提出一种合理解释)。
(3)过程 II,发生反应 2PbO2 + H2C2O4=2PbO + H2O2 + 2CO2↑。PbO与 Al2O3性质相似,PbO与氢氧化钠溶液反应的离子方程式是________________。
(4)过程Ⅲ,将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液。电解Na2PbCl4溶液,生成Pb,如下图:
①阴极的电极反应式是____________。
②电解一段时间后,Na2PbCl4浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______________。
22.Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
]
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:____。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_____(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间B.用小试管收集气体并检验其纯度
C.关闭K1 D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____。(填“偏大”“偏小”或“不变”)
高二化学 总4页 第4页
商丘一高2017—2018学年第二学期期末考试
高二化学参考答案
一.选择题(每题3分,共54分)
题号
1
2
3
4
5
6
7
8
9
答案
C
C
D
D
A
C
A
C
B
题号
10
11
12
13
14
15
16
17
18
答案
C
B
B
C
D
C
C
B
D
二.填空题(,共46分)
19.(共10分)
(1)还原剂(2分)、催化剂(2分)、14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+ (2分)
(2) 4(2分)、 生成的催化剂NO更多,加快了反应速率。(2分)
20.(共12分)
(1) > (2分)(2) 480 (1分) 、 303(1分) 探究温度对化学反应速率的影响 (2分) K1=K3
查看更多