- 2021-02-26 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专题空气氧气水
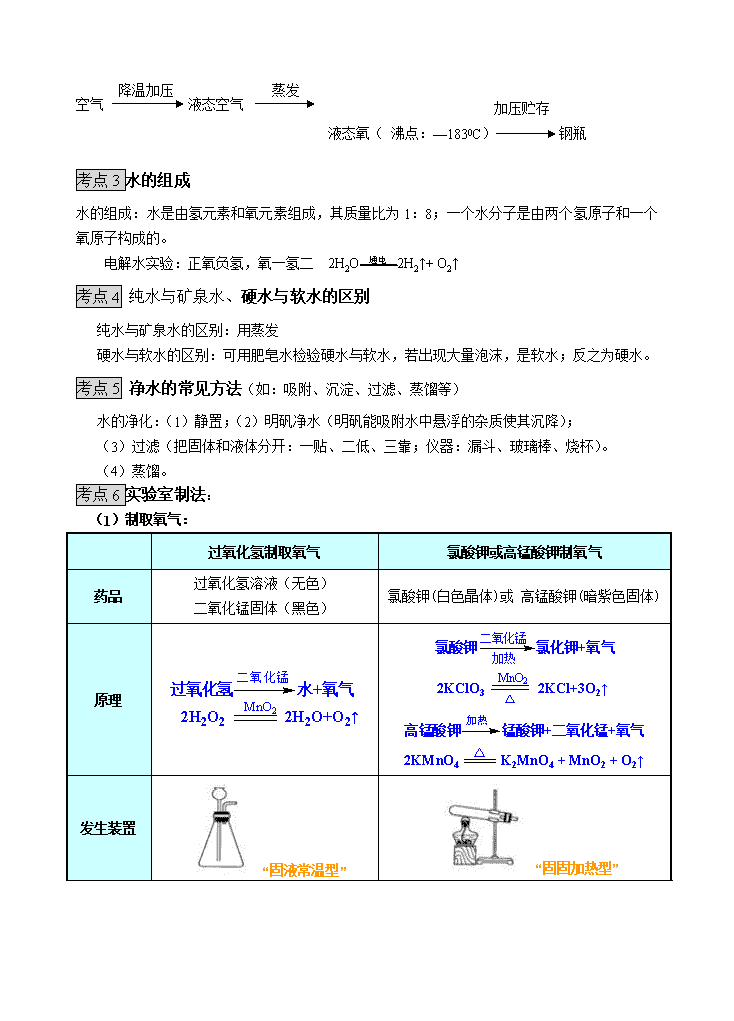
中考化学专题-----空气、氧气、水 【知识梳理】 考点1 空气成分: 1、空气的组成: 空气成分 氮气 氧气 二氧化碳 稀有气体 其他气体及杂质 体积分数 2、氮气和稀有气体的主要性质及主要用途: 氮气(N2) 稀有气体(He Ne Ar Kr Xe等) 物理性质 通常状况下: 色、 味的气体, 溶于水。 通常状况下: 色、 味的气体。 化学性质 ⑴ ⑴常湿下稳定。 ⑵一定条件下可与氢气、氧气等物质反应。 很稳定,很难与其它物质反应,故又称 气体。 用途 ①保护气;②制硝酸和氮肥等。 ①保护气;②霓虹灯、航标灯等。 3、空气中氧气含量的测定 ⑴实验原理及方法:红磷在密闭容器中燃烧,消耗 氧气 ,生成 黑色 固体。密闭容器内压强 ,大气压将水压入密闭容器,通过测定进入容器中的 的量来测定氧气在空气中的体积分数。 ⑵实验现象:红磷 ,生成大量 ,水进入原容器,且水的体积约占原容器体积的 。 ⑶实验失败的主要原因: a、红磷的量 ;b、装置 ;c、装置未冷却到室温。 ⑷实验讨论: ①不能用木炭、硫粉代替红磷做上述实验,原因是 。 ②进入瓶中水的体积一般小于瓶内空间1/5的可能原因是: 。 如果大于1/5可能原因? 。 考点2氧气 ①氧气的主要物理性质和用途 物理性质:氧气是一种没有颜色,没有气味的气体,密度比空气略大,不易溶于水。 用途:供给呼吸,作为助燃剂,氧化剂。 ②氧气的化学性质: 氧气能与许多物质发生氧化反应 ;氧化反应:物质与氧发生的化学反应。 氧气与几种物质反应的实验现象及化学方程式: 物质 实验现象(在O2中燃烧) 化学方程式 注意 木炭 ⒈发出白光 ⒉放出热量 3.生成使澄清石灰水变浑浊的气体 C + O2 点燃 CO2 盛有木炭的燃烧匙应由上而下慢慢伸入瓶中 硫 ⒈发出蓝紫色火焰(在空气中燃烧发出淡蓝色火焰) ⒉放出热量 ⒊生成有刺激性气味的气体 S + O2 点燃 SO2 硫的用量不能过多,防止空气造成污染,用氢氧化钠溶液可以吸收生成的二氧化硫。 红磷 (暗红) 1.产生大量白烟 2.放出热量 3.生成白色固体 4P + 5O2 点燃 2P2O5 此反应生成的P2O5为白色固体,现象应描述为白烟 镁条 1.发出耀眼的白光 2.放出大量的热量 3.生成白色固体 2Mg + O2 点燃 2MgO 用石棉网承接生成物,以免烫坏实验台。 铁丝 1.剧烈燃烧,火星四射 2.生成黑色固体 3.放出大量的热量 3Fe + 2O2 点燃 Fe3O4 ⒈预先放少量水或沙,防止生成物溅落瓶底,炸裂瓶底 ⒉铁丝在空气中不能燃烧 氢气 1.淡蓝色火焰 2.放热 3.水珠附在烧杯内壁上 2H2 + O2 点燃 2H2O 点燃前需验纯 CO 1.蓝色火焰 2.放热 3.生成使澄清石灰水变浑浊的气体 2CO + O2 点燃 2CO2 点燃前需验纯 CH4 1.蓝色火焰 2.放热 3.水珠 4.生成使澄清石灰水变浑浊的气体 CH4 + 2O2 点燃 CO2+2H2O 点燃前需验纯 酒精 1.蓝色火焰 2.放热 3.水珠 4.生成使澄清石灰水变浑浊的气体 CH4+2O2点燃 CO2+2H2O 酒精灯不慎打翻着火用湿抹布盖灭。 ③氧气的工业制法:分离液态空气法(属于物理变化) 氮气(沸点:—196 0C) 加压贮存 空气 降温加压 液态空气 蒸发 液态氧( 沸点:—1830C) 钢瓶 考点3水的组成 水的组成:水是由氢元素和氧元素组成,其质量比为1:8;一个水分子是由两个氢原子和一个氧原子构成的。 电解水实验:正氧负氢,氧一氢二 2H2O 通电 2H2↑+ O2↑ 考点4 纯水与矿泉水、硬水与软水的区别 纯水与矿泉水的区别:用蒸发 硬水与软水的区别:可用肥皂水检验硬水与软水,若出现大量泡沫,是软水;反之为硬水。 考点5 净水的常见方法(如:吸附、沉淀、过滤、蒸馏等) 水的净化:(1)静置;(2)明矾净水(明矾能吸附水中悬浮的杂质使其沉降); (3)过滤(把固体和液体分开:一贴、二低、三靠;仪器:漏斗、玻璃棒、烧杯)。 (4)蒸馏。 考点6实验室制法: (1)制取氧气: 过氧化氢制取氧气 氯酸钾或高锰酸钾制氧气 药品 过氧化氢溶液(无色) 二氧化锰固体(黑色) 氯酸钾(白色晶体)或 高锰酸钾(暗紫色固体) 原理 发生装置 “固液常温型” “固固加热型” 收集方法 a.排水法----因为氧气难溶于水。 b.向上排空气法----因为氧气密度比空气略大(导气管应伸入瓶底,尽量排净空气) 整体装置 操作步骤 检查装置气密性 向试管或锥形瓶中先加入二氧化锰固体,再加入过氧化氢溶液。 用排水法或向上排空气法收集 口诀:"茶庄定点收利息" 1.查:查装置的气密性. 2.装:装药品.用单孔橡皮塞塞紧试管 3.定:固定试管在铁架台上. 4.点:点燃酒精灯,均匀加热. 5.收:收集气体. 6.离:先让导管撤离水槽. 7.熄:熄灭酒精灯. 注意事项 用长颈漏斗时,长颈漏斗末端应在液面一下,否则氧气会从长颈漏斗中逸出。 ①试管口应略向下倾斜,以防止湿存水在反应过程中倒流到管底,使试管破裂. ②导管不可伸入试管太长,以利于氧气排出,防止药品堵塞导管. ③使用高锰酸钾反应时,需在试管口放一小团棉花,以防加热时高锰酸钾粉末进入导管. ④用氯酸钾和二氧化锰适合于制取较多的氧气,但要注意二氧化锰一定要纯净,二氧化如果混有炭粉,制取氧气时就很容易发生爆炸,因此,使用二氧化锰时最好烧灼一下. ⑤药品要平铺在试管底均匀受热. ⑥加热时要使试管均匀受热(预热). ⑦铁夹夹在试管中上部. ⑧停止加热,先把导管撤出,在撤离酒精灯,否则水槽内水会倒流,导致试管爆裂. 检验和验满 检验方法:把带火星的木条伸入集气瓶中,如复燃,则说明是氧气。 验满方法:把带火星的木条放在瓶口,如复燃,则已收满。 【考题精练】 1.(2013•宜宾)空气是一种宝贵的自然资源,下列有关说法中不正确的是( ) A.法国化学家拉瓦锡研究了空气的成分,并得出氧气约占空气总体积4/5的结论 B.空气是由氮气、氧气、稀有气体、二氧化碳等物质组成的混合物 C.氮气是制造硝酸和氮肥的重要原料 D.稀有气体都没有颜色、没有气味,在通电时能发出不同颜色的光 解:A、法国化学家拉瓦锡研究了空气的成分,并得出空气是由氧气和氮气组成的,其中氧气约占空气总体积1/5 的结论,A项的错误在于氧气约占空气总体积4/5,故说法不正确. B、空气是由氮气、氧气、稀有气体、二氧化碳等物质组成的混合物,故说法正确. C、工业上,氮气是制造硝酸和氮肥的重要原料,故说法正确. D、稀有气体都没有颜色、没有气味,化学性质稳定,在通电时能发出不同颜色的光,故说法正确. 故选A. 2.(2013•苏州)实验室制取氧气的装置如图所示,下列有关叙述合理的是( ) A.锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水 B.锥形瓶里加入高锰酸钾固体,分液漏斗里盛放蒸馏水 C.集满氧气的集气瓶从水槽里取出后倒放在桌面上 D.当发生装置中液体与固体一接触产生了气泡即可收集 解:A、该装置是固液在常温下产生氧气,所以使用的药品是双氧水和二氧化锰,锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水,故说法正确; B、用高锰酸钾制取氧气时,需要加热的装置,故说法错误; C、因为氧气的密度比空气大,为了防止氧气逸散,从水槽里盖上玻璃片取出后正放在桌面上,故说法错误; D、用排水法收集氧气的合适时机是:气泡连续均匀冒出时收集,以防收集的氧气不纯,故说法错误; 故选项为:A. 3.对下列实验指定容器中的水,其解释没有体现水的主要作用的是( ) A B C D 实 验 装 置 硫在氧气中燃烧 测定空气中氧气含量 铁丝在氧气中燃烧 探究燃烧的条件 解释 集气瓶中的水:吸收放出的热量 量筒中的水:通过水体积的变化得出O2体积 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 烧杯中的水:加热铜 片;隔绝空气 答案:A 4.(2013.安徽省)2013年“世界水日”和“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”。下列说法正确的是 ( ) A.保护水资源,禁止使用化肥、农药 B.利用沉降的方法,将硬水转化成软水 C.工业废渣的任意排放,不会污染水体 D.城市浇花,使用喷灌、滴灌技术 答案:A 5.(2013.哈尔滨)下列相关事实用微观粒子的知识解释错误的是 ( ) 选项 事 实 解 释 A 墙内开花墙外可嗅到花香 分子不断运动 B 酒精溶液是混合物 由不同种分子构成 C 水结冰后体积变大 水分子体积变大 D 氢氧化钠溶液能导电 溶液中存在自由移动的Na+和OH 答案:C 6.(2013.株洲市)(12分)某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。 (1)写出仪器a的名称: 。 (2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为: ① 。在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口 ,然后稍稍用力把玻璃管插入胶皮管。收集气体前,应将集气瓶装满 并盖上 。收集氧气还可选用的装置是 。 (3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究: [提出猜想]猜想I:反应生成的MnO2分解放出O2; 猜想II:反应生成的K2MnO4分解放出O2; 猜想III:反应生成的K2MnO4和MnO2分解都放出O2。 [实验验证]同学们分成两组,分别进行下列实验: 第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是 。 [拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么? 。 [实验反思]通过以上实验探究,你对“实验室制取氧气”还想探究的问题是 。 答案:(1)锥形瓶 (2)2H2O2 2H2O + O2↑ 用水湿润 水 玻璃片 C (3) I 将带火星的木条伸入试管口,木条复燃 不是 因为KMnO4反应后质量和化学性质都发生了变化 7.(2013•珠海)乙醇俗称酒精,可用作医用消毒,也常作燃料.其完全燃烧的化学方程式可表示为:C2H6O+3O2点燃2CO2+3H2O. (1)23g乙醇完全燃烧需消耗多少克氧气? (2)乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表: 物质 乙醇 氧气 二氧化碳 水 一氧化碳 反应前质量(g) 4.6 8.8 0 0 0 反应后质量(g) 0 0 6.6 5.4 a ①表中a的值为 . ②该实验发生反应的化学方程式为:4C2H6O+11O2 点燃 CO2+ H2O+ CO. 答案: (1) 解:设生成需要氧气的质量为 C2H6O + 3O2 ====2CO2 + 3H2O 46 3 *32 23g X 46:96=23g:X X=48g 答:氧气质量为48g (2) ①1.4 ② 6 12 2查看更多