- 2023-04-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2014年版高考化学二模试题目天津七校
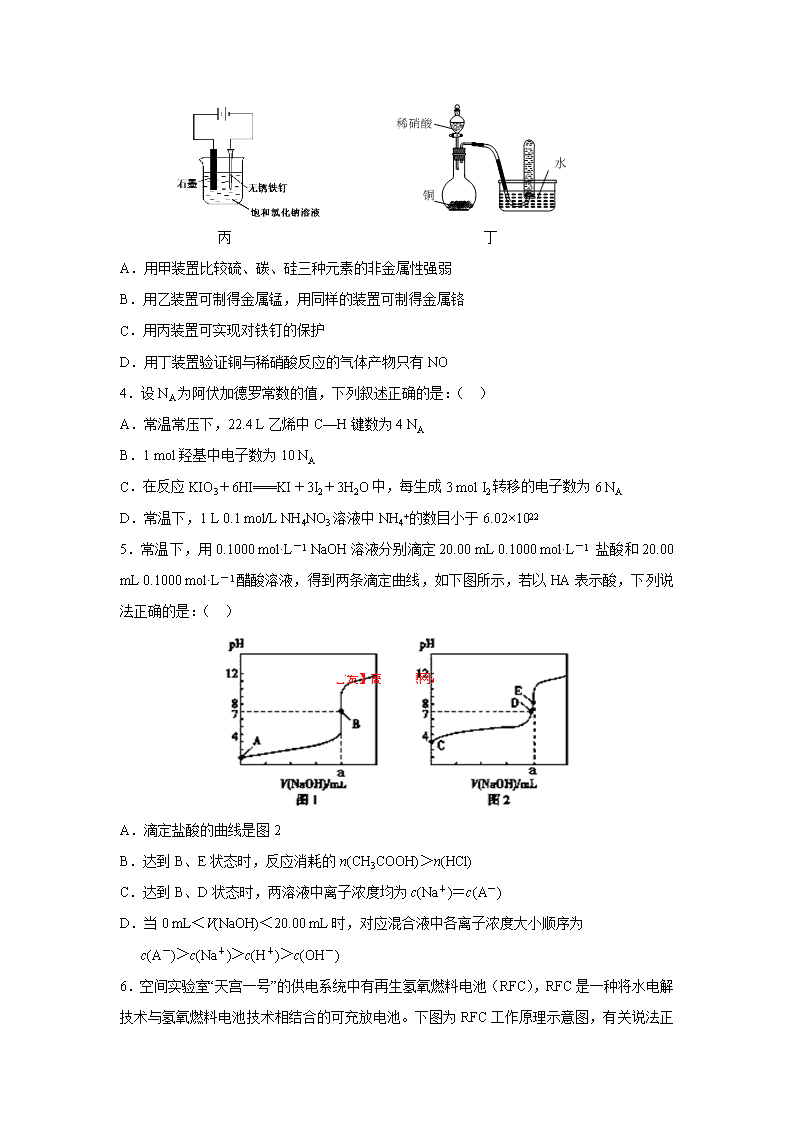
天津市七校2014届高三4月联考 化 学 试 题 化学试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,祝各位考生考试顺利! 以下数据可供解题时参考: 相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 K:39 Fe:56 第Ⅰ卷(选择题 共36分) 本卷共6题,每题6分,共36分。每小题给出的四个选项中,只有一项是最符合题目要求的。 1.化学与社会生活密切相关,下列说法正确的是:( ) A. PM2.5是指空气中直径≤ 2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm = 10 -6 m) B.甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 C.有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 D.亚硝酸钠是有毒物质,不能添加到食物中 2.下列判断错误的是:( ) A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42‾+H++OH‾ ==BaSO4 ↓+H2O B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3 ②NH4Cl ③(NH4)2Fe(SO4)2中 c(NH4+):①<②<③ C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I- 四种离子不能大量共存 D.=1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存 3.用下图所示装置进行实验,不能达到实验目的的是:( ) 甲 乙 丙 丁 A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 B.用乙装置可制得金属锰,用同样的装置可制得金属铬 C.用丙装置可实现对铁钉的保护 D.用丁装置验证铜与稀硝酸反应的气体产物只有NO 4.设NA为阿伏加德罗常数的值,下列叙述正确的是:( ) A.常温常压下,22.4 L乙烯中C—H键数为4 NA B.1 mol羟基中电子数为10 NA C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA D.常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022 5.常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是:( ) A.滴定盐酸的曲线是图2 B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为 c(A-)>c(Na+)>c(H+)>c(OH-) 6.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下 图为RFC工作原理示意图,有关说法正确的是:( ) A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2 B.左端装置中化学能转化为电能,右端装置中电能转化为化学能 C.c极上发生的电极反应是:O2 + 2H2O + 4e- = 4OH— D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A 第Ⅱ卷(非选择题 共64分) 本卷共4题,共64分 7、(14分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。 请填写下列空白: (1)在周期表中,组成单质G的元素位于第_______周期第_______族。 (2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。 (3)简述M溶液中阳离子的检验方法 。 (4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。 (5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。 NaOH与其他 电解质溶液 (6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。 ①熔炼制备该合金时通入氩气的目的是 。 ② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。 8、(18分)某芳香烃A是一种重要的有机化工原料,以它为初始原料经过如下转化关系(部分产物、合成路线、反应条件略去)可以合成邻氨基苯甲酸、扁桃酸等物质。其中D能与银氨溶液发生银镜反应,H是一种功能高分子。 (1)写出扁桃酸的结构简式: ;写出G官能团的名称 。 (2)反应②的反应类型为: ;发生反应④的条件为加入 。 反应步骤③与④不能对换,其理由是 。 (3)写出D与银氨溶液反应的化学方程式: 。 (4)写出反应⑤的化学方程式: 。 (5)写出符合下列条件G的同分异构体的结构简式 , ;(任写两种) ①含有苯环,且苯环上的一氯取代产物只有二种; ②苯环上只有两个取代基,且N原子直接与苯环相连 ; ③结构中不含醇羟基和酚羟基; (6)请设计合理的方案以乙烯为主要有机原料合成。 提示:①合成过程中无机试剂任选;② 合成路线流程图示例如下: 9、(18分)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: 实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。 已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。 (1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ; 操作Ⅱ为 。 (2)无色液体A是 ,定性检验A的试剂是 , 现象是 。 (3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。 序号 实验方案 实验现象 结论 ① 将白色固体B加入水中, 得到白色晶体和无色溶液 加热溶解, ② 取少量滤液于试管中, 生成白色沉淀 滤液含Cl- ③ 干燥白色晶体, 白色晶体是苯甲酸 (4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。 10、(14分)短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。 (1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。 (2)已知:①2E· → E-E;=-a kJ·mol-1 ② 2A· → A-A;=-b kJ·mol-1 ③E·+A· → A-E;=-c kJ·mol-1 写出298K时,A2与E2反应的热化学方程式 。 (3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: 实验 甲 乙 丙 初始投料 2 mol A2、1 mol BC 1 mol X 4 mol A2、2 mol BC 平衡时n(X) 0.5mol n2 n3 反应的能量变化 放出Q1kJ 吸收Q2kJ 放出Q3kJ 体系的压强 P1 P2 P3 反应物的转化率 1 2 3 ①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率( A2)为 。 ②该温度下此反应的平衡常数K的值为 。 ③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。 A. 容器内A2、BC、X的物质的量之比为2:1:1 A. 容器内气体的密度保持恒定 B. 容器内A2气体的体积分数保持恒定 C. 2V正(A2)=V逆(BC) ④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。 A.α1+α2=1 B.Q1+Q2=a C.α3<α1 D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1 (4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。 七校联考化学答案 2014.4 1 -----6 C B D D C A 7、(14分) (2分) (2)(2分) (3)取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色(其他合理答案) (2分) (4) (2分) (5) (2分) (6)① (2分) ② (2分) 8、(18分) H2O Cu/O2 HCN H2O/H+ 浓硫酸 (6)CH2=CH2 → CH3CH2OH → CH3CHO →CH3-CH-CN → CH3-CH-COOH → 一定条件 △ △ △ (3分) 9、(18分) (1)分液(1分),分液漏斗、烧杯等(1分);蒸馏(1分) (2)甲苯(1分);酸性KMnO4溶液(1分),溶液褪色(1分)。 (3) 序号 实验方案 实验现象 结论 ① 将白色固体B加入水中加热,溶解,冷却结晶、过滤 (2分) 得到白色晶体和无色溶液 ② 取少量滤液于试管中,滴入2-3滴硝酸酸化的AgNO3溶液(2分) 生成白色沉淀 滤液含有Cl- ③ 干燥白色晶体,加热使其融化,测其熔点(2分) 熔点为122.4℃(2分) 白色晶体是苯甲酸 (4)(2.40×10-3×122×4)/1.22(2分);96%(2分) 10、(14分) (1)离子键、共价键(1分)(1分) (2)H2(g)+Cl2 (g)=2HCl(g);=(a+b-2c)kJ·mol-1(2分) (3)①0.125mol·L-1·min-1(2分) ② 4(2分) ③ C(2分) ④ ABD(2分) (4)(2分)查看更多