- 2024-06-04 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江西省奉新县第一中学高二上学期第三次月考化学试题 Word版
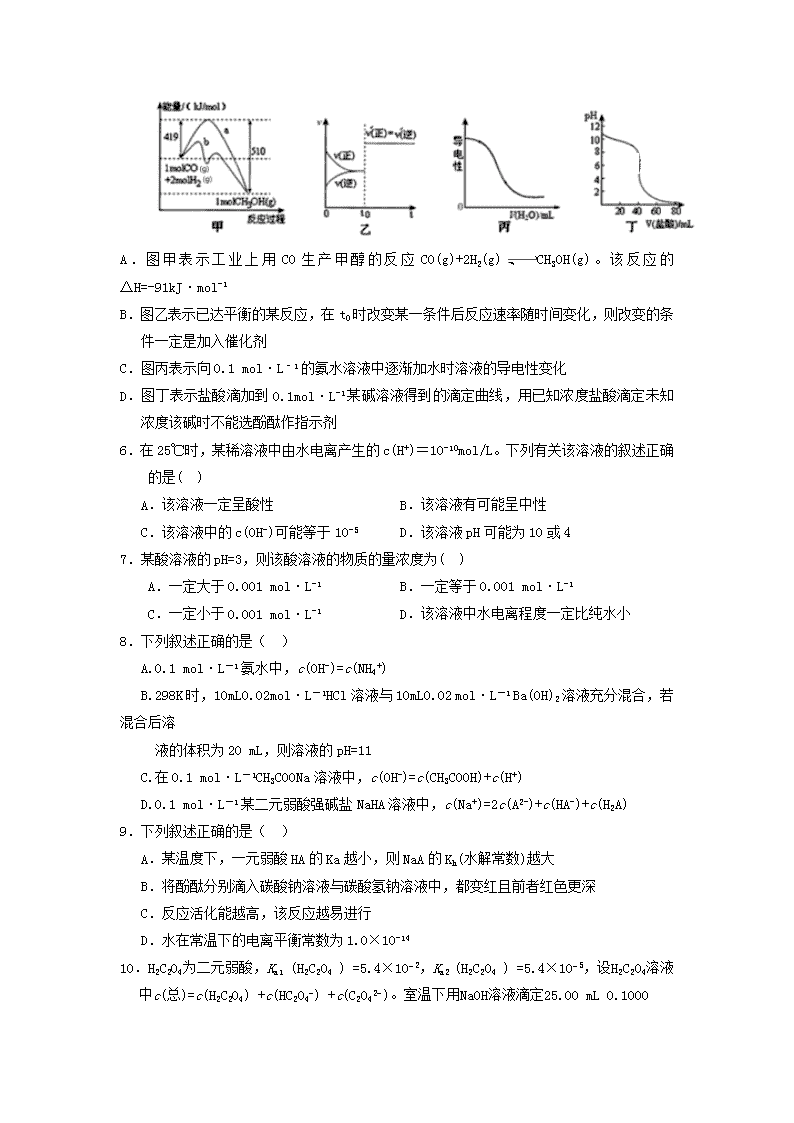
奉新一中2018-2019学年高二上学期第三次月考化学试卷 命题人:李江华 2018.12 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 K:39 Cl:35.5 Mg:24 Cu:64 Zn:65 Ca:40 第Ⅰ卷(选择题,共48分) 1.下列说法或表示方法正确的是( ) A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 B.由“C(石墨)=C(金刚石) ;ΔH=+1.9 kJ·mol-1”可知,金刚石比石墨稳定 C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气的燃烧的化学方程式表示为2H2(g)+O2(g)===2H2O(l) ;ΔH=+571.6 kJ·mol-1 D.在稀溶液中:H++OH-===H2O;ΔH=-57.3 kJ·mol-1,将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ 2.在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( ) A.CH3OH(l)+O2(g)=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol 3.下列说法正确的是( ) A.增大反应物浓度能加快反应速率,但活化分子百分数不变 B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 C.在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 D.研制性能优良的催化剂可以显著提高产量 4.有一处于平衡状态的反应:X(s)+3Y(g)2Z(g);△H<0.为了使平衡向生成Z的方向移动,应选择的条件是( ) ①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z ⑦增加X ⑧增加Y. A.①③⑤⑦ B.②③⑤⑦ C.②③⑥⑧ D.②④⑥⑧ 5.下列图示与对应的叙述不符合的是( ) A.图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g)CH3OH(g)。该反应的△H=-91kJ·mol-1 B.图乙表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 C.图丙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化 D.图丁表示盐酸滴加到0.1mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时不能选酚酞作指示剂 6.在25℃时,某稀溶液中由水电离产生的c(H+)=10-10mol/L。下列有关该溶液的叙述正确的是( ) A.该溶液一定呈酸性 B.该溶液有可能呈中性 C.该溶液中的c(OH-)可能等于10-5 D.该溶液pH可能为10或4 7.某酸溶液的pH=3,则该酸溶液的物质的量浓度为( ) A.一定大于0.001 mol·L-1 B.一定等于0.001 mol·L-1 C.一定小于0.001 mol·L-1 D.该溶液中水电离程度一定比纯水小 8.下列叙述正确的是( ) A.0.1 mol·L-1氨水中,c(OH-)=c(NH4+) B.298K时,10mL0.02mol·L-1HCl溶液与10mL0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶 液的体积为20 mL,则溶液的pH=11 C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) 9.下列叙述正确的是( ) A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越大 B.将酚酞分别滴入碳酸钠溶液与碳酸氢钠溶液中,都变红且前者红色更深 C.反应活化能越高,该反应越易进行 D.水在常温下的电离平衡常数为1.0×10-14 10.H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( ) A.0.1000 mol·L−1 H2C2O4溶液:c(H+ ) + 0.1000 mol·L-1=c(C2O42-)+c(OH-)−c(H2C2O4 ) B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42- ) >c(H+ ) C.pH = 7的溶液:c(Na+ ) =0.1000 mol·L-1+ c(C2O42-) −c(H2C2O4) D.c(Na+ ) =2c(总)的溶液:c(OH-) −c(H+) = 2c(H2C2O4) +c(HC2O4-) 11.向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化)。下列数值变小的是 ( ) A.c(H+) B.c(CO32-) C.MgCO3溶解度 D.Ksp(MgCO3) 12.氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时: ①HF(aq)+OH-(aq)===F-(aq)+H2O(l) H=-67.7 kJ·mol-1 ②H+(aq)+OH-(aq)===H2O(l) H=-57.3 kJ·mol-1 在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,下列有关说法正确的是( ) A.氢氟酸的电离方程式及热效应可表示为:HF(aq)F-(aq)+H+(aq) △H=+10.4 kJ·mol-1 B.当V=20时,溶液中:c(OH-)=c(HF)-c(H+) C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 D.当V>0时,溶液中可能存在:c(Na+)>c(OH-)>c(F-)>c(H+) 13.下列说法正确的是( ) A.常温下,物质的量浓度均为0.1mol·L−1 Na2CO3和NaHCO3等体积混合后的溶液中: 2c(OH-)-2c(H+)=c(H2CO3)+c(HCO3-)-c(CO32-) B.ΔH<0,ΔS>0的反应都是自发反应;ΔH>0,ΔS>0的反应任何条件都是非自发反应 C.电离平衡、水解平衡、难溶电解质的溶解平衡都是动态平衡 D.在一定温度下,固定体积为2 L密闭容器中,发生反应:2SO2(g)+O2(g)2SO3(g) △H<0,当υ(SO2)= υ(SO3)时,说明该反应已达到平衡状态 14.CH4是一种重要的化工原料,工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1mol CH4(g)和1.1 mol H2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta。下列说法正确的是( ) A. a、b两容器的温度不可能相同 B. 在达到平衡前,容器a的压强保持不变 C. 该反应在Ta温度下的平衡常数为2700(mol·L-1)2 D. 容器a中CH4从反应开始到恰好平衡时的平均反应速率为0.25mol·L-1·min-1 15.NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是( ) A. NH2D·H2O和D3O+ B. NH3·HDO和D3O+ C. NH3·D2O和HD2O+ D. NH2D·HDO和H2DO+ 16.25℃时,下列各组离子在指定溶液中一定能大量共存的是( ) A.pH=1的溶液中:Na+、K+、MnO4-、CO32- B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- C.0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- D.0.1 mol/L FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- 第Ⅱ卷(非选择题 共52分) 二、填空题(46分) 17.(6分)(1)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问: ①若a+b=12,则Va∶Vb= ; ②若a+b=15,则Va∶Vb= ; ③若a+b<14,则Va∶Vb= ,且Va Vb(填“>”“<”或“=”)。 (2)室温时,将c(H+)=10-10mol/L的Ba(OH)2溶液稀释10倍,c(H+)∶c(Ba2+)= 。 (3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如上图所示。下列叙述中正确的是( ) A.MOH为强碱 B.在x点,ROH部分电离 C.在x点,c(M+)=c(R+) D.稀释前ROH溶液中c(OH-)是MOH溶液中c(H+)的10倍 18.(5分)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示, 导电能力 加水体积 O a b c (1)O点导电能力为0的理由是 ; (2)a、b、c三点溶液的c(H+)由大到小的顺序是 ; (3)a、b、c三点醋酸的电离程度最大的是 ; (4)要使c点c(CH3COO— )增大,c(H+)减少,可采取的措施是(至少写出两种方法)① ② 。 19.(12分)(1)已知:碳酸:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11;草酸:H2C2O4,Ka1=5.9×10-2,Ka2=6.4×10-5 ①0.1 mol/L Na2CO3溶液的pH_____0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”);等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 。 ②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号) A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-] C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-] ③人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象 。 (2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=______mol·L-1。将SO2通入该氨水中,当c(OH-)降至2.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)= 。 20.(10分)(1)BiCl3的水解产物中有BiOCl生成。 ①写出BiCl3水解反应的化学方程式: ; ②医药上常将BiOCl称为次氯酸铋,该名称 (填“正确”或“不正确”); ③如何配制BiCl3溶液? 。 (2)将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。 ①若生成的盐中只有一种离子水解,该离子水解的离子方程式为 ; ②简述该混合液呈碱性的原因 。 21.(7分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。 [实验一]配制并标定醋酸溶液的浓度 取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题: (1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。 (2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL 醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下: 实验序号 1 2 3 4 消耗NaOH溶液的体积(mL) 20.05 20.00 18.80 19.95 则该醋酸溶液的准确浓度为 (保留小数点后四位)。 醋酸浓度 (mol·L-1) 0.0010 0.0100 0.0200 0.1000 0. 2000 pH 3.88 3.38 3.23 2.88 2.73 [实验二] 探究浓度对醋酸电离程度的影响 用pH计测定25℃时不同浓度的醋酸的pH,结果如下,回答下列问题: (3)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。 (4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。 [实验三]探究温度对醋酸电离程度的影响 (5)请你设计一个实验完成该探究,请简述你的实验方案: 。 22.(12分)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(1) FeCl3净水的原理是 ;FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。 (2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。 (3)FeCl3在溶液中分三步水解:Fe3++H2OFe(OH)2++H+ K1 ;Fe(OH)2++H2OFe(OH)2++H+ K2; Fe(OH+H2OFe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由小到大的顺序是 ; 通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2OFex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) ; A.降温 B.加水稀释 C.加入NH4Cl D.加入NaHCO3 室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。 奉新一中2020届高二上学期第三次月考化学答案 1—16:CBACB DDCAD BDCAB C 17.(6分)(1)1:100 10:1 10a+b-14 <(2)2∶104 (3)C 18.(5分)(1)在O点醋酸未电离,无自由离子存在 (2) b >a> c (3) c点 (4)加NaOH固体 加少量的碳酸钠固体 加入镁等金属 加醋酸钠固体等 19.(12分)(1)①大于 草酸;②AC ③当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合理即给分)(2)6.0×10-3 1.24 20.( 10分)((1)①BiCl3+H2OBiOCl+2HCl ②不正确③将适量的BiCl3固体溶于少量浓盐酸,再加水稀释(2)①Bm++mH2OB(OH)m+mH+ ②等体积混合时,酸中的H+与碱中的OH-完全中和,pH=8说明碱为弱碱,发生反应H++OH-===H2O后,碱继续电离出OH-,使溶液显碱性(只要回答到碱过量,混合后溶液呈碱性就给分) 21.(7分)(1)胶头滴管 250 mL容量瓶(2)0.2000 mol·L-1 (3)增大 (4)0.010 0 mol·L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1(或其他合理答案) (5)用pH计(或pH试纸)测定相同浓度的醋酸在几种不同温度时的pH 22.(12分) (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中悬浮的杂质 2Fe3++Fe=3Fe2+ (2)①2 (3) K3<K2<K1 BD 调节溶液的pH查看更多