- 2024-05-28 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省洛阳市高二上学期期末考试化学试题 Word版
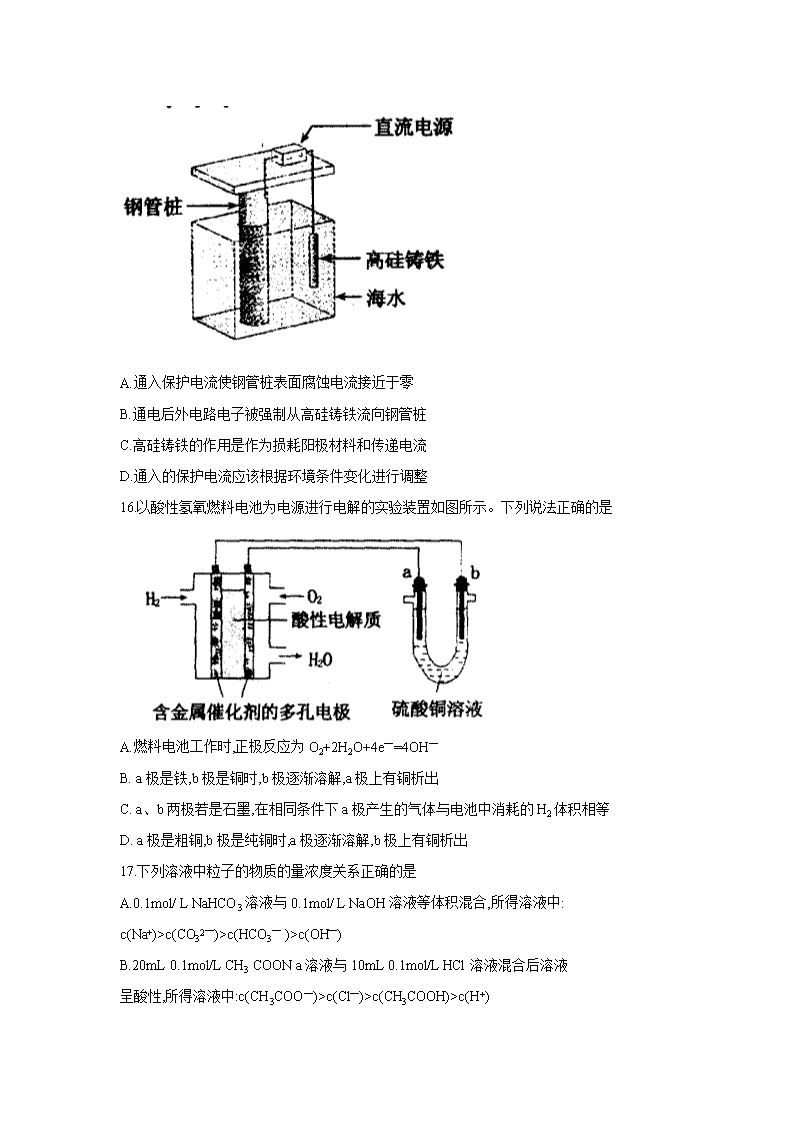
洛阳市2017—2018学年第一学期期末考试 高二化学试卷 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间90分钟 第Ⅰ卷(选择题,共50分) 本试卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Fe:56 Cu:64 一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题2分,共20分) 1.以下能级符号正确的是 A. 1p B. 2d C. 3f D.6s 2.以下电子排布式属于基态原子的电子排布的是 A. 1s12s1 B.1s22s12p1 C. 1s 22s22p63s2 D.1s22s22p63p1 3.碱性锌锰电池尖得了广泛的应用,根据电池的电极反应,下列判断正确的是 A. Zn为负极,MnO2为正极 B. Zn为正极,MnO2为负极 C.工作时电子由MnO2经外电路流向Zn极 D. Zn电极发生还原反应,MnO2电极发生氧化反应 4.铅蓄电池充电时, PbSO4 A.在阳极生成 B.在阴极生成 C.在两个电极上生成 D.在两个电极上除去 5.下列关于电解槽的叙述不正确的是 A.与电源正极相连的是电解槽的阴极 B.与电源负极相连的是电解槽的阴极 C.在电解槽的阳极发生氧化反应 D.电子从电源的负极沿导线流入电解槽的阴极 6.下列关于铜电极的叙述不正确的是 A.锌铜原电池中铜是正极 B.在镀件上镀铜时可用金属铜作阳极 C.用电解法精炼粗铜吋粗铜作阳极 D.用电解法精炼粗铜时纯铜作阳极 7.下列物质中,含有共价键的离子晶体是 A. KBr B NaOH C. HCl D. I2 8.下列叙述正确的是 A.原子晶体中只含有共价键 B.离子晶体中只含有离子键,不含有共价键 C.分子晶体中只存在分子间作用力,不含有其他化学键 D.任何晶体中,若含有阳离子也一定含有阴离子 9下列性质中,可以较充分说明某晶体是离子晶体的是 A.具有较高的熔点 B.固态不导电,水溶液能导电 C.可溶于水 D.固态不导电,熔融状态能导电 10.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s2p4,由这三种元素组成的化合物的化学式可能是 A.XYZ2 B.Ⅹ2YZ3 CX2 YZ2 D.ⅩYZ3 二、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共30分) 11.下列说法中正确的是 A.在分子中,两个成键的原子间的距离叫做键长 B.H-Cl的键能为431.8kJ·mol—1,H—I的键能为298.7kJ·mol—1,这可以说明HCl比HI稳定 C.含有极性键的分子一定是极性分子 D.键能越大,表示该分子越容易受热分解 12.在单质的晶体中,一定不存在 A.离子键 B.分子间作用力 C.共价键 D.金属离子与自由电子间的作用 13.用 VSEPR模型预测下列分子或离子的立体结构,其中正确的是 A.H2O与BeCl2为角形(V形) B.CS2与SO2为直线形 C.BF3与PCl3为三角锥形 D.SO3与CO32—为平面三角形 14.等电子体之间结构相似、物理性质也相近。根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体。下列各组粒子不能互称为等电子体的是 A.CO32—和NO3— B.O3和SO2 C. CO2和NO2— D.SCNˉ和N3— 15.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 16.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是 A.燃料电池工作时,正极反应为O2+2H2O+4e—=4OH— B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 C. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 D. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 17.下列溶液中粒子的物质的量浓度关系正确的是 A.0.1mol/ L NaHCO3溶液与0.1mol/ L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32—)>c(HCO3— )>c(OH—) B.20mL 0.1mol/L CH3 COON a溶液与10mL 0.1mol/L HCl溶液混合后溶液 呈酸性,所得溶液中:c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+) C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中 c(Cl— )+c(H+)>C(NH4+ )+C(OH—) D.0.1 mol/L CH3COOH溶液与0.1 mol/ L NaOH溶液等体积混合,所得溶液 中:c(OH—)>c(H+)+c(CH3COOH) 18.已知Ksp(AgCl)=1.56×10—10,Ksp(AgBr)=7.7×10—13,Ksp(Ag2CrO4)=9.0×10—12。某溶液中含有C—、Br—和CrO42—浓度均为0.010mol·L—1,向该溶液中逐滴加入0.010mol·L—1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 A. Cl—、Br—、CrO42— B.CrO42—、Br—、Cl— C.Br—、Cl—、CrO42— D.Br—、CrO42—、Cl— 19.常压下羰基化法精炼镍的原理为:Ni(s)十4CO(g) Ni(CO)4(g)。230时,该反应的平衡常数K=2×10—5。已知:Ni(CO)4的沸点为42.2,固体杂质不参与反应。 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4 第二阶段:将第一阶段反应后的气体分离出来,加热至230制得高纯镍。 下列判断正确的是 A.增加c(CO),平衡向正向移动,反应的平衡常数增大 B.第一阶段,在30和50℃两者之间选择反应温度,选50℃ C.第二阶段,Ni(CO)4分解率较低 D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) 20.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是 A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S被还原生成单质银 C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl 第Ⅱ卷(非选择题,共50分) 三、填空题(本题共4题,共50分) 21.(6分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料,从 天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol—1 ②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ·mol—1 ③CO(g)+H2 O(g) CO2(g)+H2(g) △H3 请回答下列问题 (1)在一容积恒定的密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=________;10min时,改变的外界条件可能是______。(写出一种) (2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变 ①可以判断甲容器中反应已达平衡状态的是___________。 a.生成CH4的速率是生成CO的速率的2倍 b.容器内压强保持不变 c.容器内气体的密度保持不变 d.容器内各气体的浓度保持不变 ②甲乙两容器中反应达到平衡时,下列说法正确的是__________。 a.化学反应速率:v(甲)>v(乙) b.甲烷的转化率:a(甲)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档