2019届二轮复习原理型简答题的精准解答学案(全国通用)
专题四 原理型简答题的精准解答
热点题空一 物质变化型简答题
典型物质的重要性质要点
1.钠是“极其活泼”金属的代表
知识主线:Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3
过氧化钠:结构特点、与水及CO2反应特点;Na2CO3、NaHCO3相互转化的条件。
2.铝单质的强还原性,即能溶于强碱,又能溶于强酸,均产生氢气。氧化铝、氢氧化铝的两性,氢氧化铝的电离特点。
3.铁元素具有变价,铁制品腐蚀的原因,Fe2+具有较强的还原性,在空气中易被氧化;Fe3+具有氧化性、易水解;Fe2+、Fe3+的相互转化的条件;Fe2+、Fe3+检验的特征反应。
4.氯气是具有强氧化性的有毒性气体,氯气可用于漂白,但氯气没有漂白性,起漂白作用的物质是HClO;氯水中存在Cl2+H2O??HCl+HClO,HClO??H++ClO-,ClO-易水解、具有强氧化性。
5.二氧化硫是形成酸雨的主要物质之一、是酸性氧化物,具有较强的还原性、弱的氧化性、漂白的可逆性;检验二氧化硫的特征试剂是品红溶液。
浓硫酸具有吸水、脱水、强氧化性;稀硫酸具有酸的通性,没有强氧化性;注意SO检验的干扰因素。
6.氨气极易溶于水、是碱性气体,具有还原性;水溶液存在的平衡:NH3+H2O??NH3·H2O??NH+OH-,氨水不稳定。
浓硝酸具有强酸性、不稳定性和强氧化性,稀硝酸也具有强氧化性。
题组一 物质性质应用型
1.根据物质的特性简答下列各题:
(1)过量的铜加入少量稀硝酸中,待反应停止后,再加入少量的稀硫酸,这时Cu片上又有气泡产生,原因是__________________________________________________________
________________________________________________________________________。
答案 加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应
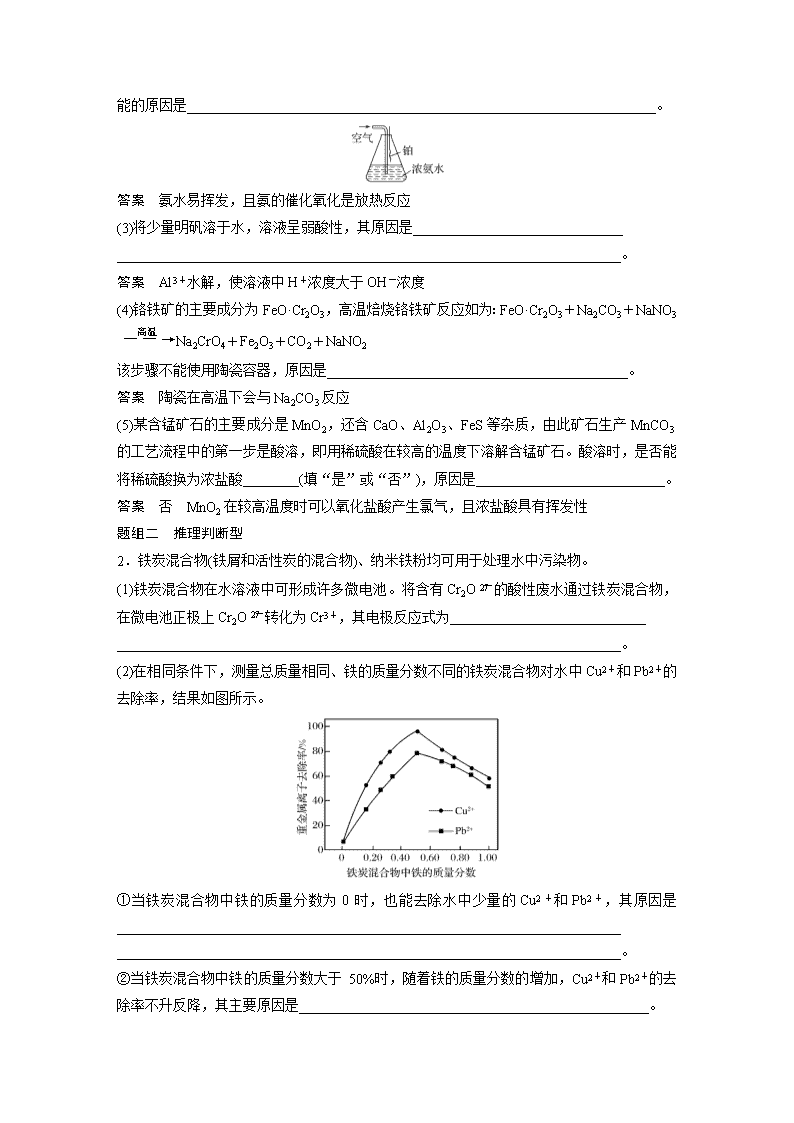
(2)如图所示,将红热的铂丝插入锥形瓶中,不与溶液接触,一段时间后铂丝仍保持红热,
可能的原因是___________________________________________________________________。
答案 氨水易挥发,且氨的催化氧化是放热反应
(3)将少量明矾溶于水,溶液呈弱酸性,其原因是______________________________
________________________________________________________________________。
答案 Al3+水解,使溶液中H+浓度大于OH-浓度
(4)铬铁矿的主要成分为FeO·Cr2O3,高温焙烧铬铁矿反应如为:FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2
该步骤不能使用陶瓷容器,原因是___________________________________________。
答案 陶瓷在高温下会与Na2CO3反应
(5)某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS等杂质,由此矿石生产MnCO3的工艺流程中的第一步是酸溶,即用稀硫酸在较高的温度下溶解含锰矿石。酸溶时,是否能将稀硫酸换为浓盐酸________(填“是”或“否”),原因是___________________________。
答案 否 MnO2在较高温度时可以氧化盐酸产生氯气,且浓盐酸具有挥发性
题组二 推理判断型
2.铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O的酸性废水通过铁炭混合物,在微电池正极上Cr2O转化为Cr3+,其电极反应式为____________________________
________________________________________________________________________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是________________________________________________________________________
________________________________________________________________________。
②当铁炭混合物中铁的质量分数大于 50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是__________________________________________________。
(3)纳米铁粉可用于处理地下水中的污染物。纳米铁粉除去水中NO反应的离子方程式为4Fe+NO+10H+===4Fe2++NH+3H2O,研究发现,若pH偏低将会导致NO的去除率下降,其原因是________________________________________________________________________
________________________________________________________________________。
答案 (1)Cr2O+6e-+14H+===2Cr3++7H2O
(2)①活性炭对Cu2+和Pb2+有吸附作用
②铁的质量分数增加,铁炭混合物中微电池数目减少
(3)纳米铁粉与H+反应生成H2
3.H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式__________________________________________________。
(2)分析产品室可得到H3PO2的原因__________________________________________
________________________________________________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有____________杂质。该杂质产生的原因是____________________________
________________________________________________________________________。
[解题思路] (2)
(3)
答案 (1)2H2O-4e-===O2↑+4H+
(2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2
(3)PO H2PO或H3PO2被氧化
解析 (1)阳极发生氧化反应,在反应中OH-失去电子,电极反应式为2H2O-4e-===O2↑+4H+。
(2)H2O放电产生H+,H+进入产品室,原料室的H2PO穿过阴膜扩散至产品室,二者发生反应:H++H2PO??H3PO2。
(3)如果撤去阳膜,H2PO或H3PO2可能被氧化。
4.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解、氧化,且在氯离子浓度较大的体系中存在CuCl+Cl-??[CuCl2]-。
工业上可用向硫酸铜饱和溶液中加入NaCl和Na2SO3的方法制取CuCl,请回答下列问题:
(1)写出生成CuCl沉淀的离子方程式:________________________________________
________________________________________________________________________。
(2)在反应进行时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是________________________________________________________________________
________________________________________________________________________。
(3)实验测得溶液的 pH 与亚硫酸钠溶液体积的关系曲线如图所示。
①解释图像中V
a时,随着亚硫酸钠溶液的体积增大,溶液pH增大的原因是
________________________________________________________________________。
答案 (1)2Cu2++2Cl-+SO+H2O===2CuCl↓+SO+2H+
(2)当Cl-浓度过大时,生成的沉淀CuCl又会发生CuCl+Cl-??[CuCl2]-,因而沉淀率会降低
(3)①由于发生2Cu2++2Cl-+SO+H2O===2CuCl↓+SO+2H+,H+浓度逐渐增大
②当铜离子完全反应后,再加入Na2SO3消耗溶液中的H+,又使H+浓度逐渐减小
物质变化类简答题答题要领
(1)结合物质的性质,推测产生结果的原因;叙述时一般可使用因果表述法。
(2)推理判断理由的阐述
该类型简答题一般是依据题意,根据化学知识及相关的知识对题目所给的问题先进行分析判断,然后说明判断的理由。解题的思路:先对问题作出判断,得出结论,然后再由结论追溯到分析过程,最后再回到结论。采分点是推理过程和结论。
热点题空二 读懂图表,精准解答化学平衡简答题
1.化学平衡移动的判断方法
(1)依据勒夏特列原理判断
通过比较平衡破坏瞬时的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起v正>v逆,此时正反应占优势,则化学平衡向正反应方向(或向右)移动。
②若外界条件改变,引起v正K,平衡逆向移动;
②若Q=K,平衡不移动;
③若Q”“<”或“=”)K(T2),理由是________________________________________________________________________。
(3)如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有________________。
[解题思路]
答案 (1)p1”“=”或“<”)0,其依据是____________________________。
(2)在210~270 ℃之间,随温度升高,实际产率增大的原因是:_______________________。
答案 (1)< 温度升高甲醇的平衡产率减小 (2)温度升高,反应速率加快
解析 (1)图像分析可知升温甲醇的平衡产率降低,升高温度平衡向吸热反应方向进行,逆反应为吸热反应,正反应为放热反应,ΔH<0。
(2)210~270 ℃时反应未到达平衡,温度升高,反应速率加快,产率增大。
3.一定温度下,在3 L容积可变的密闭容器中发生反应H2(g)+CO2(g)??H2O(g)+CO(g),已知c(CO)随反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
(1)当曲线Ⅰ变为曲线Ⅱ时,改变的条件是__________,判断的理由是
________________________________________________________________________。
(2)当曲线Ⅰ变为曲线Ⅲ时,改变的条件是__________。
答案 (1)加入催化剂 图像分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后两种情况的平衡浓度相同,说明改变的条件是加入了催化剂 (2)将容器的体积快速压缩至2 L
解析 曲线Ⅰ、曲线Ⅲ对应的t0和平衡状态t1时,CO的浓度之比均为2∶3,可知平衡未发生移动,改变的条件是增大压强,气体物质的量不变时,设曲线Ⅲ对应的气体的体积为V,则4.5 mol·L-1×V=3 mol·L-1×3 L,得V=2 L。
�
题组二 工业生产中平衡图像的数学表征分析
4.已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)??C2H5OH(g)+3H2O(g) ΔH<0。
(1)图1、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=。①图1中投料比相同,温度从高到低的顺序为____________________,判断依据是__________________;
②图2中m1、m2、m3从大到小的顺序为____________,判断依据是________________。
(2)图3表示在总压为5 MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为____________(填化学式),T4温度时,该反应的平衡常数Kp=________(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)。
答案 (1)①T3>T2>T1 正反应放热,升高温度平衡逆向移动,温度越高,CO2的平衡转化率越小,所以T3>T2>T1 ②m1>m2>m3 保持n(CO2)不变,增大n(H2),平衡正向移动,CO2的平衡转化率增大,所以m1>m2>m3 (2)C2H5OH 0.243
解析 (2)升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O
减小,乙醇的含量是水蒸气的倍,所以曲线d代表的物质为C2H5OH;Kp=≈0.243。
5.氨气制取尿素[CO(NH2)2]的合成塔中发生反应:
2NH3(g)+CO2(g)??CO(NH2)2(l)+H2O(g)。
下图为合成塔中不同氨碳比a[]和水碳比b[]时二氧化碳的转化率(α)。b宜控制在____________(填字母)范围内。
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a宜控制在4.0左右,理由是________________________________________。
答案 A 当氨碳比大于4.0时,CO2的转化率增加不大,但增加了生产成本,氨碳比太小,CO2的转化率较低,降低了原料利用率
解析 控制变量,作垂直于横轴的一条直线交三条曲线于三点,转化率越高越好,所以选择A。选择最佳氨碳比,可看最上面曲线的走势,整体增加,曲线先陡后平(略上升),依然选择拐点。当氨碳比大于4.0时,增大氨气的量,CO2转化率增加不大,但生产成本提高了;氨碳比太小,CO2转化率低。
6.(2018·重庆模拟)(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2 L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)??COCl2(g) ΔH=a kJ·mol-1,反应过程中测定的部分数据如下表:
t/min
n(CO)/mol
n(Cl2)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
①反应0~2 min末的平均速率v(COCl2)=________ mol·L-1·min-1。
②在2~4 min间,v正(Cl2)______v逆(Cl2)(填“>”“=”或“<”),该温度下K=________。
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系。X代表的物理量是________;a______(填“>”“=”或“<”)0。
(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)??2CO2(g)+N2(g)
ΔH=-748 kJ·mol-1
一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示。温度高于710 K时,随温度的升高氮氧化物转化率降低的原因可能是_______________________________
________________________________________________________________________。
答案 (1)①0.1 ②= 5 ③温度 <
(2)当温度升高到710 K时,单位时间内反应达平衡,由于该反应是放热反应,再升高温度,平衡向左移动,转化率降低
解析 (1)①由表中数据,可知0~2 min内Δn(CO)=1.20 mol-0.80 mol=0.4 mol,由方程式可知Δn(COCl2)=Δn(CO)=0.4 mol,则v(COCl2)==0.1 mol·L-1·min-1;②4 min内,反应的氯气为0.60 mol-0.20 mol=0.4 mol,由方程式可知参加反应的CO为0.4 mol,故4 min时CO为1.20 mol-0.4 mol=0.8 mol,与2 min时CO的物质的量相等,则2 min、4 min处于平衡状态,在2~4 min 间,v正(Cl2)=v逆(Cl2),由方程式可知,平衡时生成COCl2为0.4 mol,该温度下平衡常数K===5;
③正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0。
题组三 高考化学平衡图像真题体验
7.(2017·全国卷Ⅱ,27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)===C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+O2(g)===C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)===H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,
x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是________(填标号)。
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_______________________
________________________________________________________________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是____________________________、___________________________________;
590 ℃之后,丁烯产率快速降低的主要原因可能是__________________________________。
答案 (1)+123 kJ·mol-1 小于 AD
(2)氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
(3)升高温度有利于反应向吸热方向进行 升高温度时,反应速率加快 丁烯高温裂解生成短碳链烃类
解析 (1)根据盖斯定律,用②式-③式可得①式,因此ΔH1=ΔH2-ΔH3=-119 kJ·mol-1-(-242) kJ·mol-1=+123 kJ·mol-1。由(a)图可以看出,温度相同时,由0.1 MPa变化到x MPa,丁烷的转化率增大,即平衡正向移动,所以x<0.1。由于反应①为吸热反应,所以温度升高时,平衡正向移动,丁烯的平衡产率增大,因此A正确,B错误;反应①正向进行时体积增大,加压时平衡逆向移动,丁烯的平衡产率减小,因此C错误,D正确。(2)反应初期,H2可以活化催化剂,进料气中n(氢气)/n(丁烷)
较小,丁烷浓度大,反应向正反应方向进行的程度大,丁烯转化率升高;随着进料气中n(氢气)/n(丁烷)增大,原料中过量的H2会使反应①平衡逆向移动,所以丁烯转化率下降。(3)590 ℃之前,温度升高时反应速率加快,生成的丁烯会更多,同时由于反应①是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯。而温度超过590 ℃时,丁烯高温会裂解生成短碳链烃类,使产率降低。
化学平衡简答题的答题要领
叙特点(反应特点或容器特点)―→变条件―→定方向―→得结论(或结果)
热点题空三 溶液中离子平衡简答题的答题思路
1.电离平衡与水解平衡的比较
电离平衡(如CH3COOH溶液)
水解平衡(如CH3COONa溶液)
研究对象
弱电解质(包括水的电离、多元弱酸的酸式盐)
盐溶液(包括强酸弱碱盐、弱酸强碱盐、弱酸弱碱盐)
实质
弱电解质的电离
盐的水解促进水的电离
升高温度
促进电离,离子浓度增大,K增大
促进水解,水解常数增大
加水稀释
促进电离,离子浓度(除OH-外)减小,K不变
促进水解,离子浓度(除H+外)减小,水解常数不变
加入相应离子
加入CH3COONa固体或盐酸,抑制电离,K不变
加入CH3COOH或NaOH,抑制水解,水解常数不变
加入反应离子
加入NaOH,促进电离,K不变
加入盐酸,促进水解,水解常数不变
2.外界条件对AgCl溶解平衡的影响
AgCl(s)??Ag+(aq)+Cl-(aq) ΔH>0
体系变化
条件
平衡移动方向
平衡后c(Ag+)
平衡后c(Cl-)
Ksp
升高温度
向右
增大
增大
增大
加水稀释
向右
不变
不变
不变
加入少量AgNO3
向左
增大
减小
不变
通入HCl
向左
减小
增大
不变
通入H2S
向右
减小
增大
不变
1.双碱法吸收尾气中二氧化硫的过程如下:
NaOH溶液Na2SO3溶液
写出过程①的离子方程式:__________________________________________________
________________________________________________________________________;
CaO在水中存在如下转化:CaO(s)+H2O(l)===Ca(OH)2(s)??Ca2+(aq)+2OH-(aq)
从平衡移动的角度,简述过程②NaOH再生的原理:_____________________________
________________________________________________________________________。
答案 2OH-+SO2===SO+H2O SO与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成
2.Na2HPO4是磷酸的酸式盐,但其水溶液呈碱性,从溶液中离子平衡角度分析回答下列问题:
(1)解释Na2HPO4溶液呈碱性的原因_________________________________________
________________________________________________________________________。
(2)当加入足量饱和CaCl2溶液时,溶液变为酸性,解释原因
________________________________________________________________________
________________________________________________________________________。
[解题思路]
答案 (1)Na2HPO4溶液中存在两个平衡,一是电离平衡,HPO??H++PO,二是水解平衡,HPO+H2O??H2PO+OH-,其水解程度大于电离程度,故溶液呈碱性
(2)Na2HPO4溶液中存在电离平衡,HPO??H++PO,加入CaCl2溶液,Ca2+与PO结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性
3.已知氢氧化钙和碳酸钙在水中分别存在下列溶解平衡:Ca(OH)2(s)??Ca2+(aq)+2OH-(aq),CaCO3(s)??Ca2+(aq)+CO(aq)。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等
。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏(CaSO4·2H2O)。
(1)粉末状碳酸钙悬浊液能吸收废气中SO2的原因:_______________________________
________________________________________________________________________。
(2)SO2与Ca(OH)2悬浊液反应生成石膏的总方程式:
________________________________________________________________________。
(3)试说明用熟石灰的悬浊液而不用澄清石灰水的理由:
________________________________________________________________________。
答案 (1)由于亚硫酸的酸性比碳酸强,亚硫酸与碳酸根反应产生CO2气体,CaCO3的溶解平衡向右移动,生成亚硫酸钙,再被氧化为硫酸钙
(2)2SO2+O2+2Ca(OH)2+2H2O===2CaSO4·2H2O
(3)Ca(OH)2微溶,澄清的石灰水中Ca(OH)2的浓度小,不利于吸收SO2
解析 (1)SO2与CaCO3悬浊液反应,相当于弱酸制更弱的酸。(2)SO2与Ca(OH)2悬浊液反应,相当于酸碱中和反应,再被氧气氧化为硫酸钙。(3)用熟石灰的悬浊液而不用澄清石灰水,与浓度有关,浓度大时吸收二氧化硫的效果好。
4.在水溶液中橙红色的Cr2O与黄色的CrO存在如下平衡关系:Cr2O+H2O??2CrO+2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈黄色,解释溶液变黄的原因:
________________________________________________________________________。
(2)向已加入NaOH溶液的溶液中再加入过量稀硫酸,则溶液应是________,因为________________________________________________________________________。
(3)向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡向________(填“左”或“右”)移动,溶液颜色将变__________________。
答案 (1)加入少量的NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液变成黄色
(2)橙红色 H+浓度增大,平衡向左移动,Cr2O浓度增大
(3)右 浅
解析 (1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动。(2)加入酸,H+浓度增大,平衡左移,Cr2O浓度增大。(3)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO浓度降低,平衡向右移动。
溶液中有关离子平衡的简答题思路
阅读题目情境的信息,找出核心问题的分析对象,即平衡体系;找出题目信息中与平衡体系变化的有关因素;利用平衡移动原理分析变化的因素对化学平衡移动的影响,即平衡移动方向的判断;说明平衡移动后对实际问题体系产生的影响。
一般用如下模式书写:“……存在……平衡,……(条件)使平衡向……(方向)移动,……(结论)”。
专题特训
A组
1.电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_________________________________________________________________,
说明理由:_____________________________________________________________________。
答案 NH3 根据反应:8NO+7H2O3NH4NO3+2HNO3,电解产生的HNO3多
2.用Fe作电极电解含Cr2O的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀以达到除铬的目的。
(1)用Fe作电极的原因为____________________________________________________。
(2)在阴极附近溶液pH升高的原因是_________________________________________。
(3)溶液中除生成Cr(OH)3沉淀外还生成________沉淀,解释产生的原因
________________________________________________________________________。
答案 (1)阳极反应为Fe-2e-===Fe2+,提供还原剂Fe2+
(2)水电离产生的H+放电生成H2:2H++2e-===H2↑,同时产生了大量OH-
(3)Fe(OH)3 溶液中的Fe2+被Cr2O氧化为Fe3+,电解过程中pH升高,Fe3+水解程度增大,转化为Fe(OH)3沉淀
解析 (1)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-===Fe2+,以提供还原剂Fe2+。
(2)阴极氢离子的放电能力较强,先放电,因而氢离子浓度减小,氢氧根离子浓度增大。
(3)溶液中的Fe2+被Cr2O氧化为Fe3+,电解过程中pH升高,Fe3+水解程度增大,转化为Fe(OH)3沉淀。
3.已知H2S高温热分解制H2的反应如下:2H2S(g)??2H2(g)+S2(g)。在恒容密闭容器中,控制不同温度进行H2S的分解实验。
以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如图所示。图中曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。请说明随温度的升高,曲线b向曲线a逼近的原因:
________________________________________________________________________。
答案 温度升高,反应速率加快,达到平衡所需的时间缩短,故曲线b向曲线a靠近
解析 弄清两根曲线表示的含义,温度低时,H2S转化率相差较大,温度高时,H2S转化率几乎相等,说明温度高时,在该段时间里已经达到平衡。
4.乙苯催化脱氢制苯乙烯反应:
+H2(g) ΔH=+124 kJ·mol-1
工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)变化如图:
(1)掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:_____________________
________________________________________________________________________。
(2)控制反应温度为600 ℃的理由是__________________________________________
________________________________________________________________________。
答案 (1)正反应方向气体分子数增加,加入水蒸气稀释,相当于起减压的效果
(2)600 ℃,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降,高温还可能使催化剂失活,且能耗大
5.我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,
实现铅的再生,意义重大。一种回收铅的工艺流程如下:
已知:PbSO4、PbCO3的溶解度(20 ℃)见图1;Na2SO4、Na2CO3的溶解度见图2。
(1)①根据图1写出过程Ⅰ的离子方程式:____________________________________
________________________________________________________________________。
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在__________溶液中PbSO4转化率较大,理由是_____________
________________________________________________________________________。
(2)生产过程中的温度应保持在40 ℃,若温度降低,PbSO4的转化率下降。根据图2,解释可能原因:
ⅰ.温度降低,反应速率降低;
ⅱ.________________________________________________________________________
(请你提出一种合理解释)。
(3)过程Ⅲ发生反应的化学方程式是_________________________________________
________________________________________________________________________。
(4)过程Ⅳ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。
①阴极的电极反应式是____________________________________________________。
②电解一段时间后,PbCl浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是____________________________________________________________。
答案 (1)①PbSO4(s)+CO(aq)===PbCO3(s)+SO(aq)
②Na2CO3 Na2CO3溶液中CO浓度大
(2)若温度降低,Na2SO4、Na2CO3浓度降低,反应速率降低,PbSO4的转化速率下降
(3)PbO2+H2O2===PbO+O2↑+H2O
(4)①PbCl+2e-===Pb+4Cl-
②向阴极加PbO粗品
解析 (1)①由PbSO4、PbCO3的溶解度知,PbSO4容易转化为PbCO3,离子方程式是PbSO4(s)+CO(aq)===PbCO3(s)+SO(aq);②同浓度的Na2CO3和NaHCO3溶液相比,前者溶液中CO浓度大,在Na2CO3溶液中PbSO4转化率较大。(2)生产过程中的温度应保持在40 ℃,若温度降低,Na2SO4、Na2CO3浓度降低,反应速率降低,PbSO4的转化速率下降。(3)由流程知,PbO2氧化H2O2生成PbO,反应的化学方程式是PbO2+H2O2===PbO+O2↑+H2O。(4)①阴极PbCl得到电子生成Pb,电极反应式是PbCl+2e-===Pb+4Cl-。②电解一段时间后,PbCl浓度极大下降,阴极区酸性增强,因此可向阴极加PbO粗品。
B组
1.若在绝热恒容密闭容器中通入一定量的SO2和O2,一定条件下发生反应:2SO2(g)+O2(g)??2SO3(g) ΔH=-196.6 kJ·mol-1,一段时间内,正反应速率随时间变化曲线如下图所示,则在a点时,反应________(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是_________________________________________________
________________________________________________________________________。
答案 未达到 t1~t2时间内,v正增大的主要原因是反应放热导致容器内温度升高;t2~t3时间内,v正减小的主要原因是反应物浓度减小
解析 化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,a点对应的正反应速率显然还在改变,故一定未达平衡;t1~t2时间内,v正
增大的主要原因是反应放热导致容器内温度升高;t2~t3时间内,v正减小的主要原因是反应物浓度减小导致反应速率降低。
2.乙烯气相水合反应的热化学方程式为C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1,下图是乙烯气相水合法制乙醇中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
(1)列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp:______________________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是___________________
________________________________________________________________________。
(3)气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________________________________、
________________________________________________________________________。
答案 (1)设起始时C2H4和H2O(g)的物质的量均为n mol,则Kp===≈0.07
(2)p1<p2<p3<p4 反应正方向是分子数减少的反应,相同温度下,压强升高乙烯转化率提高
(3)将产物乙醇液化移去、增加n(H2O)∶n(C2H4)比
解析 (2)增大压强,平衡将正向移动,能提高C2H4的转化率,故利用图像可知压强:p1<p2<p3<p4。
(3)为了使平衡正向移动,还可以将乙醇液化及时分离,或采取增大n(H2O)∶n(C2H4)之比等措施。
3.在催化剂作用下合成气合成甲烷过程中会发生如下反应:
Ⅰ.CO(g)+3H2(g)=== CH4(g)+H2O(g)
ΔH1= -206 kJ·mol-1
Ⅱ.CO(g)+H2O(g) === CO2(g)+H2(g)
ΔH2= -41 kJ·mol-1
Ⅲ.2CO(g)+2H2(g)===CH4(g)+CO2(g)
ΔH 3= -247.4 kJ·mol-1
(1)图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应Ⅰln K(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是_______________________
________________________________________________________________________
________________________________________________________________________。
(2)提高甲烷反应选择性的关键因素是________________________,根据相关知识和图2分析合成甲烷适宜的反应条件是在550~630 K、1.0 MPa的原因是___________________
________________________________________________________________________
________________________________________________________________________。
答案 (1)在其他条件不变时,温度升高反应Ⅰ向吸热的逆反应方向移动,使ln K减小
(2)催化剂 此条件下反应速率较快而且甲烷产率较高
解析 (1)CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH1=-206 kJ·mol-1,此反应正方向是放热反应,在其他条件不变的情况下,升高温度平衡逆向移动,平衡常数减小,ln K 也减小。
(2)催化剂只改变反应速率,不影响平衡的移动,是提高甲烷反应选择性的关键因素,根据相关知识和图2分析在550~630 K和1.0 MPa的条件下反应速率较快而且甲烷产率较高,是合成甲烷适宜的反应条件。
4.SNCR—SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
已知该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g)??4N2(g)+6H2O(g) ΔH=-1 646 kJ·mol-1,
如图所示,反应温度会直接影响SNCR技术的脱硝效率。
(1)SNCR技术脱硝的最佳温度选择925 ℃的理由是_____________________________
________________________________________________________________________。
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是______________
________________________________________________________________________;
但当烟气温度高于1 000 ℃时,SNCR脱硝效率明显降低,其原因可能是_________
________________________________________________________________________。
答案 (1)925 ℃时脱硝效率高,残留氨浓度较小 (2)反应的活化能较大,没有使用催化剂 因为脱硝主要反应是放热反应,温度过高,使脱硝主要反应的平衡逆向移动(或生成的N2与O2反应生成NO等其他合理答案)
5.合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)??2NO2(g)的反应历程分两步:
①2NO(g)??N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)??2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ΔH2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)??2NO2(g)的ΔH=____________________________________
(用含ΔH1和ΔH2的式子表示)。一定温度下,反应2NO(g)+O2(g)??2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=______________________。
(2)决定2NO(g)+O2(g)??2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________(填“>”“<”或“=”)E2。
Ⅱ.(3)反应N2O4(g)??2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是______________,理由是____________________________________________
________________________________________________________________________。
(4)在25 ℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃时NH3·H2O的电离常数Kb=______________。用质量分数为17%,密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=________ mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH和SO。物质A的化学式为____________,阴极的电极反应式是________________________________________。
答案 (1)ΔH1+ΔH2 (2)<
(3)B、D 图中只有D点的NO2的消耗速率是B点N2O4的消耗速率的2倍,所以表示达到化平衡状态的点是B、D
(4)(或) 21.5a(或或)
(5)H2SO4 NO+6H++5e-===NH+H2O
解析 Ⅰ.(1)①2NO(g)??N2O2(g);②N2O2(g)+O2(g)??2NO2(g),而目标反应2NO(g)+O2(g)??2NO2(g)的ΔH=①+②=ΔH1+ΔH2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则K==。(2)因为决定2NO(g)+O2(g)??2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2。
Ⅱ.(3)满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的反应速率比为1∶2,所以B、D为平衡点。(4)反应后溶液中c(NH)=c(Cl-)=0.01 mol·L-1,c(NH3·H2O)= mol·L-1-c(NH)= mol·L-1,c(OH-)=1×10-7 mol·L-1,则Kb===
eq f(2×10-9,a-0.02);设氨水的体积为V mL,则根据稀释定律可知:=a mol·L-1
×0.2 L,解得V≈21.5a mL。(5)NO得电子生成铵根,离子方程式为NO+5e-+6H+===NH+H2O,为阴极反应,阳极上SO2失电子形成硫酸。
C组
1.[2016·全国卷Ⅲ,27(2)(3)(4)]煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol·
L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子
SO
SO
NO
NO
Cl-
c/mol·L-1
8.35×10-4
6.87×10-6
1.5×10-4
1.2×10-5
3.4×10-3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
________________________________________________________________________。
增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________________________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pe如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均________(填“增大”“不变”或“减小”)。
②反应ClO+2SO??2SO+Cl-的平衡常数K表达式为_____________________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是____________________。
②已知下列反应:
SO2(g)+2OH-(aq)===SO(aq)+H2O(l) ΔH1
ClO-(aq)+SO(aq)===SO(aq)+Cl-(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_____。
答案 (2)①4NO+3ClO+4OH-===4NO+3Cl-+2H2O 提高 ②减小 ③大于 NO溶解度较低(或脱硝反应活化能较高) (3)①减小 ②K= (4)①形成硫酸钙沉淀,反应平衡向产物方向移动,SO2转化率提高
②ΔH1+ΔH2-ΔH3
解析 (2)①亚氯酸钠具有氧化性,可将NO气体氧化为NO,则NaClO2溶液脱硝过程中主要反应的离子方程式为4NO+3ClO+4OH-===4NO+3Cl-+2H2O。该反应是一个气体体积减小的反应,增大压强,有利于反应向消耗NO的方向进行,所以增大压强,NO的转化率提高。②脱硝反应消耗OH-,故随着吸收反应的进行,吸收剂溶液的pH逐渐减小。③根据题中表格数据发现,反应一段时间后溶液中SO的离子浓度最大,说明脱硫反应速率大于脱硝反应速率。原因除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高。(3)①由图分析可知,温度升高,SO2或NO平衡分压的负对数均减小,说明升高温度,平衡逆向移动,因此脱硫、脱硝反应的平衡常数均减小。②根据反应ClO+2SO??2SO+Cl-可写出其平衡常数表达式为K=。(4)①相对于NaClO,Ca(ClO)2能形成CaSO4沉淀,有利于平衡向脱硫方向移动,提高了SO2的转化率。②将题中的3个反应依次标记为①、②、③,根据盖斯定律,①+②-③即得所求的反应,ΔH=ΔH1+ΔH2-ΔH3。
2.直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO)∶n(HSO)变化关系如下表:
n(SO)∶n(HSO)
91∶9
1∶1
9∶91
pH
8.2
7.2
6.2
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_________________
________________________________________________________________________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
当阴极室中溶液pH升到8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________
________________________________________________________________________。
答案 (1)酸 NaHSO3溶液中的HSO存在两个平衡:HSO??H++SO和HSO+H2O??H2SO3+OH-,HSO的电离程度大于其水解程度
(2)H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO电离生成SO,且Na+进入阴极室,吸收液得以再生
3.化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑,工作原理如图甲所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(1)电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
(2)电解过程中,须将阴极产生的气体及时排出,其原因是______________________
________________________________________________________________________。
(3)c(Na2FeO4)随初始c(NaOH)的变化如图乙,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
________________________________________________________________________
________________________________________________________________________。
答案 (1)阳极室 (2)防止Na2FeO4与H2反应使产率降低
(3)M点:c(OH-)低,Na2FeO4稳定性差,且反应慢[或N点:c(OH-)过高,铁电极上有Fe(OH)3生成,使Na2FeO4产率降低]
解析 (1)由电解装置图可知,阳极为Fe电极,阴极为Ni电极,电解总反应为Fe+2H2O+2OH-FeO+3H2↑;装置通电后,铁电极附近生成紫红色的FeO
,镍电极有气泡产生,则阳极反应式为Fe+8OH--6e-===FeO+4H2O,阴极反应式为6H2O+6e-===6OH-+3H2↑,由于阳极反应中消耗OH-,故电解一段时间后,阳极室c(OH-)降低。
(2)Na2FeO4易被H2还原,电解过程中,将阴极产生的气体(H2)及时排出,可防止Na2FeO4被H2还原,使其产率降低。
(3)由c(Na2FeO4)随初始c(NaOH)的变化图可知,当c(NaOH)=14 mol·L-1时,c(Na2FeO4)达到最大值。Na2FeO4只在强碱性条件下稳定,M点在最高值之前,溶液中c(OH-)较低,Na2FeO4的稳定性差,且反应速度慢。由题中信息“若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质”,即有Fe(OH)3生成;N点在最高值之后,溶液中c(OH-)过大,铁电极上有Fe(OH)3生成,使Na2FeO4的产率降低。
4.炼铁高炉中存在以下热化学方程式:
Ⅰ.C(s)+CO2(g)===2CO(g) ΔH1=172.5 kJ·mol-1
Ⅱ.Fe2O3(s)+CO(g)??2FeO(s)+CO2(g) ΔH2=-3 kJ·mol-1
Ⅲ.FeO(s)+CO(g)??Fe(s)+CO2(g) ΔH3=-11 kJ·mol-1
Ⅳ.Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g) ΔH4
(1)上述反应中,ΔH4=________ kJ·mol-1。
(2)在实际生产中炼铁高炉中通入适量的空气,其主要作用是_____________________
________________________________________________________________________。
(3)T ℃时,在1 L的密闭容器中加入20.0 g Fe2O3和3.6 g C,只发生反应:2Fe2O3(s)+3C(s)??4Fe(s)+3CO2(g),20 min后达到平衡,固体质量变成19.2 g,用CO2表示的反应速率为__________。
(4)炼铁过程中发生反应:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)。
①下图中能表示该反应的平衡常数对数值(1g K)与温度的关系的是________(填“Ⅰ”或“Ⅱ”),原因是__________________________________________________________
________________________________________________________________________。
②1 500 ℃时,在某体积可变的密闭容器中按物质的量比1∶3加入Fe2O3和CO,则达平衡时Fe2O3转化率是______________________。
③下列说法能够提高Fe2O3转化率的是____________(填字母)。
A.升高反应体系的温度
B.加入适量的Na2O固体
C.对体系加压
D.增大CO在原料中的物质的量比
答案 (1)-25 (2)与C反应产生热量,制备还原性气体CO
(3)0.005 mol·L-·min-1 (4)①Ⅰ 因为该反应正向放热,升高温度,平衡逆向移动,K减小,lg K减小
②50% ③BD
解析 (1)已知Ⅰ.C(s)+CO2(g)===2CO(g) ΔH1=172.5 kJ·mol-1
Ⅱ.Fe2O3(s)+CO(g)??2FeO(s)+CO2(g) ΔH2=-3 kJ·mol-1
Ⅲ.FeO(s)+CO(g)??Fe(s)+CO2(g) ΔH3=-11 kJ·mol-1
根据盖斯定律,由Ⅱ+Ⅲ×2得反应Ⅳ.Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g) ΔH4=ΔH2+ΔH3×2=-3 kJ·mol-1-11×2 kJ·mol-1=-25 kJ·mol-1。(2)在实际生产中炼铁高炉中通入适量的空气,其主要作用是与C反应产生热量,制备还原性气体CO。(3)根据反应Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)可知,固体减少的质量为生成的二氧化碳的质量,即(20.0+3.6-19.2) g=4.4 g,物质的量为0.1 mol,用CO2表示的反应速率为=0.005 mol·L-1·min-1。(4)①因为该反应正向放热,升高温度,平衡逆向移动,K减少,lg K减小,图中能表示该反应的平衡常数对数值(lg K)与温度的关系的是Ⅰ。②1 500 ℃时,lg K=0,则K==1,根据反应Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g),则参与反应的CO和剩余的CO相等,在某体积可变的密闭容器中按物质的量比1∶3加入Fe2O3和CO,则达平衡时Fe2O3的转化率与CO的转化率相等,为50%。③反应Fe2O3(s)+3CO(g)??4Fe(s)+3CO2(g)是气体体积不变的放热反应,升高反应体系的温度,平衡逆向移动,Fe2O3转化率减少,选项A不选;加入适量的Na2O固体与二氧化碳反应,平衡正向移动,Fe2O3转化率增大,选项B选;对体系加压,平衡不移动,Fe2O3转化率不变,选项C不选;增大CO在原料中的物质的量比,消耗更多的Fe2O3,转化率增大,选项D选。