- 2024-03-26 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年贵州省思南中学高二上学期期末考试化学试题 解析版
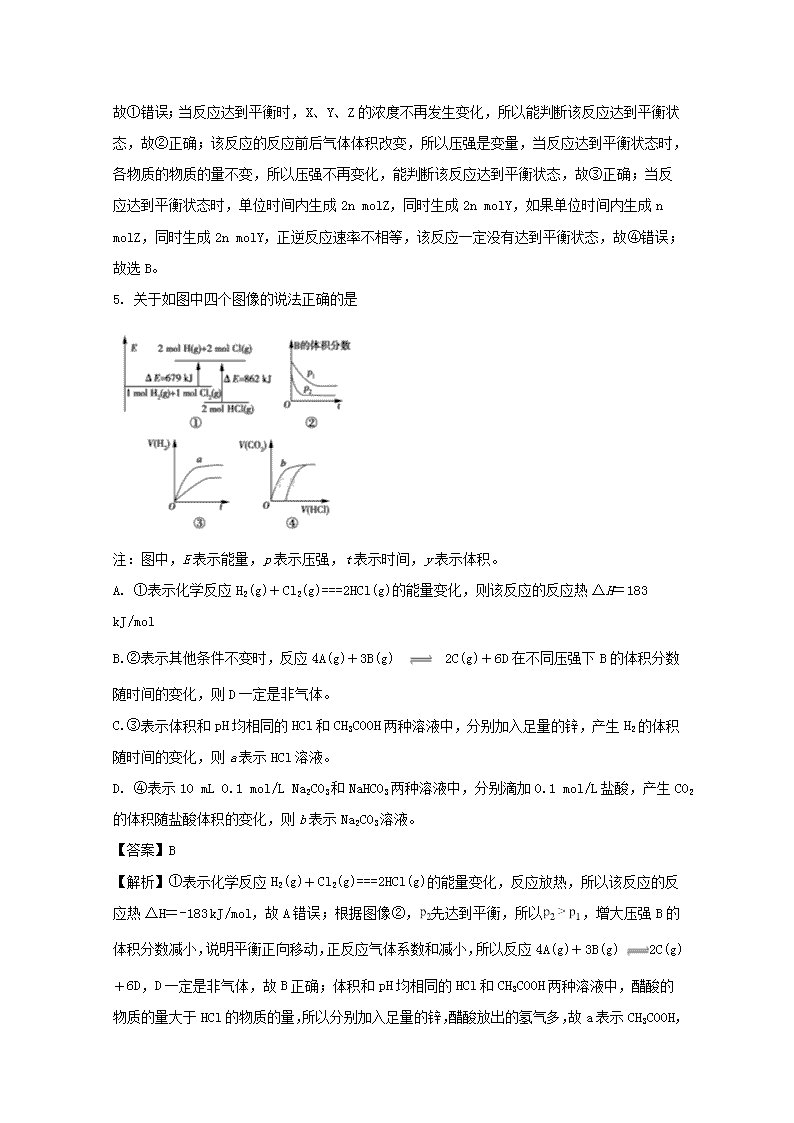
贵州省思南中学2017-2018学年高二上学期期末考试化学试卷 考试说明:1.考试时间120分钟,总分100分。 2.可能用到的相对原子量:H 1 O 16 Cu 63.5 3.考生务必将答案答在答题卡上的指定区域内。 一、选择题(本题包括18个小题,每小题3分,共54分) 1. 新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源的是 ①煤 ②火力发电 ③太阳能 ④生物质能 ⑤石油 ⑥氢能 A. ①②③ B. ③④⑥ C. ②③⑤ D. ②④⑤ 【答案】B 2. 某化学反应的能量变化如下图所示。下列有关叙述正确的是 A. 该反应的反应热ΔH=E2-E1 B. a、b分别对应有催化剂和无催化剂的能量变化。 C. 催化剂不能改变反应的活化能。 D. 催化剂能改变反应路径,但不能改变反应的焓变。 【答案】D 【解析】该反应吸热,反应热ΔH=E1-E2,故A错误;催化剂可以降低活化能,所以a、b分别对应有无催化剂和有催化剂的能量变化,故B错误;催化剂能改变反应的活化能,故C错误;催化剂通过改变反应路径,改变活化能,但不能改变反应的焓变,故D正确。 3. 已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1; H2SO4(浓)+NaOH(aq)=== Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是 A. 上述热化学方程式中的计量数表示分子数。 B. ΔH1>ΔH2 C. ΔH2应为H2SO4(浓)溶于水的能量变化与中和热之和。 D. |ΔH1|〈|ΔH2| 【答案】A 【解析】热化学方程式中的计量数表示物质的量,故A错误;浓硫酸溶于水放热,故含 mol H2SO4的浓H2SO4与1 mol NaOH反应时,放出的热量大于57.3 kJ,但焓变为负值,所以ΔH1>ΔH2,故B正确;根据盖斯定律,ΔH2为H2SO4(浓)溶于水的能量变化与中和热之和,故C正确;浓硫酸溶于水放热,故含 mol H2SO4的浓H2SO4与1 mol NaOH反应时,放出的热量大于57.3 kJ,所以|ΔH1|〈|ΔH2|,故D正确。 点睛:焓变比较大小时,带符号进行比较,对于吸热反应吸热越多焓变越大,对于放热反应,放热越多焓变越小,如:含 mol H2SO4的浓H2SO4与1 mol NaOH反应时,放出的热量大于57.3 kJ,所以ΔH1>ΔH2。 4. 一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)2Z(气)一定达到化学平衡状态的是 ①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y A. ①② B. ①④ C. ②③ D. ③④ 【答案】C 【解析】X、Y、Z的物质的量之比为1∶2∶2 时,浓度不一定不再改变,所以反应不一定平衡,故①错误;当反应达到平衡时,X、Y、Z的浓度不再发生变化,所以能判断该反应达到平衡状态,故②正确;该反应的反应前后气体体积改变,所以压强是变量,当反应达到平衡状态时,各物质的物质的量不变,所以压强不再变化,能判断该反应达到平衡状态,故③正确;当反应达到平衡状态时,单位时间内生成2n molZ,同时生成2n molY,如果单位时间内生成n molZ,同时生成2n molY,正逆反应速率不相等,该反应一定没有达到平衡状态,故④错误;故选B。 5. 关于如图中四个图像的说法正确的是 注:图中,E表示能量,p表示压强,t表示时间,y表示体积。 A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol B. ②表示其他条件不变时,反应4A(g)+3B(g)2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。 C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。 D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。 【答案】B 【解析】①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,反应放热,所以该反应的反应热ΔH=-183 kJ/mol,故A错误;根据图像②,先达到平衡,所以 ,增大压强B的体积分数减小,说明平衡正向移动,正反应气体系数和减小,所以反应4A(g)+3B(g) 2C(g)+6D,D一定是非气体,故B正确;体积和pH均相同的HCl和CH3COOH两种溶液中,醋酸的物质的量大于HCl的物质的量,所以分别加入足量的锌,醋酸放出的氢气多,故a表示CH3COOH, 故C错误;Na2CO3与盐酸反应开始时生成NaHCO3,开始不生成二氧化碳气体,所以B表示NaHCO3,故D错误。 点睛:碳酸钠中滴入盐酸,碳酸钠先与盐酸反应生成碳酸氢钠,再滴入盐酸碳酸氢钠与盐酸反应放出二氧化碳气体,反应过程可以表示为 ,所以用盐酸可以鉴别碳酸钠和碳酸氢钠溶液。 6. 已知反应A(g)+B(g) C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是 温度/℃ 700 830 1200 K值 1.7 1.0 0.4 A. 达到平衡后,B的转化率为50% B. 增大压强,正、逆反应速率均加快 C. 该反应为吸热反应,升高温度,平衡正向移动 D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1 【答案】C 【解析】试题分析:设平衡时参加反应的B的物质的量为xmol,则: A(g)+B(g)C(g)+D(g) 开始(mol·L-1):0.2 0.2 0 0 变化(mol·L-1):x x x x 平衡(mol·L-1):0.2-x 0.2-x x x 故=1,解得x=0.1 所以平衡时B的转化率为×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)==0.005mol·L-1·s-1 ,故D正确,故选C。 考点:本题考查化学平衡计算、化学平衡影响因素、平衡常数有关计算、反应速率影响因素等,难度中等。 7. 浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述正确的是 A. MOH为弱碱,ROH为强碱 B. ROH的电离程度:a点大于b点 C. 若两溶液无限稀释,则它们的c(OH-)相等 D. 当lg=2时,若两溶液同时升高温度,则增大 【答案】C ..................... 8. 下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是 选项 离子组 加入试剂 加入试剂后发生反应的离子方程式 A Fe2+、NO3-、NH4+ NaHSO4溶液 3Fe2++NO3- +4H+=3Fe3++NO↑+2H20 B Ca2+、HCO3-、Cl- 少量NaOH溶液 Ca2++2HCO3- +2OH-=2H2O+CaCO3↓+CO32- C K+、AlO2-、HCO3- 通入少量CO2 2AlO2-+3H2O+CO2=2Al(OH) 3↓+CO32- D NH4+、Al3+、SO42- 少量Ba (OH) 2溶液 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O A. A B. B C. C D. D 【答案】A 【解析】试题分析:A、离子能够大量共存,NaHSO4=Na++H++SO42-,NO3-在酸性条件下,具有强氧化性,能把Fe2+氧化成Fe3+,离子反应方程方式正确,故正确;B、少量定为1,离子反应方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,故错误;C、AlO2-和HCO3-不能大量共存,生成Al(OH)3沉淀和CO32-,故错误;D、Al3+结合OH-能力强于NH4+,因此是Al3+结合OH-生成Al(OH)3↓,故错误。 考点:考查离子共存、离子反应方程式正误判断等知识。 9. 常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 A. HA为强酸 B. 该混合液pH=7 C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A-)+c(Y)=c(Na+) 【答案】D 【解析】试题分析:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,发生反应HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH- ,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA),选D。 考点:考查酸碱混合溶液的定性判断,溶液PH值、盐类水解等知识。 视频 10. 下列说法正确的是 A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。 B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。 C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。 D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 【答案】A 【解析】水的离子积常数KW只与温度有关,若外加酸、碱, c(H+)或c(OH-)增大,抑制水的电离;若外加盐,如加入氯化钠不影响水的电离,加入碳酸钠促进水电离,故A正确;Ksp与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误;NH3·H2O的电离平衡常数只与温度有关,所以NH3·H2O溶液中加入少量NH4Cl晶体,Kb不变,故C错误;醋酸中 ,氨水中,所以只有同浓度的CH3COOH、NH3·H2O溶液中的c(H+)与c(OH-)才相等,故D错误。 点睛:水的离子积常数、弱电解质的电离平衡常数与温度有关,与溶液的浓度、与溶液是否存在其它电解质无关;如常温下,纯水和盐酸溶液中水的离子积都是 。 11. 常温下,将浓度均为0.1 mol/L HA溶液和NaOH溶液等体积混合,混合溶液的pH=9,下列说法正确的是 A. 该混合溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) B. 该混合溶液中:c(HA)+c(A-)=0.1 mol/L C. 常温下,0.1 mol/L HA溶液的pH=1 D. 0.1 mol/L HA溶液中:c(HA)>c(A-) 【答案】D 【解析】试题分析:A、根据电荷守恒c(A-)+c(OH-)=c(Na+)+c(H+)可知,A错误;B、根据物料守恒可知混合后的溶液中c(HA)+c(A¯)=0.05mol/L,B错误;C、常温下,将浓度均为0.1 mol/L HA溶液和NaOH溶液等体积混合,混合溶液的pH=9,这说明生成的NaA水解溶液显碱性,因此HA为弱酸,所以0.1mol/LHA溶液的pH>1,C错误;D、由于HA的电离程度很小,因此0.1 mol/L HA溶液中c(HA)>c(A¯),D正确,答案选D。 考点:考查弱电解质的电离、离子浓度大小的比较。 12. 已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断不正确的是 A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)较小。 B. 25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大。 C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp与在20 mL 0.01 mol/L NH4Cl溶液中的Ksp相同,但前者的溶解度比后者小。 D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2。 【答案】D 【解析】Mg(OH)2、MgF2结构相似,Ksp越大越易溶,饱和Mg(OH)2溶液与饱和MgF2溶液相比,Mg(OH)2的c(Mg2+)较小,故A正确;在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,NH4+结合氢氧根离子,使氢氧根离子浓度减小,Mg(OH)2沉淀溶解平衡正向移动,c(Mg2+)增大,故B正确;Ksp只与温度有关,氨水中氢氧根离子浓度大,抑制Mg(OH)2溶解,NH4Cl溶液中NH4+结合氢氧根离子,促进Mg(OH)2溶解,故C正确;Mg(OH)2的悬浊液中加入NaF溶液后,F-的浓度很大,氢氧根离子浓度小,所以Mg(OH)2能转化为MgF2,故D错误。 13. 碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是 A. Zn为负极,MnO2为正极。 B. Zn为正极,MnO2为负极。 C. 工作时电子由MnO2经外电路流向Zn极。 D. Zn电极发生还原反应,MnO2电极发生氧化反应。 【答案】A 【解析】Zn失电子为负极,MnO2得电子为正极,故A正确;根据电池的电极反应,Zn失电子为负极,MnO2得电子为正极,故B错误;工作时电子由Zn经外电路流向MnO2极,故C错误;Zn电极失电子发生氧化反应,MnO2电极得电子发生还原反应,故D错误。 点睛:原电池中失电子发生氧化反应的一极是负极,得电子发生还原反应的一极是正极;工作时电子由负极经外电路流向正极;溶液中阳离子移向正极、阴离子移向负极。 14. 为保护地下钢管不受腐蚀,可使它与 A. 交流电源火线相连 B. 铜板相连 C. 锌板相连 D. 直流电源正极相连 【答案】C 【解析】A.根据电化学防护方法,受保护的金属应与直流电源负极相连不能与交流电源相连,故A错误; B.如果与Cu连接,Fe、Cu和电解质溶液构成原电池,Fe易失电子作负极,加速被腐蚀,故B错误; C.与锌板相连,Fe、Zn和电解质溶液构成原电池,Zn易失电子作负极、Fe作正极,则Fe被保护,故C正确; D.与直流电源正极相连,则钢铁作阳极,加速被腐蚀,故D错误; 点睛:金属的电化学防护方法:①外加电流阴极保护法:把金属连接在电源的负极上,被保护的金属不再失电子;②牺牲阳极保护法:在金属上连接比它更活泼的另一金属,活泼金属发生氧化反应被腐蚀。 15. 根据如图回答,下列说法正确的是 A. 此装置若用于铁表面镀铜时,a为铁。 B. 此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。 C. 燃料电池中正极反应为:O2+4e-+2H2O===4OH- D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。 【答案】D 【解析】左侧装置为燃料电池,通入氧气的一极是正极,通入氢气的一极是负极;此装置若用于铁表面镀铜时,a为铜、b为铁,故A错误;电镀铜时,硫酸铜溶液的浓度不变,故B错误;酸性电解质,燃料电池中正极反应为:O2+4e-+4H+===2H2O,故C错误;当有1 mol 水生成时转移2mol电子,b电极生成1mol铜,增重64 g,故D错误。 16. 纯净物X、Y、Z转化关系如图所示,下列判断不正确的是 A. X可能是金属铜 B. Y可能是氢气 C. Z可能是氯化钠 D. Z不可能是三氧化硫 【答案】C 【解析】若X是金属铜、Y是氯气,则Z是氯化铜,电解氯化铜溶液生成铜和氯气,故A正确;若Y是氢气、X是氯气,则Z是氯化氢,电解稀盐酸生成氢气和氯气,故B正确;钠与氯气反应生成氯化钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,故C错误;若Z是三氧化硫,则Z的水溶液是硫酸,电解硫酸生成氢气和氧气,氢气和氧气反应生成水,所以Z不可能是三氧化硫,故D正确。 17. 温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表: t/s 0 50 150 250 350 n(Y)/mol 0 0.32 0.38 0.40 0.40 下列说法不正确的是 A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1 B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0 C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20 D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆) 【答案】D 【解析】反应前250 s的平均速率为v(Y) = 0.000 8 mol·L-1·s-1,故A正确;保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,说明平衡正向移动,则反应的ΔH>0,故B正确;平衡常数只与温度有关, ,故C正确;相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z, ,所以达到平衡前v(正)查看更多
相关文章
您可能关注的文档
- 2017-2018学年贵州省思南中学高二上学期期末考试化学试题 解析版
- 机电一体化企业发展状况调研-调查报告
- 河北省临漳县第一中学2020学年高二物理上学期第三次月考试题(无答案)
- 2019-2020学年内蒙古翁牛特旗乌丹第二中学高二上学期期中考试生物试题 Word版
- 【解析版】安徽省舒城中学2017届高三上学期新课程自主学习系列训练政治试题
- 简单的个人房屋租赁合同最新文本
- 2020年加油站副经理个人述职报告
- 2018-2019学年云南省玉溪市民族中学高一上学期月考物理试卷
- 2017-2018学年广西南宁市马山县金伦中学、华侨、新桥、罗圩中学高二上学期期中联考物理试题
- 班主任(心得)之小学低年级班主任工作心得