- 2024-03-15 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高三化学 全国卷高考化学模拟试题七(全国I) Word版含答案
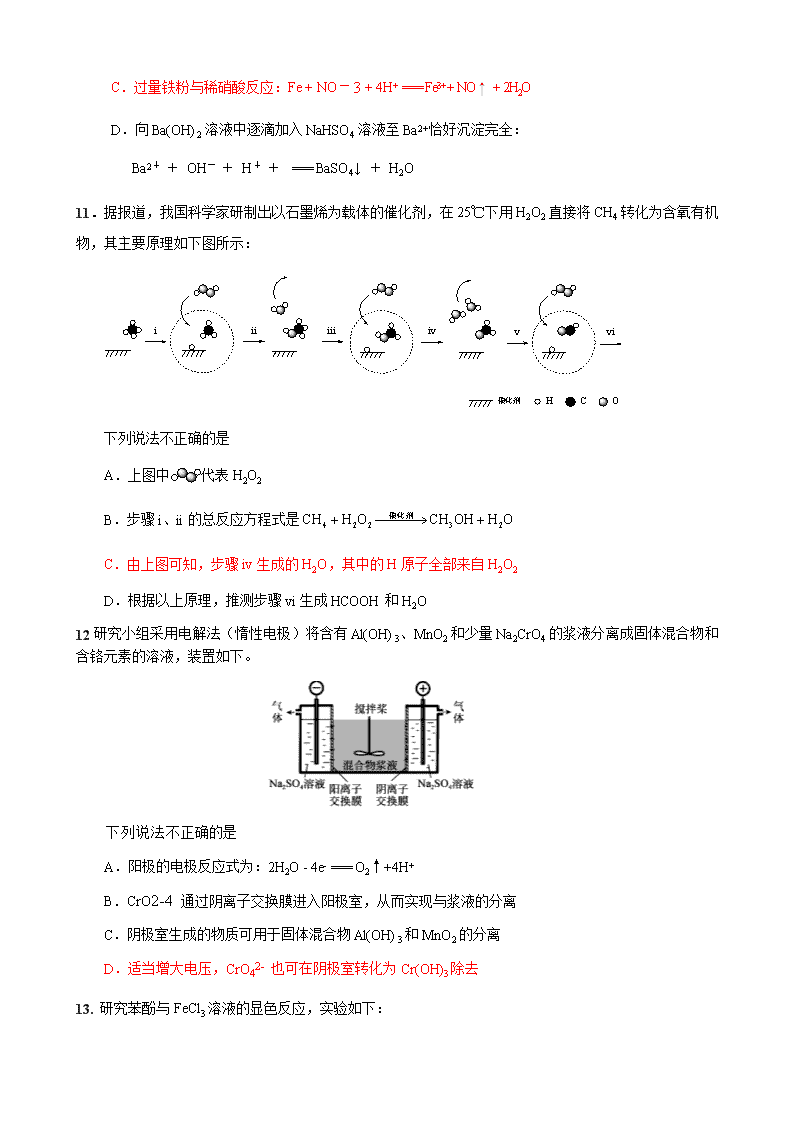
2020届高三化学 全国卷高考化学模拟试题七 (考试用时:45分钟 试卷满分:100分) 第Ⅰ卷(选择题 共42分) 本卷共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.下列物质的主要成分(括号中)不包括ⅣA族元素的是 A.石英石 [SiO2] B.猫眼石 [Be3Al2Si6O18] C.孔雀石 [Cu2(OH)2CO3] D.红宝石 [Al2O3] 8.下列物质转化关系,在给定条件下都能实现的是 ① ② ③ ④ A.①② B.①③ C.①②③ D.②③④ 9.工业制备硝酸的反应之一为:3NO2 + H2O === 2HNO3 + NO。用NA表示阿伏加德罗常数,下列说法正确的是 A.室温下,22.4 L NO2 中所含原子总数为3 NA B.36 g H2O中含有共价键的总数为2NA C.上述反应,生成1 mol HNO3转移电子的数目为NA D.标准状况下,11.2 L NO中所含电子总数为5 NA 10.下列解释事实的离子方程式不正确的是 A.用石墨电极电解饱和食盐水:2Cl- + 2H2O === 2OH-+ H2↑+ Cl2↑ B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO2-3 CaCO3(s) + SO2-4 C.过量铁粉与稀硝酸反应:Fe + NO-3 + 4H+ === Fe3+ + NO↑ + 2H2O D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全: Ba2+ + OH- + H+ + === BaSO4↓ + H2O 11.据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如下图所示: 下列说法不正确的是 A.上图中代表H2O2 B.步骤i、ii的总反应方程式是 C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2 D.根据以上原理,推测步骤vi生成HCOOH和H2O 12研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。 下列说法不正确的是 A.阳极的电极反应式为:2H2O - 4e- === O2↑+4H+ B.CrO2-4 通过阴离子交换膜进入阳极室,从而实现与浆液的分离 C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离 D.适当增大电压,CrO42- 也可在阴极室转化为Cr(OH)3除去 13. 研究苯酚与FeCl3溶液的显色反应,实验如下: 下列说法不正确的是 A.苯酚的电离方程式是 B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色 C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小 D.对比①②、①④中的现象,说明紫色物质的生成与溶液中 相关 第Ⅱ卷(非选择题 共58分) 本卷包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。 26.(14分) 合成氨对人类生存具有重大意义,反应为: N2(g)+3H2(g) 2NH3(g) ∆H (1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如下图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。 ① NH3的电子式是_______。 ② 写出步骤c的化学方程式_______。 ③ 由图像可知合成氨反应的∆H______0 (填“>”、“<”或“=”)。 (2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0 L的反应容器中投入5 mol N2、15 mol H2,在不同温度下分别达平衡时,混合气中NH3的 质量分数随压强变化的曲线如下图所示。 ① 温度T1、T2、T3大小关系是_______。 ② M点的平衡常数 K = _______(可用分数表示)。 (3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如下: ① 导线中电子移动方向是_______。 ② 固氮酶区域发生反应的离子方程式是_______。 ③ 相比传统工业合成氨,该方法的优点有_______。 答案 (1)① ② *NNH + H2 *N + NH3 ③ < (2)① T1< T2 < T3 ② (或 7.32×10-3) (3)① a → b ② N2 + 6H+ + 6 MV+ === 2NH3 + 6 MV2+ ③ 条件温和、生成氨的同时释放电能(其他答案合理给分) 27.(14分) 乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。 (1) 室温下,测得 0.1 mol·L−1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。 (2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图所示: ① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是 _______。 ② 0.1 mol·L−1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。 a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–) b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4) c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4) (3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为: Fe2+ + H2C2O4 + xH2O ⇌ FeC2O4·xH2O↓ + 2H+ ① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解 释原因: 。 ② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下: 称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。 已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+ 则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。 答案(1)H2C2O4 ⇌ H+ + HC2O4- ,HC2O4-⇌ C2O42- + H+ (2)① ② b c (3)① NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O ⇌ FeC2O4·xH2O↓ + 2H+ 平衡向正反应方向移动,产生更多的FeC2O4·xH2O ② 2 28.(15分) 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题: 相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和____________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式___________。 (2)“氧化”中添加适量的MnO2的作用是____________________________________。 (3)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是________________________________________________________________________ (6)写出“沉锰”的离子方程式________________________________________________ (7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=时,z=________。 答案 (1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4===2MnSO4+S+2H2O (2)将Fe2+氧化为Fe3+ (3)4.7 (4)NiS和ZnS (5)F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 (6)Mn2++2HCO===MnCO3↓+CO2↑+H2O (7) 解析 (1)硫化锰矿中硅元素主要以SiO2或不溶性硅酸盐形式存在,则“滤渣1”的主要成分为S和SiO2(或不溶性硅酸盐)。结合“滤渣1”中含S,可知“溶浸”时MnO2与MnS在酸性条件下发生氧化还原反应生成MnSO4和S,根据化合价升降法可配平该反应。(2)“溶浸”后溶液中含Fe2+,“氧化”中加入的适量MnO2能将Fe2+氧化为Fe3+。(3)“调pH”除去Fe3+和Al3+时,结合表格中数据信息可知需控制溶液的pH在4.7~6之间。(4)“除杂1”中加入Na2S能将Zn2+和Ni2+分别转化为沉淀除去,故“滤渣3”的主要成分为NiS和ZnS。(5)“除杂2”中F-与Mg2+反应生成MgF2沉淀,若溶液酸度过高,则F-与H+结合生成弱电解质HF,导致MgF2(s)Mg2+(aq)+2F-(aq)平衡向右移动,Mg2+不能完全除去。(6)“沉锰”时Mn2+与HCO反应生成MnCO3并放出CO2,由此可写出离子方程式。(7)化合物LiNixCoyMnzO2中,当x=y=时,根据化合价代数和为0得1+2×+3×+4z-2×2=0,解得z=。 请考生在第35、36两道化学题中任选一题作答。如果多做,则按所做的第一题计分。 35.(15分)【化学——选修3:物质结构与性质】 据《科技日报》报道,近日《危险物质杂志》发表俄罗斯科学家的实验结果:银纳米粒子具有高毒性。实验显示:银纳米粒子的毒性比银离子更强。银消毒商业用途越来越广,如银纳米牙膏等。如果过量摄取会导致中毒。铜、银、金位于同族,它们是生活中常用金属。 请回答下列问题: (1)在周期表中,银的周期序数比铜多1,基态银原子的价层电子排布式为________;金元素属于________区。 (2)银器变黑的原理:在空气中银器长时间与空气接触,4Ag+2H2S+O2===2Ag2S+2H2O。 ①在该反应中,断裂的化学键有________(填字母)。 A.金属键 B.离子键 C.共价键 D.氢键 ②常温常压下,H2O呈液态,H2S呈气态,其原因是____________________________。 ③H2O的热稳定性比H2S强,其原因是________________________________________。 (3)实验室广泛使用AgNO3试剂,制备AgNO3原理是3Ag+4HNO3===3AgNO3+NO↑+2H2O。 ①AgNO3晶体中阴离子立体构型是________________;与它互为等电子体的分子或离子有:_______________________________________________________________(写两种即可)。 ②已知:HNO3是强酸,HNO2是弱酸,其原因是________________________________。 (4)银是常用的催化剂。例如, ⅰ:CH2===CH2+O2(环氧乙烷) ⅱ:2CH3CH2OH+O22CH3CHO+2H2O 上述反应中,碳原子采用sp2杂化的物质名称:________。 (5)配离子[Ag(CN)2]-中配体CN-中提供孤电子对的原子是C不是N,其原因是_______。 (6)某银铜合金(M)是优质储氢材料。其晶体堆积方式为面心立方堆积(如图所示),铜位于面心,银位于顶点。已知:M晶体的摩尔质量为m g·mol-1,NA代表阿伏加德罗常数的值,M晶体密度为d g·cm-3。M晶胞参数为________pm。 答案 (1)4d105s1 ds (2)①AC ②H2O分子间存在氢键,H2S分子间只存在范德华力 ③O的原子半径小于S,H—O键键能大于H—S键 (3)①平面三角形 CO、SO3、SeO3(任写两种,答案合理即可) ②HNO3分子中非羟基氧比HNO2多1,HNO3中N的价态较高,吸引H—O键中共用电子对能力较强,易断裂H—O键 (4)乙烯、乙醛 (5)N的电负性大于C,N提供孤电子对能力比C小 (6)×1010 解析 (1)铜、银、金位于第ⅠB族,属于ds区。 (2)极性键和非极性键属于共价键。物质状态、熔点和沸点由粒子间作用力大小决定,而氢化物的热稳定性由共价键强弱决定。 (3)①NO中N价层有3个电子对,孤电子对数为0,所以它呈平面三角形结构,N采用sp2杂化,与CO、SO3、SeO3互为等电子体。②HNO3、HNO2分子中,前者非羟基氧为2,后者为1,N的价态越高,吸引H—O键中共用电子对能力越强,越容易断裂H—O键。 (4)乙烯、—CHO上C采用sp2杂化。其他碳原子采用sp3杂化。 (5)提供孤电子对的原子具备两个条件:有孤电子对、电负性相对较小。所以,CN-作配体,C提供孤电子对。 (6)1个M晶胞含3个铜、1个银。设M的晶胞参数为a,有:=d,a=×1010pm。 36.(15分)【化学——选修5:有机化学基础】 高分子H是人造棉的成分之一,其合成路线如下: (1)按官能团分类,A的类别是_______。 (2)B为不饱和醇,A→B的反应类型是_______。 (3)C的名称是_______。 (4)D的核磁共振氢谱显示其分子有2种不同环境的氢原子,D的结构简式是_______。 (5)E→F的化学方程式是_______。 (6)G分子内含有一个六元环(含“”结构)。 ① 下列试剂能使转化为的是_______(填序号)。 a. b. c. ② G→H的反应类型为缩聚反应,该反应还有生成,其化学方程式是_______。 答案(1)炔烃 (2)加成反应 (3)1,4 —丁二醇 (4) (5) (6)① a ②查看更多