- 2024-02-14 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏专版2020中考化学复习方案阶段测试02
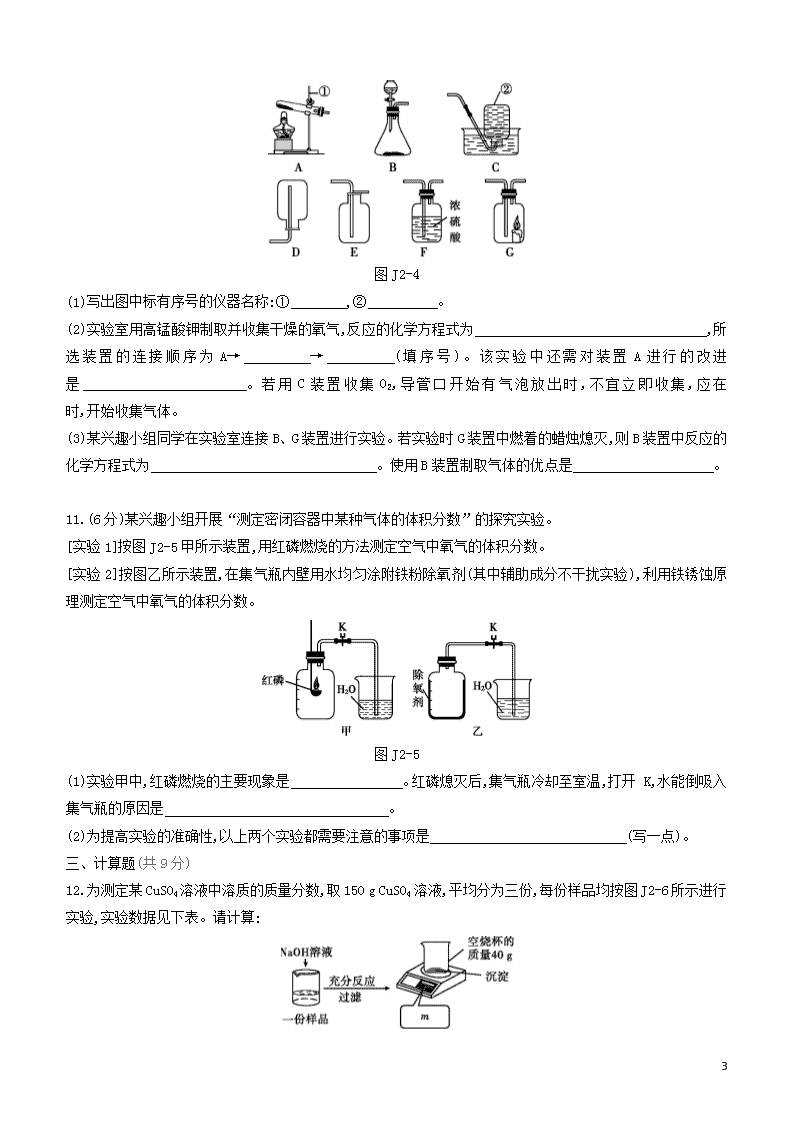
阶段测试(二) 时间:30分钟 满分:50分 一、选择题(每小题2分,共14分) 1.下列化学用语所表达的意义正确的是 ( ) A.2K——2个钾元素 B.Al3+——1个铝离子 C.O3——3个氧原子 D.2N——2个氮分子 2.香草醛(C8H8O3)是迄今为止,世界上最重要的香料添加剂,关于香草醛的说法正确的是 ( ) A.由碳、氢、氧原子构成 B.物质的相对分子质量为152 g C.一个分子中有19个原子 D.碳、氢、氧元素质量比为8∶8∶3 3. 下列对实验现象的描述符合事实的是 ( ) A.硫在空气中燃烧,发出蓝紫色火焰 B.NH4NO3固体溶于水,溶液的温度升高 C.黄铜片与铜片相互刻划,铜片上有划痕 D.打开盛有浓盐酸的试剂瓶,有大量白烟产生 4.焦亚硫酸钠在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠(Na2S2O6)中硫元素的化合价为 ( ) A.-2 B.+3 C.+4 D.+5 5.某同学制作的试剂标签如图J2-1所示,其中化学式书写不正确的是 ( ) 图J2-1 6.在一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生某个反应,测得反应前后各物质的质量如下表: 物质 甲 乙 丙 丁 反应前质量/g 20 30 20 15 反应后质量/g 0 x y 10 下列叙述错误的是 ( ) A.参加反应的甲与丁的质量比为4∶1 B.x+y=75 C.y≤20时,该反应一定是化合反应 D.x的取值范围:0≤x≤30 7.图J2-2是甲转化为丁的微观过程。下列说法正确的是 ( ) 6 图J2-2 A.转化①中原子种类不变,个数改变 B.转化②是化合反应 C.整个过程中共有2种氧化物 D.物质丁是复合肥 二、填空题(共10分) 8.(5分)有下列物质:①氧气;②氮气;③五氧化二磷;④二氧化硫;⑤二氧化碳;⑥食盐水;⑦氖气。请用这些物质的序号填空: (1)空气中含量最多的气体是 。 (2)有刺激性气味的有毒气体是 。 (3)属于混合物的是 。 (4)属于稀有气体的是 。 (5)常温下属于固体的是 。 9.(5分)从化合价和物质类别两个维度认识元素及其化合物性质是重要的化学学习方式。图J2-3是Fe及其化合物的化合价——物质类别二维图。 图J2-3 [知识卡片]在化学反应中有元素化合价升高,则必有元素化合价降低,且化合价升高的总数一定等于化合价降低的总数。 请回答下列问题。 (1)A物质所属物质类别是 。 (2)D的化学式是 。 (3)可以用 (写化学式)和D在高温下反应生成A。 (4)G可以是硫酸盐,这种硫酸盐可用作贫血病人的补血剂,写出可生成该硫酸盐的化学方程式: (只写一个)。 三、实验题(共17分) 10.(11分)实验室制取气体时需要的一些装置如图J2-4所示,请回答下列问题。 6 图J2-4 (1)写出图中标有序号的仪器名称:① ,② 。 (2)实验室用高锰酸钾制取并收集干燥的氧气,反应的化学方程式为 ,所选装置的连接顺序为A→ → (填序号)。该实验中还需对装置A进行的改进是 。若用C装置收集O2,导管口开始有气泡放出时,不宜立即收集,应在 时,开始收集气体。 (3)某兴趣小组同学在实验室连接B、G装置进行实验。若实验时G装置中燃着的蜡烛熄灭,则B装置中反应的化学方程式为 。使用B装置制取气体的优点是 。 11.(6分)某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。 [实验1]按图J2-5甲所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。 [实验2]按图乙所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。 图J2-5 (1)实验甲中,红磷燃烧的主要现象是 。红磷熄灭后,集气瓶冷却至室温,打开 K,水能倒吸入集气瓶的原因是 。 (2)为提高实验的准确性,以上两个实验都需要注意的事项是 (写一点)。 三、计算题(共9分) 12.为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每份样品均按图J2-6所示进行实验,实验数据见下表。请计算: 6 图J2-6 实验1 实验2 实验3 样品质量/g 50 50 50 NaOH溶液质量/g 20 40 60 m/g 42.45 44.9 44.9 (1)50 g CuSO4溶液完全反应时,所得沉淀的质量为 g。 (2)CuSO4溶液中溶质的质量分数。 6 【参考答案】 1.B 2.C 3.C 4.D [解析]化合物中元素化合价的代数和为0,焦亚硫酸钠中钠元素的化合价是+1,氧元素的化合价是-2,设硫元素的化合价为x,则(+1)×2+2x+(-2)×6=0,x=+5。 5.C 6.D [解析]反应前后,甲、丁分别减少了20 g、5 g,参加反应的甲与丁的质量比为4∶1,二者都为反应物。根据质量守恒定律可知,不管乙、丙是否参加反应,x+y=30+20+20+15-10=75。如果y=20,说明丙没有参加反应,x=55,乙一定是生成物,该反应是化合反应;如果y<20,说明丙是反应物,该反应仍然是化合反应。乙可能是反应物,可能是生成物,也可能没有参加反应,x的取值范围是0≤x≤75。 7.C [解析]化学反应前后,原子的种类、数量不变;转化②的化学方程式是2NH3+CO2CO(NH2)2+H2O,不是化合反应;整个过程中,二氧化碳、水属于氧化物,其他物质不属于氧化物;丁是尿素,属于氮肥,不属于复合肥。 8.(1)② (2)④ (3)⑥ (4)⑦ (5)③ 9.(1)单质 (2)Fe2O3 (3)CO(或C) (4)Fe+H2SO4FeSO4+H2↑(合理即可) [解析](1)由Fe及其化合物的化合价——物质类别二维图可知,A物质中Fe元素的化合价为0,所以A属于单质。(2)D物质中铁元素呈+3价,且属于氧化物,所以D的化学式为Fe2O3。(3)A为单质Fe,D为Fe2O3,Fe2O3在高温条件下被CO或C还原成Fe。(4)由图知,G中铁元素呈+2价,且为硫酸盐,所以G为FeSO4,可通过铁与硫酸的置换反应或铁与某些盐的置换反应来生成硫酸亚铁,反应的化学方程式为Fe+H2SO4FeSO4+H2↑,合理即可。 10.(1)铁架台 集气瓶 (2)2KMnO4K2MnO4+MnO2+O2↑ F E 需在试管口放一团棉花 气泡连续均匀冒出 (3)CaCO3+2HClCaCl2+CO2↑+H2O 可以控制反应的速率 [解析](2)实验室用高锰酸钾制取氧气,高锰酸钾加热反应生成锰酸钾、二氧化锰和氧气,据此书写化学方程式即可;若要得到干燥的氧气,氧气可以用浓硫酸干燥,再用向上排空气法收集,所选择装置的连接顺序为A→F→E;使用高锰酸钾制取氧气时,为防止高锰酸钾粉末进入导管,需在试管口放一团棉花;用排水法收集氧气,应该在气泡连续均匀冒出时再开始收集。(3)若实验时G装置中蜡烛熄灭,则B装置中生成的是二氧化碳,所选用的药品是大理石(或石灰石)和稀盐酸,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;B装置使用了分液漏斗,优点是可以控制反应速率。 11.(1)产生大量白烟 氧气被消耗,集气瓶内气压小于大气压 (2)装置的气密性良好(或红磷和铁粉除氧剂足量等其他合理答案均可) 12.(1)4.9 (2)解:设50 g CuSO4溶液中溶质的质量为x。 CuSO4+2NaOHCu(OH)2↓+Na2SO4 160 98 6 x 4.9 g 16098=x4.9 g x=8 g CuSO4溶液中溶质的质量分数为8 g50 g×100%=16%。 答:CuSO4溶液中溶质的质量分数为16%。 6查看更多
相关文章
您可能关注的文档
- 江苏专版2020中考化学复习方案阶段测试02
- 一年级上册美术课件-17漂亮的染花纸 |广西版 (共11张PPT)
- 2021届一轮复习人教版化学实验方案的设计与评价作业
- 云南省大理市下关第一中学2019-2020学年高一上学期期末考试政治试题
- 六年级下册语文素材-小升初字词、古诗文与作文素材积累41 全国通用
- 班主任(心得)之德育(心得):推行副班主任制度的思考
- 2017-2018学年陕西省西安中学高二下学期期末考试地理试题 Word版
- 历史理卷·2018届海南省海南中学高二上学期期末考试(2017
- 信访工作总结-信访局关于上半年信访工作总结与下半年工作打算
- 2020年精选商场导购员辞职报告模板【五篇】