- 2024-01-17 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【推荐】2018年9月16日 每周一测-试题君之每日一题君2018-2019学年上学期高二化学人教版(课堂同步系列一)
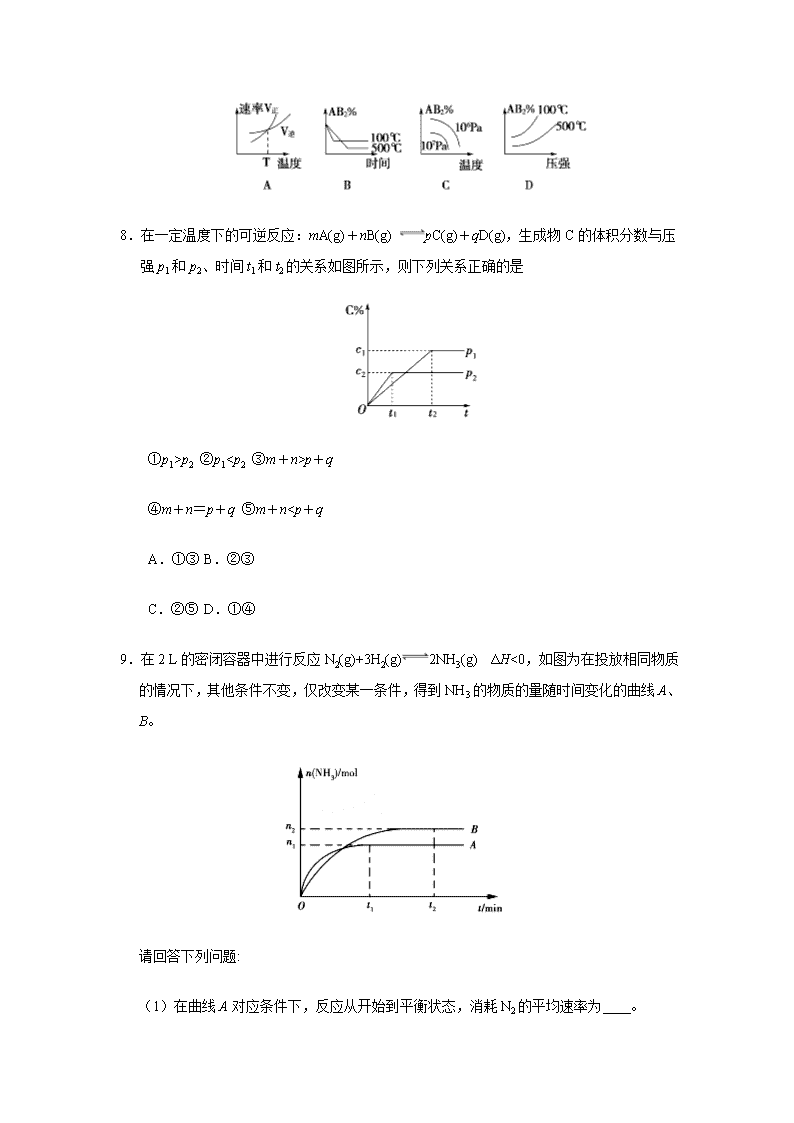
高考频度:★★★★☆ 难易程度:★★★☆☆ 1.对于密闭容器中进行的反应:2SO2+O22SO3,如果温度保持不变,下列说法中正确的是 A.增大SO2的浓度,逆反应速率减小 B.使用合适的催化剂,平衡常数增大 C.增大SO2的浓度,平衡常数增大 D.减小O2的浓度,平衡常数不变 2.下列变化一定会引起平衡移动的是 ①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化 A.①②⑥⑦⑧ B.②④⑤⑥⑧ C.②④⑤⑥⑦ D.③④⑦⑧ 3.下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是 A.SO2(g)+NO2(g) SO3(g)+NO(g) ΔH<0 B.C(s)+CO2(g) 2CO(g) ΔH>0 C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 D.H2S(g) H2(g)+S(s) ΔH>0 4.如图为800 ℃时A、B、C三种气体在密闭容器中反应时的浓度变化,从图上分析,下列结论错误的是 A.发生的反应可表示为2A(g)2B(g)+C(g) B.前2 min A的分解速率为0.1 mol·L-1·min-1 C.开始时,正逆反应同时进行 D.2 min时,A、B、C的浓度之比为2∶3∶1 5.已知反应:A(g)+3B(g)2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是 A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动 B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动 C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 6.在一个不导热的密闭反应器中,只发生两个反应: a(g)+b(g)2c(g) ΔH1<0 x(g)+3y(g)2z(g) ΔH2>0 进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是 A.等压时,通入惰性气体,c的物质的量不变 B.等压时,通入z气体,反应器中温度升高 C.等容时,通入惰性气体,各反应速率不变 D.等容时,通入z气体,y的物质的量浓度增大 7.对于反应A2(g)+2B2 (g) 2AB2(g) ΔH<0 ,下列各图所表示的变化符合勒夏特列原理的是 8.在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是 ①p1>p2 ②p1查看更多
相关文章
您可能关注的文档
- 当前文档收益归属上传用户
- 下载本文档