- 2024-01-16 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届云南省大理州南涧县民族中学高二3月月考(2018
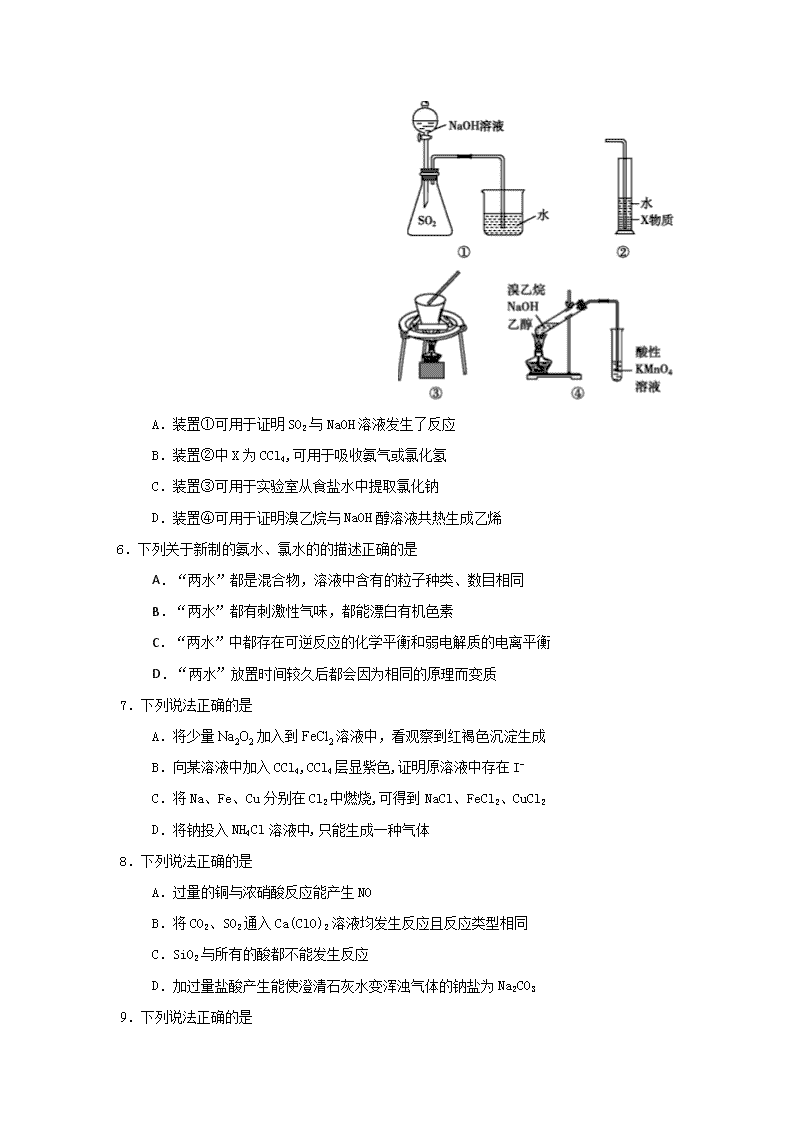
南涧县民族中学2017——2018学年下学期3月月考 高二化学(理)试题 (全卷二个大题,共25个小题,8页;满分100分,考试用时120分钟) 可能用到的相对原子质量:H:1; C:12; O:16; Na:23; S:32; Fe:56; Cu:64;Zn:65 第Ⅰ卷(选择题 共42分)【来源:全,品…中&高*考+网】 一、单项选择题(本大题共21小题,每小题2分,共42分。每小题只有一项最符合题目要求) 1.化学与生活、社会密切相关。下列说法正确的是 A.加碘盐的溶液遇淀粉变蓝 B.汽油和乙烯均为石油分馏得到的产品 C.CaO可用作工业废气的脱硫剂 D.蔗糖、淀粉、油脂水解均能生成电解质 2.下列化学用语正确的 A.乙烯的结构简式:CH2CH2 B.次氯酸的结构式:H-Cl-O C.中子数为16的磷原子: D.间硝基甲苯的结构简式: 3.下列应用涉及氧化还原反应的是 A.粗盐提纯 B.人工固氮 C.工业制氧 D.玻璃刻字 4.下列有关物质的性质与应用相对应的是 A.NH3极易溶于水,可用作制冷剂 B.Al2O3熔点高,可用作耐火材料 C.SO2具有氧化性,可用于漂白品红,织物等 D.BaCO3能与盐酸反应,可用于治疗胃酸过多 5.下列装置或操作能达到实验目的的是 A.装置①可用于证明SO2与NaOH溶液发生了反应 B.装置②中X为CCl4,可用于吸收氨气或氯化氢 C.装置③可用于实验室从食盐水中提取氯化钠 D.装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯 6.下列关于新制的氨水、氯水的的描述正确的是 A.“两水”都是混合物,溶液中含有的粒子种类、数目相同 B.“两水”都有刺激性气味,都能漂白有机色素 C.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡 D.“两水”放置时间较久后都会因为相同的原理而变质 7.下列说法正确的是 A.将少量Na2O2加入到FeCl2溶液中,看观察到红褐色沉淀生成 B.向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- C.将Na、Fe、Cu分别在Cl2中燃烧,可得到NaCl、FeCl2、CuCl2 D.将钠投入NH4Cl溶液中,只能生成一种气体 8.下列说法正确的是 A.过量的铜与浓硝酸反应能产生NO B.将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 C.SiO2与所有的酸都不能发生反应 D.加过量盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 9.下列说法正确的是 A.浓度相同的NaNO3溶液和HNO3溶液中NO3—化学性质相同 B.等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同 C.可以通过化学反应将淀粉转化为乙酸 D.所有加聚产物都不能与Br2(CCl4)发生加成反应 10.设NA为阿伏伽德罗常数的值,下列说法正确的是 A.22.4L CO2与足量Na2O2完全反应,转移电子数为2NA B.6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA C.1mol/L的NaCl溶液中Cl—的数目为NA D.标况下,22.4L NO和11.2L O2,混合后气体分子数为NA 11.关于相同体积、物质的量浓度的NaHCO3溶液和Na2CO3溶液,下列说法不正确的是 A.滴加酚酞后溶液均变红 B.可用澄清石灰石鉴别 C.可用CaCl2溶液鉴别 D.加入足量的盐酸,产生的气体的物质的量相同 12.在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是 A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ B.在含I-、S2—、Br-的溶液中不断通入氯气:I-、Br-、S2— C.在含AlO2—、SO32—、OH-的溶液中逐滴加入盐酸:OH-、AlO2—、SO32— D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ 13.下列离子方程式书写正确的是 A.沸水中滴入FeCl3饱和溶液:Fe3++3H2OFe(OH)3↓+3H+ B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ C.用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2=HCO3— D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 14.为提纯下列物质(括号内物质为杂质),所选用的除杂试剂和分离方法正确的是 被提纯的物质 除杂试剂 分离方法 A 乙酸乙酯(乙醇) 乙酸 加热回流 B 乙烷(乙烯) 酸性KMnO4 洗气 C 乙醇(乙酸) 氧化钙 蒸馏 D 苯(溴) 碘化钾溶液 分液 15.已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水。下列说法错误的是 A.稳定性:A2B>A2E B.工业上常用电解法制得C和D的单质 C.简单离子的半径:C>D>E>B D.单质D可用于冶炼某些难熔金属 16.已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是 A.若A是铁,则E可能为稀硝酸 B.若A是CuO,E是碳,则B为CO C.若A是NaOH溶液,E是CO2,则B为NaHCO3 D.若A是AlCl3溶液,E可能是氨水 17.分子式为C6H12O2,属于酯类,且能发生银镜反应的同分异构体有 A.8种 B.9种 C.10种 D.11种 18.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1 已知:碳的燃烧热 ΔH1=a kJ·mol-1 S(s)+2K(s)=K2S(s) ΔH2=b kJ·mol-1 2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为 A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 19.对于化学反应mA(g)+nB(g)pC(g)+qD(g) ,A的百分含量与温度(T)的变化情况,如图所示 下列说法不正确的是 A.M点前速率v正>v逆 B.该反应为吸热反应 C.M点速率v正=v逆 D. M点以后均为平衡状态 20.酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。 下列对该有效成分的说法正确的是 A.所有原子可能共平面 B.核磁共振氢谱中有7个峰 C.能发生加聚反应生成高分子化合物 D.1 mol该物质最多能与含2 molNaOH的烧碱溶液反应 21.碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是 A. 电池工作时,锌失去电子 B. 电池负极反应为Zn+2OH--2e-=Zn(OH)2 C. 电池工作时,电流由负极通过外电路流向正极 D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 第Ⅱ卷(非选择题 共58分) 二、非选择题 22.(15分)黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,由硫与氯气再50℃~60℃直接化合而成。装置图如下: (1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾,其化学方程式为 。 (2)A装置中所盛试剂为 。 (3)操作过程中: ①先通入N2,理由是 。 ②通入少量Cl2后,装置B采用 (填“水浴”或“油浴”)加热1h。 ③停止加热,加大通入氯气量,维持16h。制备二氯化二硫为 (填“放热”或“吸热”)反应。 (4)二氯化二硫的电子式为 。 (5)装置C的作用是 ,同时制得有价值的工业产品为 。 (6)为了得到更纯净的二硫化二氯,需要在装置B、C之间安装干燥管,其内盛试剂为 。 23.(14分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。 (1)E元素形成的氧化物对应的水化物的化学式为_______________________________。 (2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。 (3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。 (4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。 (5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。 24.(14分)CO是重要的燃料和工业原料。目前,对CO的综合利用是科学家研究的热点。回答下列问题: Ⅰ.工业制备CO的方法之一是甲烷氧化法。 已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol ②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol ③2CO(g)+O2(g)=2CO2(g) △H=-330 kJ/mol (1)反应2CH4(g)+O2(g)=2CO(g)+4H2(g),△H= kJ/mol。 Ⅱ.CO也是制备AlCl3的副产品 制备AlCl3的原理为:2Al2O3(s)+6Cl2(g)4AlCl3(g)+3O2(g) △H1 (2)已知该反应在较低温度下不能自发进行,则△H1 0(填“>”“<”或“=”) (3)制备AlCl3的实际生产过程中,常加入足量的碳粉,同时生成CO(g)。T1℃时,向恒容的密闭容器中加入5molAl2O3(s)、14molC(s)和6.4molCl2(g)发生反应。Cl2(g)的浓度变化如图(a)所示;图b为20min后改变容器中条件,平衡体系的反应速率()随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。 ①容器中发生反应的化学方程式为 。 ②0~15min内,用CO表示的该反应平均速率= mol/L·min。 ③T1℃时,该反应的平衡常数K= (不需带单位)。 ④40min时的平衡常数[K(40)]与15min时的平衡常数[K(15)]的大小关系:K(40) K(15)(填“>”“<”或“=”) ⑤45min时,改变的条件为 。 25.(15分)有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示: 已知:①A的核磁共振氢谱图中显示两组峰 ②F的结构简式为: ③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。 ④ 请回答下列问题: (1)A的名称为 (系统命名法);Z中所含官能团的名称是 。 (2)反应Ⅰ的反应条件是 ;反应Ⅲ的反应类型为 。 (3)E的结构简式为 。 (4)写出反应Ⅴ的化学方程式 。 (5)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件: ①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有 种(不包括立体异构),核磁共振氢谱有四组峰的结构为 。 (6)参照如下合成路线,设计以2—氯丙烷为起始原料合成丙醛的合成路线(无机试剂任选) 。 2016—2017学年中小学期末考试高二年级 理 科 化 学 试 参 考 答 案 一、选择题(共21小题,每题2分,共42分) 题号 1 2 3 4 5 6 7 8 9 10 11 答案 C D B B B C A A C B B 题号 12 13 14 15 16 17 18 19 20 21 答案 C C C C D A c B A A 二、非选择题(除特殊注明外,每空2分) 22.(15分) (1)2S2Cl2+2H2O=SO2↑+3S↓+4HCl (2)浓硫酸 (3)①排走氧气,防止硫加热时与氧气反应。②水浴(1分)。③放热(1分)。 (4) (5)吸收多余的氯气 漂白粉(漂粉精) (6)氯化钙(五氧化二磷)(1分) 23.(14分) (1)250 mL容量瓶、胶头滴管 (2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(答两点即可) (3)2Cr3++3H2O2+H2O=Cr2O+8H+ (4)Na+、Mg2+ ;pH超过8会使部分Al(OH)3溶解生成AlO,最终影响Cr(Ⅲ)的回收与再利用 (5)Mg2+ (6)3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH 24.(14分) (1)306 (2) >(1分) (3)① Al2O3+3C+3Cl22AlCl3+3CO ② 0.02 ③ 3375 ④ =(1分) ⑤ 降低温度 (4)CO - 2e— + H2O = CO2 + 2H+ 25.(15分) (1)2-甲基-2-丙醇 ;酚羟基、醛基(1分) (2)浓硫酸,加热(1分);氧化反应(1分) (3)(CH3)2CHCOOH (4) (5)6 , 。 (6)查看更多