2018-2019学年浙江省慈溪市六校高二上学期期中考试化学试题 Word版
2018-2019学年浙江省慈溪市六校高二上学期期中考试化学试卷
本试题卷分选择题和非选择题两部分,共7页,满分100分,考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64 Ag-108
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.近日王中林院士被授予能源界“诺贝尔奖”的埃尼奖,以表彰他首次发明纳米发电机、开创自驱动系统与蓝色能源两大原创领域。下列与“蓝色能源”海洋能一样属于可再生能源的是
A.氢气 B.煤 C.石油 D.可燃冰
2.下列物质放入水中,会显著放热的是
A.食盐 B.蔗糖 C.酒精 D.生石灰
3.下列变化一定会导致熵增大的是
A.吸热反应 B.物质由固态变为气态 C. 自发过程 D.体系有序性变高
4.在电解水制取H2和O2时,为增强溶液的导电性常加入一些电解质。下列物质中最合适的是
A.Na2SO4 B.CuCl2 C.NaCl D.AgNO3
5.A2(g)+B2(g) 2AB(g),ΔH >0。下列因素能使活化分子百分数增加的是
A.降温 B.使用催化剂 C.增大反应物浓度 D.增大气体的压强
6.下列说法不正确的是
A.大力发展火力发电,解决电力紧张问题
B.利用微生物在光合作用下分解水,是氢气制取的一个重要研究方向
C.植物秸秆发酵制沼气、玉米制乙醇都涉及生物质能
D.太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热
7.在下列各说法中,正确的是
A.ΔH >0表示放热反应
B.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
C.1 mol H2SO4与1 mol Ba(OH)2完全反应放出的热叫做中和热
D.热化学方程式中的化学计量数表示物质的量,可以用分数表示
8.在四个不同的容器中,在不同的条件下进行反应A(g)+3B(g)==
=2C(g)+2D(g),根据在相同时间内测定的结果判断,生成C的速率最快的是
A.v(A)=0.45 mol·L-1·s-1 B.v(B)=0.6 mol·L-1·s-1
C.v(C)=0.4 mol·L-1·s-1 D.v(D)=0.45 mol·L-1·s-1。
9.对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
A.增大容器容积 B.通入大量O2 C.移去部分SO3 D.降低体系温度
10.10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是
A.CH3COOH B.K2SO4 C.CuSO4 D.Na2CO3
11.10月24日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属所技术能保障大桥120年耐久性。 下列保护钢管桩的措施不合理的是
A.使用抗腐蚀性强的合金钢 B.在钢筋表面附上新一代高性能环氧涂层
C.钢管桩附着铜以增强抗腐蚀性 D.使用原位腐蚀监测系统设计
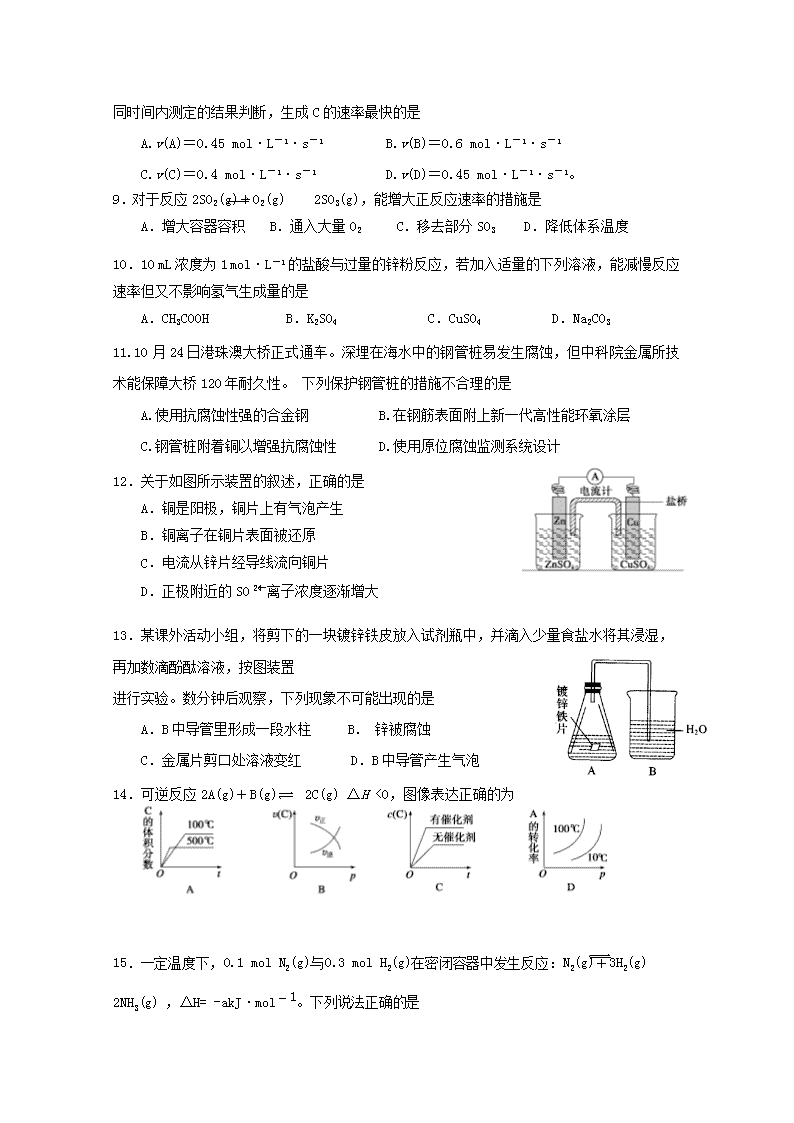
12.关于如图所示装置的叙述,正确的是
A.铜是阳极,铜片上有气泡产生
B.铜离子在铜片表面被还原
C.电流从锌片经导线流向铜片
D.正极附近的SO离子浓度逐渐增大
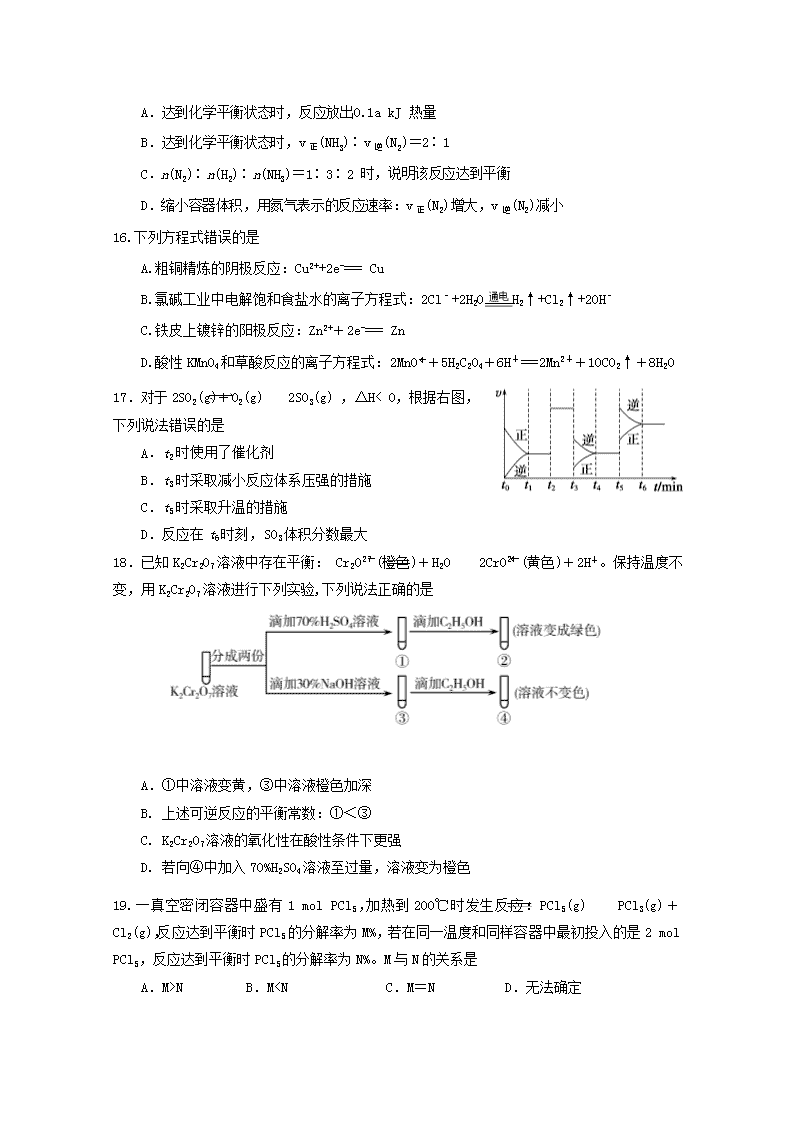
13.某课外活动小组,将剪下的一块镀锌铁皮放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置
进行实验。数分钟后观察,下列现象不可能出现的是
A.B中导管里形成一段水柱 B. 锌被腐蚀
C.金属片剪口处溶液变红 D.B中导管产生气泡
14.可逆反应2A(g)+B(g)
2C(g) ΔH <0,图像表达正确的为
15.一定温度下,0.1 mol N2(g)与 0.3 mol H2(g)在密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ,ΔH= -akJ·molˉ1。下列说法正确的是
A.达到化学平衡状态时,反应放出 0.1a kJ 热量
B.达到化学平衡状态时,v正(NH3)∶v逆(N2)=2∶1
C.n(N2)∶n(H2)∶n(NH3)=1∶3∶2 时,说明该反应达到平衡
D.缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小
16.下列方程式错误的是
A.粗铜精炼的阴极反应:Cu2++2e-=== Cu
B.氯碱工业中电解饱和食盐水的离子方程式:2Cl﹣+2H2OH2↑+Cl2↑+2OH﹣
C.铁皮上镀锌的阳极反应:Zn2++2e-=== Zn
D.酸性KMnO4和草酸反应的离子方程式:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
17.对于2SO2(g)+O2(g) 2SO3(g) ,ΔH< 0,根据右图,下列说法错误的是
A.t2时使用了催化剂
B.t3时采取减小反应体系压强的措施
C.t5时采取升温的措施
D.反应在t6时刻,SO3体积分数最大
18.已知K2Cr2O7溶液中存在平衡: Cr2O(橙色)+H2O 2CrO(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验,下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B. 上述可逆反应的平衡常数:①<③
C. K2Cr2O7溶液的氧化性在酸性条件下更强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
19.一真空密闭容器中盛有1 mol PCl5,加热到200℃时发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A.M>N B.M
b B.反应①中反应物总键能小于生成物总键能
C.a=482 D.反应②中反应物的总能量大于生成物的总能量
21.某锂离子二次电池装置如图所示,其放电时的总反应为:
Li1-xCoO2+LixC66C+LiCoO2。下列说法正确的是
A.石墨为正极
B.充电时,阳极质量不变
C.充电时,阴极反应式为xLi-xe-xLi+
D.放电时,电池的正极反应式为xLi++Li1-xCoO2+xe-LiCoO2
22. 研究不同条件对同体积同浓度的 H2O2 分解速率的影响,得到如下结果。由此不能得出的结论是:
A.Cu2+与 Fe3+对 H2O2 分解都有催化作用,但 Cu2+催化效果更好
B.由Ⅰ与Ⅱ可知其它条件相同时,时间越长, H2O2 分解越彻底
C.由Ⅰ与Ⅲ可知其它条件相同时,温度越高, H2O2 分解越快
D.由Ⅰ与Ⅲ可知其它条件相同时,碱性越强, H2O2 分解越快
23.模拟电渗析法淡化海水的工作原理示意图如下。已知X、Y均为惰性电极,模拟海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子。下列叙述不正确的是
A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为2H2O-4e-===4H++O2↑
24.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图所示。下列说法不正确的是
缓蚀剂的浓度/(mg•L—1)
缓蚀剂
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
25.一定条件下,在水溶液中1molCl—、ClOx—(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
A.这些离子中结合H+能力最强的是E
B.A、B、C、D、E五种微粒中A最稳定
C.C→B+D的反应,反应物的总键能大于生成物的总键能
D.B→A+D是吸热反应
非选择题部分
二、非选择题(本大题共4小题,共50分)
26.(10分)(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,已知E1=+134 kJ·mol-1、E2=+368 kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是 ▲ (填“增大”“减小”或“不变”,下同),ΔH的变化是 ▲ 。
请写出NO2和CO反应的热化学方程式: ▲ 。
(2) 以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:
a: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1
b: NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1
c: H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
①对于a反应来说, ▲ (填“高温”“低温”或“无影响”)更有利于该反应的自发。
②写出CO2与NH3合成尿素和液态水的热化学反应方程式: ▲ 。
27.(13分)用如图所示的装置测定中和热。
实验药品:100mL 0.50 mol‧L-1盐酸、50mL 0.50 mol‧L-1NaOH溶液、
50mL 0.50 mol‧L-1氨水。
实验步骤:略。
已知:NH3·H2O NH4++OH- ,ΔH>0
回答下列问题:
⑴从实验装置上看,还缺少 ▲ ;是否可以用铜质材料替代 ▲
(填“是”或“否”),理由是 ▲ 。
⑵烧杯间填满碎泡沫塑料的作用是 ▲ 。
⑶将浓度为0.5 mol·L-1的酸溶液和0.50 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g· mL-1),生成溶液的比热容c=4.18 J·g-1·℃-1,搅动后,测得酸碱混合液的温度变化数据如下:
反应物
起始温度
t1/℃
终止温度
t2/℃
中和热
甲组
HCl+NaOH
15.0
18.3
ΔH1
乙组
HCl+NH3·H2O
15.0
18. 1
ΔH2
①某同学利用上述装置做甲组实验,测得中和热的数值偏低,试分析可能的原因 ▲ 。
A.测量完盐酸的温度再次测最NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净。
B.做本实验的当天室温较高
C.大小烧杯口不平齐,小烧杯口未接触泡沫塑料板。
D.NaOH溶液—次性迅速倒入
②写出HCl+NH3·H2O的热化学方程式: ▲ 。
③两组实验结果差异的原因是 ▲ 。
28.(13分)如图是原电池电解池的组合装置图。请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为碳棒B为Fe,则:①A碳电极上发生的现象为 ▲ 。
②丙池中E、F电极均为碳棒,E电极为 ▲ (填“正极”、“负极”、“阴极”或“阳极”)。如何检验F侧出口的产物 ▲ 。
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的甲池原电池装置,则B(正极)电极反应式为 ▲ 。
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,
①A电极的反应方程式为 ▲ 。
②若线路中转移0.02 mol电子,乙池中C极质量变化 ▲ g。
(4)若用少量NaOH溶液吸收SO2气体,对产物 NaHSO3进一步电解可制得硫酸,将丙池电解原理示意图改为如下图所示。电解时阳极的电极反应式为 ▲ 。
29.(14分)近日IPCC发布了由来自40个国家的91位科学家编写的《全球升温1.5℃特别报告》,温室效应引发的环境问题日益严重,物种灭绝,洪灾、旱灾、粮食欠收等自然灾害发生频率不断增加,CO2的减排和综合利用是解决温室及能源问题的有效途径。
(1)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从3 min到9 min,v(H2)= ▲ mol·L-1·min-1。
②该反应的平衡常数为 ▲ 。
③下列说法正确的的是 ▲ (填字母)。
A.混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态
B.平衡时CO2的转化率为75%
C.平衡时混合气体中CH3OH(g)的体积分数是30%
D.该条件下,第9 min时v逆(CH3OH)大于第3 min时v正(CH3OH)。
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g) CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如左下图所示。
①由图可知温度升高CO的产率上升,其主要原因可能是 ▲ 。
②由图可知获取CH3OH最适宜的温度是 ▲ 。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有 ▲ (填字母)。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(3)250 ℃下CH3OH物质的量随时间的变化曲线如右上图所示。画出280 ℃下0~t2时刻CH3OH物质的量随时间的变化曲线。
命题学校:象山县第三中学
2018学年第一学期高二期中六校联考
化学答案
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
D
B
A
B
A
D
A
B
B
C
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
/
答案
A
B
C
D
C
A
A
D
C
D
C
B
/
二、非选择题(本大题共4小题,共50分)
26. (10分,每空2分)
(1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH =-234 kJ·mol-1
(2)①低温②2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l)ΔH=-87.0 kJ·mol-1
27.(13分,其中1空1分,其余每空2分)
(1)环形玻璃搅拌棒 否(1分),金属材质易散热,使实验误差增大
(2)减少实验过程中的热量损失。
(3)①AC ②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l) ΔH=-51.8 kJ·mol-1
③NH3·H2O在中和过程中要吸热,导致放热较少
28.(13分,其中1空1分,其余每空2分)
(1)①产生大量无色气泡,②阴极(1分),F出口置一湿润的淀粉碘化钾试纸,淀粉变蓝,则产物为Cl2
(2)Fe3++e-===Fe2+
(3)①H2+2e-+2OH-===2H2O ②2.16g
(4)
29.(14分,每空2分)
(1)①0.125 ②5.3 ③BC
(2)①反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高②250 ℃ BD
(3)
注:1、有效数字不要求。
2、 ΔH算错不给分,单位漏写扣1分。
3、 29题画图转折点,横坐标
查看更多