- 2023-12-30 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学鲁科版选修3课后练习:1-3-1 电离能及其变化规律
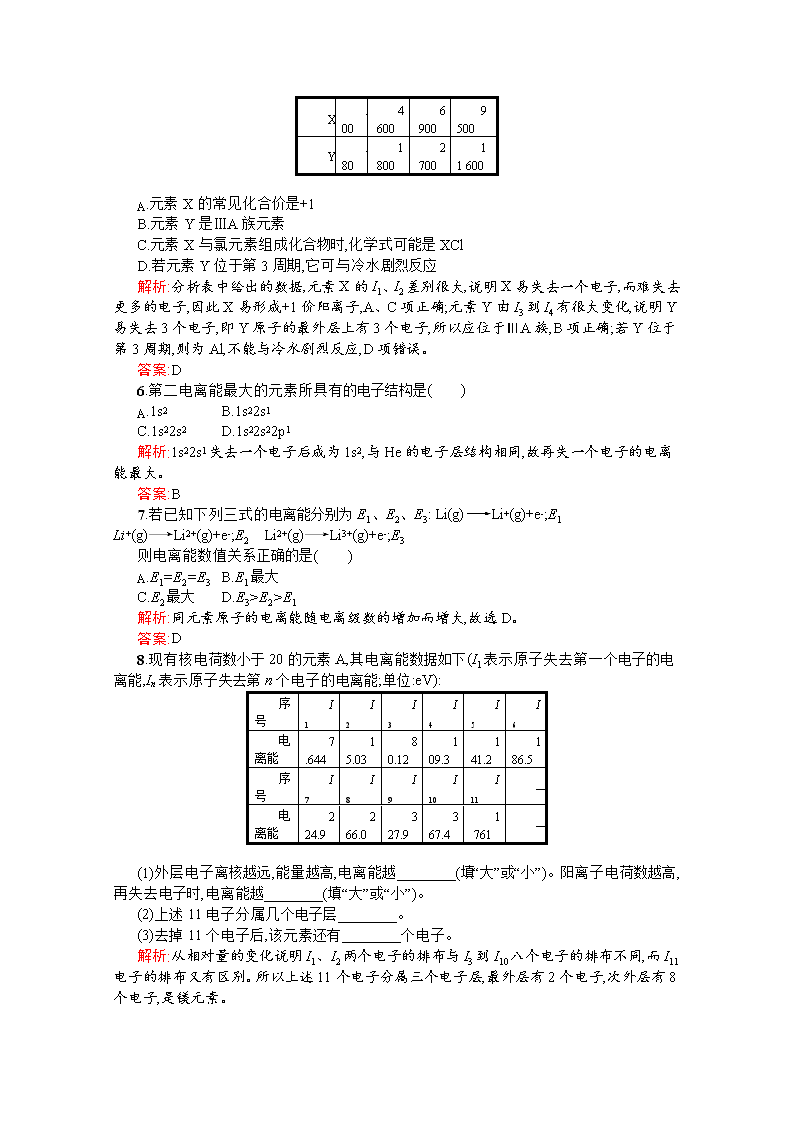
www.ks5u.com 第3节 原子结构与元素性质 第1课时 电离能及其变化规律 一、非标准 1.下列元素按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( ) A.K、Na 、Li B.Al、Mg、 Na C.N、O、C D.Cl、S、P 解析:同周期中从左到右,元素的第一电离能逐渐增大;同主族中,从上到下,第一电离能逐渐减小。第ⅡA族中的Be、Mg、Ca及第ⅤA族的N、P、As第一电离能出现反常现象。 答案:A 2.下列关于稀有气体的叙述不正确的是( ) A.各原子轨道电子均已填满 B.其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 C.化学性质很不活泼 D.同周期中第一电离能最大 解析:稀有气体各原子轨道电子达到稳定结构,所以化学性质不活泼,同周期中第一电离能最大。稀有气体元素原子的核外电子排布与同周期的阴离子(达到稳定结构)的电子排布相同,同时还与下一周期的ⅠA、ⅡA族阳离子(失去最外层电子)具有相同的核外电子排布,故B错误。 答案:B 3.气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法不正确的是( ) A.元素的第一电离能越大,其金属性越弱 B.元素的第一电离能越小,其金属性越强 C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关 D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该金属原子失去电子后在水溶液里形成水合离子的变化有关 解析:一般来说,第一电离能越小,金属性越强。 答案:C 4.在基态多电子原子中,关于核外电子能量的叙述错误的是( ) A.最易失去的电子能量最高 B.电离能最小的电子能量最高 C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低 解析:A项,原子在反应中失去的电子应是离核最远的外层电子,其能量最高,A正确;B项,电离能最小的电子离原子核最远,受原子核的吸引力最小,能量最高,B正确;处于高能层中的s轨道电子的能量要比处于较低能层中p轨道电子的能量高,C错误;能量越低的电子尽量排布在离原子核越近的轨道上,D正确。 答案:C 5.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。根据表中所列数据判断下列选项中错误的是( ) 元素 I1 I2 I3 I4 X 500 4 600 6 900 9 500 Y 580 1 800 2 700 11 600 A.元素X的常见化合价是+1 B.元素Y是ⅢA族元素 C.元素X与氯元素组成化合物时,化学式可能是XCl D.若元素Y位于第3周期,它可与冷水剧烈反应 解析:分析表中给出的数据,元素X的I1、I2差别很大,说明X易失去一个电子,而难失去更多的电子,因此X易形成+1价阳离子,A、C项正确;元素Y由I3到I4有很大变化,说明Y易失去3个电子,即Y原子的最外层上有3个电子,所以应位于ⅢA族,B项正确;若Y位于第3周期,则为Al,不能与冷水剧烈反应,D项错误。 答案:D 6.第二电离能最大的元素所具有的电子结构是( ) A.1s2 B.1s22s1 C.1s22s2 D.1s22s22p1 解析:1s22s1失去一个电子后成为1s2,与He的电子层结构相同,故再失一个电子的电离能最大。 答案:B 7.若已知下列三式的电离能分别为E1、E2、E3: Li(g)Li+(g)+e-;E1 Li+(g)Li2+(g)+e-;E2 Li2+(g)Li3+(g)+e-;E3 则电离能数值关系正确的是( ) A.E1=E2=E3 B.E1最大 C.E2最大 D.E3>E2>E1 解析:同元素原子的电离能随电离级数的增加而增大,故选D。 答案:D 8.现有核电荷数小于20的元素A,其电离能数据如下(I1表示原子失去第一个电子的电离能,In表示原子失去第n个电子的电离能;单位:eV): 序号 I1 I2 I3 I4 I5 I6 电离能 7.644 15.03 80.12 109.3 141.2 186.5 序号 I7 I8 I9 I10 I11 — 电离能 224.9 266.0 327.9 367.4 1 761 — (1)外层电子离核越远,能量越高,电离能越 (填“大”或“小”)。阳离子电荷数越高,再失去电子时,电离能越 (填“大”或“小”)。 (2)上述11电子分属几个电子层 。 (3)去掉11个电子后,该元素还有 个电子。 解析:从相对量的变化说明I1、I2两个电子的排布与I3到I10八个电子的排布不同,而I11电子的排布又有区别。所以上述11个电子分属三个电子层,最外层有2个电子,次外层有8个电子,是镁元素。 答案:(1)小 大 (2)3 (3)1 9.A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3。A与B可形成化合物C和D。D溶于水时有气体B逸出,B能使带火星的木条复燃。请回答下列问题: (1)比较电离能:①I1(A) I1(B)(填“>”或“<”,下同),②I1(B) I1(He)。 (2)通常A元素的化合价是 ,对A元素呈现这种价态进行解释: ①用原子结构的观点进行解释: 。 ②用电离能的观点进行解释: 。 ③写出D跟水反应的离子方程式: 。 解析:由s能级最多能容纳2个电子和nsx+1可知,x等于1。由A、B都是短周期元素和(n+1)sx、nsx+1npx+3可知,n等于2。因此(n+1)sx代表的完整电子排布式是1s22s22p63s1,A是钠(Na);nsx+1npx+3代表的完整电子排布式是1s22s22p4,B是氧(O)。 答案:(1)①< ②< (2)+1价 ①钠原子失去一个电子后形成1s22s22p6式的原子轨道全充满的+1价阳离子。该离子结构体系能量低,极难再失去电子 ②Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍。通常Na原子只能失去一个电子 ③2Na2O2+2H2O4Na++4OH-+O2↑ 10.不同元素的气态原子失去最外层一个电子所需要的能量I1如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。 (1)同主族内不同元素的I1变化的特点是 ,各主族中I1的这种变化特点体现了元素性质的 变化规律。 (2)同周期内,随原子序数增大,I1增大。但个别元素的I1出现反常,试预测下列关系式中正确的是 (填序号)。 ①I1(砷)>I1(硒) ②I1(砷)查看更多