化学(重点班)卷·2018届陕西省西安中学高二上学期期末考试(2017
西安中学2016-2017学年高二(重点班)上学期期末考试
化学试题
(时间:90分钟 满分:100分)
相对原子质量: H 1 O 16 C 12 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Si 28 Fe 56 Cu 64
一、选择题(共25小题,每题只有1个选项符合题意,每小题2分,共50分)
1.下列能源的大量使用会导致全球进一步变暖、雾霾天气增多的是
A.化石能源 B.太阳能 C.氢能 D.地热能
2. 己知形成l mol H-H键,放出436 kJ的能量;断开l mol H-N键,吸收391 kJ的能量。l molN2和3 mol H2完全反应生成2 molNH3时,放出92.4 kJ的能量。则要断开1 mol N-N键,所需要的能量是
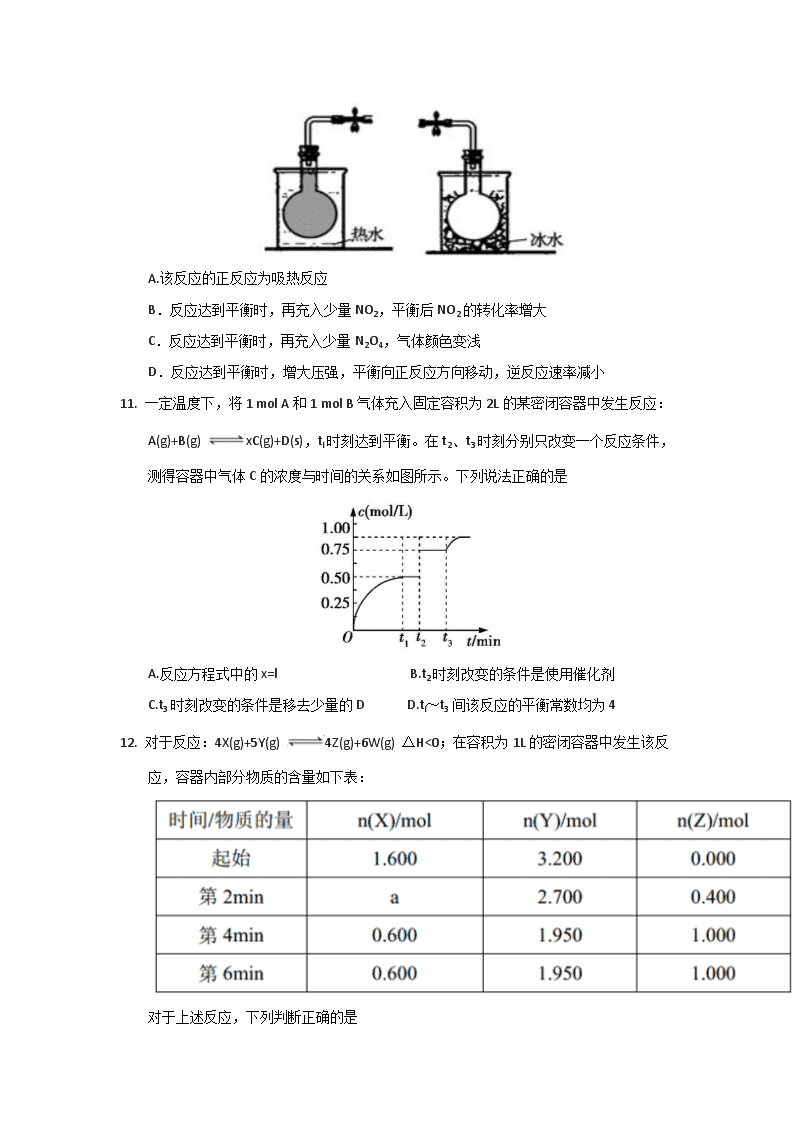
A.431 kJ B.945.6 kJ C.649.6 kJ D.869 kJ
3.某反应A=B+C在室温下不能自发进行,在高温下能自发进行,对该反应过程的焓变(△H)、熵变(△S)的判断正确的是
A. △H<0. △S>0 B. △H>0. △S<0 C. △H>0. △S>0 D. △H<0. △S<0
4. 甲烷的燃烧热为△H1,氢气的燃烧热为△H2,且△Hl<△H2,若甲烷和氢气的混合物1 mol完全燃烧生成稳定的化合物时,反应热为△H3,则甲烷和氢气的物质的量之比为
A. B. C. D.
5. 一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
A. 前50 s内B的平均反应速率v(B)=0.0032 mol.L-1.s-1
B.相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前 v(正)>V(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol.L-1,则反应的AH
c(CH3COO-)
18. 下列说法正确的是
A.25℃时,在pH=4的盐酸和NH4C1溶液中,由水电离出的H+浓度相等
B. 25℃时,pH=3和pH=5的盐酸等体积混合后,溶液的pH=4
C. 25℃时,pH=9和pH=ll的NaOH溶液等体积混合后,溶液的pH=10
D. 25℃时,pH=3.6的某橙汁中的c(H+)是pH=5.6的某西瓜汁中的c(H+)的100倍
19.常温下,下列有关溶液中微粒浓度的判断正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)c(CH3COO-)>c(OH-)=c(H+)
D.上图中a点溶液:c(OH-)=c(H+)+ c(CH3COO-)+2c(CH3COOH)
20. 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源。其工作原理如图所示。下列有关说法不正确的是
A.电池工作时,电子的流向:锂电极→导线→碳电极
B.水既是氧化剂又是溶剂,有机电解质可用水溶液代替
C.电池总反应为2Li+2H2O=2LiOH+H2T
D.该装置不仅可提供电能,还可得到清洁燃料氢气
21. 如图是进行电化学实验的两个装置,下列有关说法正确的是
A. 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成
B.反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小
C.电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+
D.反应后甲中溶液的pH减小,乙中溶液的pH增大
22. 燃料电池是未来新能源汽车的发展方向,Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极反应式为:2Li++ FeS+2e-=Li2S+Fe,有关该电池的下列叙述中正确的是
A.该电池的总反应式为:2Li+ FeS=Li2S+Fe
B.Li-Al合金在电池中作为正极材料
C.负极反应式为:Al -3e-=Al3+
D.Li-Al/FeS电池中,电子经外电路流入Li-Al极
23. 下列说法中正确的是
A. 在铁制船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率
B.粗铜精炼时,电镀液中的c(Cu2+)保持不变
C.纯银在空气中久置变黑发生的是电化学腐蚀
D.外加电流的阴极保护法是将被保护的金属与外加电源的正极相连
24. 全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为V3++VO2++H2O VO2++2H++V2+。下列叙述正确的是
A. 充电时阳极附近溶液的酸性减弱
B.充电时阳极反应式为V3++e-=V2+
C.放电过程中电解质溶液中阳离子移向负极
D.放电时每转移1 mol电子,负极有1molV2+被氧化
25. 用石墨电极电解只含有Cu2+、H+和M3+(M为金属元素)三种阳离子的电解质溶液,起始时三种阳离子的物质的量均为0.1 mol,电解过程中阴极产生金属的质量与电路中通过电子的物质的量的关系如图所示,下列说法正确的是
A.三种阳离子的氧化性强弱顺序:Cu2+>H+>M3+
B.电路中通过0.3 mol电子时,溶液中的阳离子只有H+
C.将Cu投入含M3+的溶液中,可能发生反应:Cu+2M3+=Cu2++2M2+
D.从开始电解到电路通过0.1 mol电子的过程中,阴极的电极反应式为2H++2e-=H2↑
二、填空题(共4小题,每空2分,共50分)
26.(14分)(1)己知:①C(s)+O2(g)=CO2(g) △H=akJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=bkJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=ckJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=_____kJ/mol。(用含a、b、c的式子表示)
(2)用50 mL 0.50mol.L-l盐酸与50 mL 0.55 mol.L-1NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
①该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要_____;
②装置中大、小烧杯之间填满碎泡沫塑料的目的是________;
③某同学实验记录的数据如上表所示,其中记录的终止温度是指______;
④计算该实验发生中和反应时放出的热量为____[中和后生成的溶液的比热容c=4.2J·(g.℃)-1,稀溶液的密度都为1g.cm-3];
⑤若用50 mL 0.55 mol.L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会____(填“偏小”、“偏大”或“不变”),其原因是_____。
27.(10分)乙酸、氰酸、碳酸等都是重要的碳的化合物。己知如下信息:
①25℃时有关弱酸的电离常数如下表:
弱酸的化学式
CH3COOH
HCN
H2CO3
电离常数
Ka= l.8×l0-5
Ka=4.9×10-10
Kal=4.3×10-7
Ka2=5.6×10-11
②Ksp(CaCO3)=2.8×10-9.
请回答下列问题:
(1)用pH试纸检测NaCN溶液的酸碱性时,pH试纸变为蓝色。用离子方程式解释出现这种现象的原因:________________。
(2)25℃时,测得CH3COOH与CH3COONa的混合溶液的pH=6,则=_______。
(3)在任一浓度的NaHCO3溶液中.c(OH-)-c(H+)____(填“>”、“=”或“<”)c(H2CO3)-c(CO32-)。
(4)体积均为100 mL pH=2的CH3COOH溶液与HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶液的pH变化趋势的曲线是____(填“I”或“Ⅱ”)。
(5)在容器中使氯化钙溶液与碳酸钠溶液等体积混合,己知碳酸钠溶液的浓度为2×l0-4mol/L,则生成沉淀所需氯化钙溶液的最小浓度为__________。
28.(12分)CH4、CH3OH、H2既是重要的化工原料又是未来重要的能源物质。
(1)将1.0molCH4和2.0 mol H2O(g)通入容积为100 L酌反应室中,在一定条件下发生反应
CH4(g)+H2O(g)CO(g)+3H2(g),测得在一定压强下CH4的平衡转化率与温度的关系如图甲所示。
①若100℃时反应达到平衡所需的时间为5 min,则用H2表示0~5 min内该反应的平均反应速率为________。
②100。C时该反应的平衡常数为_______,该反应的△H____0(填“<”或“>”)。
(2)在一定条件下和有催化剂存在时,将1.0mol CH4与2.0mol H2O充入密闭容器中发生反应CH4(g)+H2O(g)CH3OH(g)+H2(g) △H<0,下列措施可以提高CH4转化率的是______(填选项序号)。
a.增大压强 b.升高温度 c.及时分离生成的CH3OH
d.投入更多的H2O(g) e.投入更多的CH4(g)
(3)在一定温度和压强下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0
,反应达到平衡时,改变温度(T)和压强(p),反应混合物中CH3OH的物质的量分数的变化情况如图乙所示,下列关于温度(T)和压强(p)的关系判断正确的是(填选项序号)。
A.p3>p2 T3>T2 B.p2>p4 T4>T2 C.pl>p3 T3>Tl D.pl>p4 T2>T3
(4)甲醇部分氧化可制得氢气。己知CH3OH(1)、H2(g)的燃烧热分别为726.5kJ/mol、285.8 kJ/mol,则当时,CH3OH(1)与O2发生反应生成CO2和H2的热化学方程式为______。
29.(14分)电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为__________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是_____(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl-2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,
其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2OCH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入_______(填化学式),电极反应式为______。电解过程中,阴极区Na2SO4的物质的量________ (填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后1位)。
参考答案
一、选择题(共25小题,每题只有1个选项符合题意,每小题2分,共50分)
1-10:ABCBC CAACB 11-20:DDCBD DCDDB 21-25:AAADC
二.填空题(共4小题,每空2分,共50分)
26. (14分)
(1) c+2a-b
(2)①50ml量筒 ②减少实验过程中的热量损失。
⑧混合溶液的最高温度; ④1344 J/mol
⑤偏大 一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大
27. (10分)
(l)CN-+H2OHCN+OH- (2)1/18;(3) = ;(4)I (5)5.6×l0-5mol/L
28. (12分)
(1)①0.0024 mol/(L·min) ②7.2×10-5 >
(2)cd (3)D
(4)2CH3OH(l)+O2(g)2CO2(g)+4H2(g) △H=-309.8 kJ.mol-l
29. (14分)
(l)2Cu+H2O-2e-=Cu2O+2H+ 2H++2e-=H2↑ (2)d
(3)①CH4 CH4-8e-+l0OH-=CO32-+7H2O 不变 ②1.9