- 2021-06-24 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年山东省济南第一中学高二上学期期中考试化学试题 (word版)
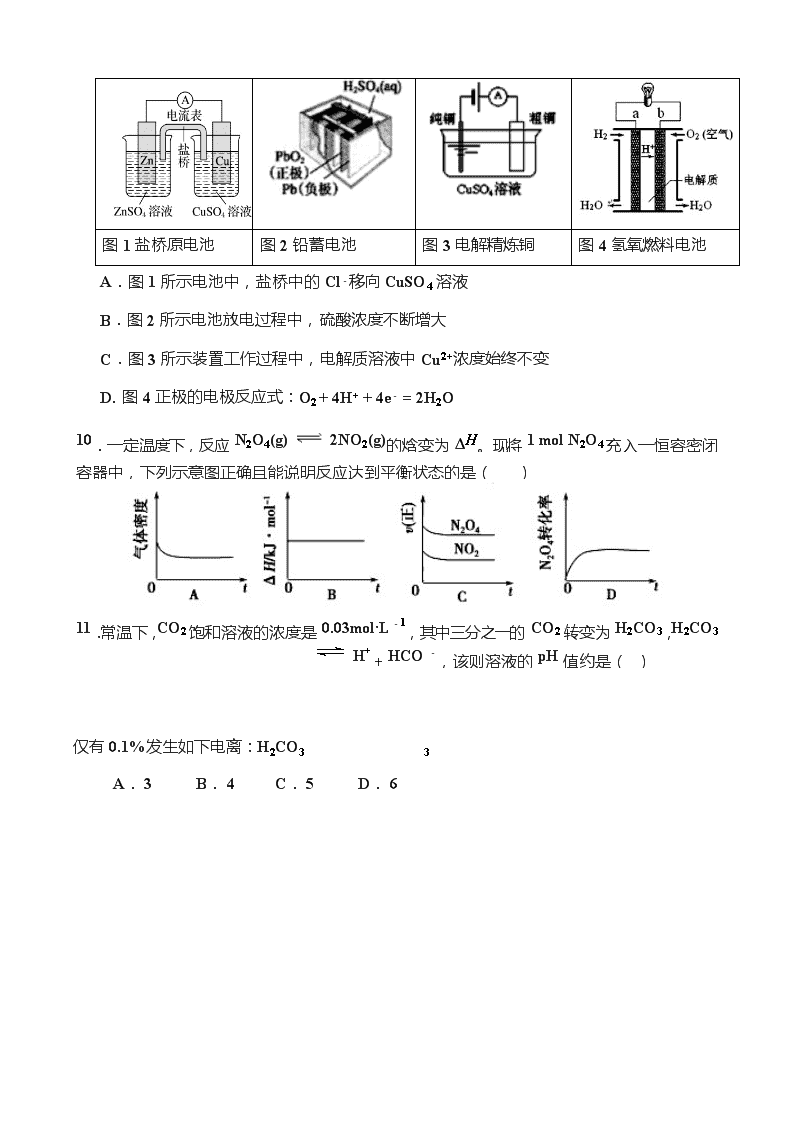
济南一中 2019—2020 学年第一学期期中考试 高 二 化 学 2019.11 注意事项: 本试卷分第Ⅰ卷和第Ⅱ卷两部分,满分 100 分。考试时间 90 分钟。 相对原子质量: H 1 C 12 N 14 O16 Na 23 Al 27 S 32 Fe 56 Cu64 第Ⅰ卷(选择题 共54分) 一、选择题(本题共 18 小题,每小题 3 分,每小题只一个选项符合题意) 1.化学与生产、生活密切相关,下列说法不正确的是( ) A. 开发新的清洁能源,有利于节约资源、保护环境 B. 为防止电池中的重金属离子污染,应将废电池集中埋于地下 C. 硫酸钡可用于钡餐透视 D. 工业合成氨中净化 N2、H2 是为了防止催化剂中毒 2.下列食品添加剂中,其使用目的与化学反应速率有关的是( ) A. 增稠剂 B. 抗氧化剂 C. 着色剂 D. 调味剂 3. 下列说法不正确的是( ) A.需要加热的化学反应可能是放热反应 B.2NO(g) + O2(g)= 2NO2(g)常温下能自发进行,说明该反应的 ΔH<0 C.除去 CuCl2 溶液中的 Fe3+,选用 CuO 做沉淀剂 D.通过直接蒸发 MgCl2 溶液的方法获取无水氯化镁固体 4.下列化学式表示的粒子对 H2O 的电离平衡不产生影响的是( ) A. B. C. D.OH- 5.实验室用 4 mol SO2 与 2 mol O2 在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-197kJ·mol-1,当放出 315.2kJ 热量时,SO2 转化率为( ) A.40% B.50% C.80% D.90% 6. 下列有关热化学方程式的叙述正确的是( ) A. 已知 H2 的燃烧热 ΔH= -285.8 kJ·mol-1,则水分解的热化学方程式为: 2H2O(l)=2H2(g)+O2(g);△H= + 571.6 kJ·mol-1 B.已知 C(石墨,s)=C(金刚石,s) △H>0,则 1mol C(金刚石)的总能量比 1mol C(石墨)的总能量低 C.已知 N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ·mol-1,则在一定条件下将 1molN2 和 3molH2 置于一密闭容器中充分反应后,最多可放出 92.4kJ 的热量 D.已知强酸与强碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O (l) △H1;则稀醋酸与 NaOH 溶液反应的中和热△H2<△H1 7. 用水稀释 0.1mo1·L-1 氨水时,溶液中随着水量的增加而减小的是 ( ) A.c(OH-)/c(NH3·H2O) B.c(H+)和 c(OH-)的乘积 C.c(NH4+) D.OH-的物质的量 8.关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理如下,下列叙述不正确的是 ( ) ① HUr(aq)+H2O(l) Ur-(aq)+H3O+(aq) ② Ur-(aq)+Na+(aq) NaUr(s) ΔH A.降低温度,反应②平衡正向移动 B.反应②正方向是吸热反应 C.降低关节滑液中 HUr 及 Na+含量是治疗方法之一 D.关节保暖可以缓解疼痛,原理是平衡②逆向移动 9. 下列有关四个常用电化学装置的叙述中,正确的是( ) 图 1 盐桥原电池 图 2 铅蓄电池 图 3 电解精炼铜 图 4 氢氧燃料电池 A.图 1 所示电池中,盐桥中的 Cl-移向 CuSO4 溶液 B.图 2 所示电池放电过程中,硫酸浓度不断增大 C.图 3 所示装置工作过程中,电解质溶液中 Cu2+浓度始终不变 D. 图 4 正极的电极反应式:O2 + 4H+ + 4e- = 2H2O 10 .一定温度下,反应 N 2 O 4 ( g ) 2 NO 2 ( g ) 的焓变为 Δ H 。现将 1 mol N 2 O 4 充入一恒容密闭 容器中,下列示意图正确且能说明反应达到平衡状态的是 ( ) 1 1 . 常温下, CO 2 饱和溶液的浓度是 0.03 mol·L - 1 ,其中三分之一的 CO 2 转变为 H 2 CO 3 , H 2 CO 3 H + + HCO - ,该则溶液的 pH 值约是 ( ) 仅有 0.1%发生如下电离:H2CO3 3 A. 3 B. 4 C. 5 D. 6 2 NO(g ) 。一定条件下,等物质的量的 12 0 12. 某可逆反应 X + Y M 在不同条件下的反应历程分别为 A、B(如图所示),下列说法不正确的是( ) A.该反应的△H = 150 kJ·mol-1 B.历程 B 有催化剂参与,降低了反应的活化能 C.该催化剂可有效提高反应速率 D.该催化剂可有效提高反应物的平衡转化率 13.汽车尾气中 NO 产生的反应为:N2(g)+O2(g) N2 和 O2 在恒容密闭容器中反应,右图曲线 a 表示该反应在温度 T 下 N2 的浓度随时间的变化,曲线 b 表示该反应在某一起始条件改变时 N2 的浓度随时间的变化。下列叙述正确的是( ) A.温度 T 下,该反应的平衡常数 K=( c0-c21 c1) 2 B.温度 T 下,随着反应的进行,混合气体的密度减小 C.曲线 b 对应的条件改变可能是加入了催化剂 D.若曲线 b 对应的条件改变是温度,可判断该反应的 ΔH<0 14.关于下列各装置图的叙述中不正确的是 ( ) A.用装置①在铁上镀锌,则 a 为铁,b 为锌 B.装置②的总反应是:Fe+2Fe3+=3Fe2+ C.装置③的钢闸门与外接电源的负极相连 D.装置④中开关由 M 改置于 N 时,Cu—Zn 合金的腐蚀速率减小 15.如图是电化学催化还原 CO2 制备 CO 的装置示意图,质子交换膜将电解池分为阴极室 和阳极室。 下列 说法中正确的是( ) 16.室温下向 10 mL 0.1 mol·L-1 NaOH 溶液中加入 0.1 mol·L-1 的一元酸 HA,溶液 pH 的 变化曲线如图所示。下列说法正确的是( ) A.a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA) B.a、b 两点所示溶液中水的电离程度相同 C.pH=7 时,c(Na+)=c(A- )+c(HA) D.b 点所示溶液中 c(A- )>c(HA) 17. 利用如图装置进行实验,开始时,a、b 两处液面相平,密封好,放置一段时间。下列说 ( ) 法不正确的是( ) A.a 管发生吸氧腐蚀,b 管发生析氢腐蚀 B.一段时间后,a 管液面高于 b 管液面 C.a 处溶液的 pH 增大,b 处溶液的 pH 减小 D.a、b 两处具有相同的电极反应式:Fe-2e-===Fe2+ 18. 常温下,已知 Ksp(CaSO4)=9×10-6 mol2·L-2 及表中有关信息: 弱酸 CH3COOH H2CO3 电离平衡常数 (单位:mol·L-1) Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 下列判断正确的是( ) A.向 Na2CO3 溶液中滴入酚酞变红,原因是 CO23-+2H2O2 H CO3+2OH- B.常温时,CH3COOH 稀溶液的 pH=5,则[[CHCH33COOH]COO-]=1.8 C.NaHCO3 溶液中:[OH-]-[H+]=[H2CO3]-[CO23-] D.2×10-3 mol·L-1 的 Na2SO4 溶液与 5×10-3 mol·L-1CaCl2 溶液等体积混合,有沉淀产生 第Ⅱ卷(非选择题 共 46 分) 19.(14 分)合成氨工业对国民经济和社会发展有重要的意义。 (1) 合成氨工业中常以天然气与水蒸气为原料制取 H2: CH4(g)+H2O (g) CO(g)+ 3H2(g),反应中有关物质的化学键键能数据如下表所示, 化学键 C—H H—H H—O 键能(kJ·mol-1) 413 436 1075 465 则 CH4(g)+H2O (g) CO (g)+3H2(g) ΔH= kJ·mol-1 (2) 某科技小组在实验室中模拟合成氨反应,在 430℃、20KPa 时,将一定量的 N2、H2 置于 2L 的恒容密闭容器中发生反应,N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ·mol-1, 反应过程中各组分的物质的量变化如下图所示: ① 前 10 min 内的 H2 的平均反应速率为 mol/(L·min) ② 反应进行到 10min 时,曲线发生变化的原因可能是 A. 加入 N2 B. 减小容器容积 C. 加入催化剂 D. 降低温度 ③ 反应进行到 25min 时,曲线发生变化的原因是 ,再次达平衡时,平衡常数 (填“增大”、“减小”或“不变”)。 CH 3 O H ( g ) B (2) 工业上还利用天然气和水蒸气反应的产物合成甲醇:CO(g)+2H2(g) ΔH<0 ,在一定条件下 CO 的平衡转化率与温度、压强的关系如右图所示: ① p1 ___ p2(填“>”、“<”或“=”,下同) ② 比较该反应在 A、B 两点的平衡常数大小: K(A) K(B)。 20.(12 分)研究电化学原理与应用有非常重要的意义。 (1) 图 1 是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为:___________________________ 。 (1) 二氧化硫—空气—质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图 2 所示。Pt1 电极为 极(填“正”或“负”),Pt1 上的电极反应式为: ____________________________。当制得 5mol H2SO4 时,外电路中转移了 mol e-。 (2) 高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取: FeO 4 2 − + 3 H 2 ↑ , 工作原理如图所示。 Fe+2H2O+2OH− 装置通电后,铁电极附近生成紫红色的 FeO42−,镍电极有气泡产生。电解一段时间后, c(OH−)降低的区域在 (填“阴极室”或“阳极室”);阴极的电极反应式为:______ _________________。 21.(10 分) 25℃时,硫氢化钠(NaHS)溶液里存在下列平衡: a. HS− + H2O H2S + OH− b. HS− H+ + S2− (1) 已知 NaHS 溶液显碱性,则溶液中 c(HS−)、c(H2S)和 c(S2−)由大到小的是 (2) 若向其中加入硫酸铜溶液,可生成 CuS 沉淀,则平衡 a 向 移动(填“正向”或 “逆向”,下同);平衡 b 向 移动。 (1) 若将溶液加热至沸腾,c(H+)•c(OH−) 将变 (填“大”或“小”)。 (2) 25℃时,若在 0.1 mol·L-1 硫酸铜溶液中加入适量 NaHS 固体,使 Cu2+完全生成 CuS 沉淀,此时溶液中 c(H+) = (假设溶液的体积不变)。 22.(10 分)滴定的方法在化学研究中应用广泛。为了测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2 •xH2O】中铁元素的含量,进行如下实验: ① 用电子天平准确称量 5.000g 硫酸亚铁铵晶体,配制成 250ml 溶液。 ② 取 25.00ml 所配溶液于锥形瓶中,加入适量稀硫酸,用 0.01 mol·L-1 的 KMnO4 溶液滴定。 已知滴定过程中发生的反应为:5Fe2+ + MnO4− + 8H+ = 5Fe3+ + Mn2+ + 4H2O。 (1) 实验中,KMnO4 溶液应装在 滴定管中(填“酸式”或“碱式”)。滴定终点时溶液的颜色变化为 ,且 30s 内颜色不再恢复为原来的颜色。 (2) 以下操作会导致铁的质量分数偏高的是______(填字母)。 a.装入 KMnO4 溶液前未润洗滴定管 b.滴定过程中,振荡时将待测液洒出 c.滴定结束后俯视读数 d.接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点 (3) 滴定结果如下表所示: 滴定次数 待测液的体积/mL KMnO4 的体积 滴定前刻度/mL 滴定后刻度/mL 1 25.00 1.05 21.15 2 25.00 0.50 20.50 3 25.00 0.20 20.10 计算所配硫酸亚铁铵溶液中的 Fe2+浓度为 mol·L-1。 (4) 实验测得该晶体中铁元素的质量分数为 。 高二化学期中考试题答案 题号 1 2 3 4 5 6 7 8 9 答案 B B D C C A C B D 题号 10 11 12 13 14 15 16 17 18 答案 D C D A A B D C C 19.(14分) (1)199 (2)①2.5×10-3 ②C ③减小氨气的浓度 不变 (3)①﹤ ②﹥ 20.(12分) (1)4Al+3O2十6H2O=4Al(OH)3↓ (2) 负 SO2-2e- +2H2O = SO42- + 4H+ 10 (3)阳极室 2H++2e- =H2(或2H2O+2e- = H2 + 2OH-) 21.(10分) (1)c(HS−)﹥c(H2S)﹥c(S2−) (2)逆向 正向 (3)大 (4)0.1 mol·L-1 22.(10分) (1)酸式 黄色变为紫红色 (2)ac (3)0.04 (4)11.2% 查看更多