- 2021-06-23 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第8章 专题讲座六 无机化工流程题的解题策略
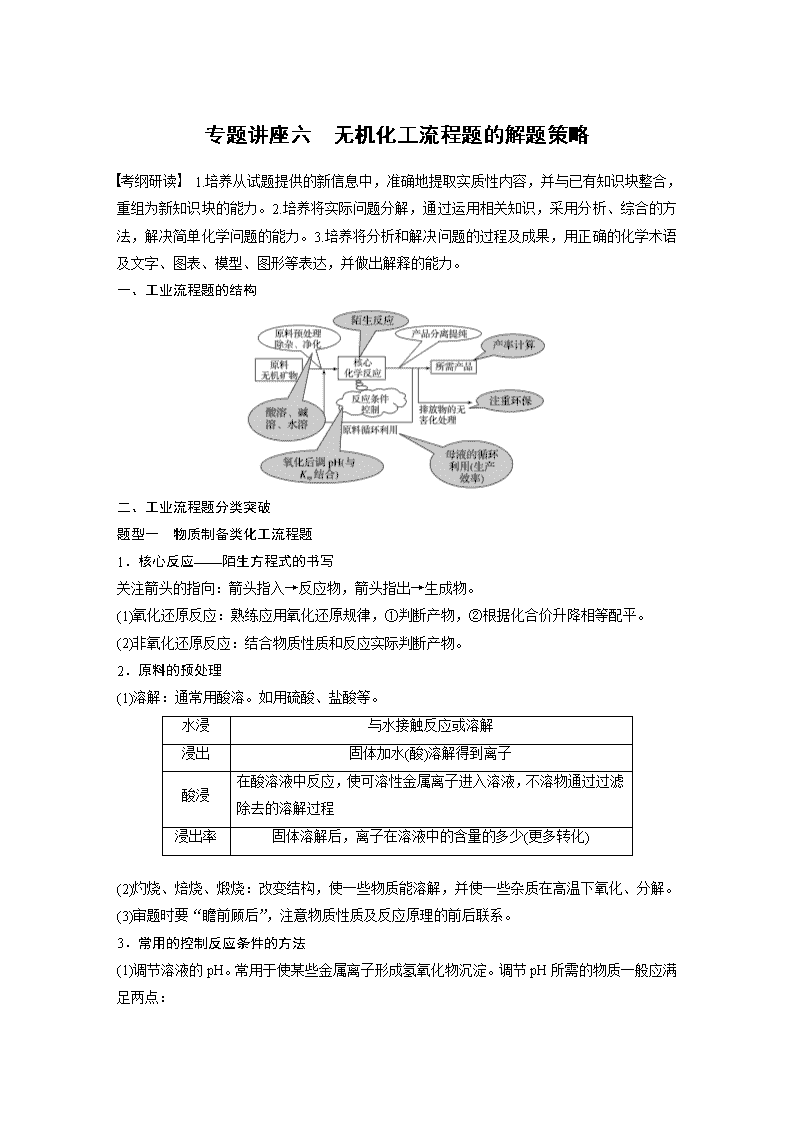
专题讲座六 无机化工流程题的解题策略 考纲研读 1.培养从试题提供的新信息中,准确地提取实质性内容,并与已有知识块整合,重组为新知识块的能力。2.培养将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。3.培养将分析和解决问题的过程及成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。 一、工业流程题的结构 二、工业流程题分类突破 题型一 物质制备类化工流程题 1.核心反应——陌生方程式的书写 关注箭头的指向:箭头指入→反应物,箭头指出→生成物。 (1)氧化还原反应:熟练应用氧化还原规律,①判断产物,②根据化合价升降相等配平。 (2)非氧化还原反应:结合物质性质和反应实际判断产物。 2.原料的预处理 (1)溶解:通常用酸溶。如用硫酸、盐酸等。 水浸 与水接触反应或溶解 浸出 固体加水(酸)溶解得到离子 酸浸 在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程 浸出率 固体溶解后,离子在溶液中的含量的多少(更多转化) (2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。 (3)审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。 3.常用的控制反应条件的方法 (1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点: ①能与H+反应,使溶液pH增大; ②不引入新杂质。 例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。 (2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。 (3)趁热过滤。防止某物质降温时会析出。 (4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。 [例1] (2016·全国卷Ⅰ,28)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 回答下列问题: (1)NaClO2中Cl的化合价为________。 (2)写出“反应”步骤中生成ClO2的化学方程式:_____________________________________ _______________________________________________________________________________。 (3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是________。 (4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为______,该反应中氧化产物是________。 (5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数) [解题流程] 第一步:读题目,明确目的——制备NaClO2 第二步:审流程,分块破题——拆分工艺流程 第三步:看设问,结合题中的问题,回到流程图中找答案。 [得分秘籍] (1)设问一般相对独立,无连带效应,一个问题解决不了不会影响下一个问题的解决。 (2)题中基本上都有与流程无关的问题,可直接作答;对于超纲知识,题目中要么有信息提示,要么与解答题目无关。 答案 (1)+3 (2)2NaClO3+H2SO4+SO2===2NaHSO4+2ClO2 (3)NaOH溶液 Na2CO3溶液 ClO(或NaClO2) (4)2∶1 O2 (5)1.57 题型二 提纯类化工流程题 1.明确常用的提纯方法 (1)水溶法:除去可溶性杂质。 (2)酸溶法:除去碱性杂质。 (3)碱溶法:除去酸性杂质。 (4)氧化剂或还原剂法:除去还原性或氧化性杂质。 (5)加热灼烧法:除去受热易分解或易挥发的杂质。 (6)调节溶液的pH法:如除去酸性溶液中的Fe3+等。 2.明确常用的分离方法 (1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。 (2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。 (3)蒸发结晶:提取溶解度随温度变化不大的溶质,如从溶液中提取NaCl。 (4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。 (5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇或甘油。 (6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气。 [例2] (2020·山东等级模拟考,19)普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下: (1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___________________________。 (2)加入锌粉的主要目的是______________________________________(用离子方程式表示)。 (3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在 碱性溶液中被还原为MnO。据流程判断,加入KMnO4时溶液的pH应调至________; a.2.2~2.4 b.5.2~5.4 c.12.2~12.4 滤渣Ⅲ的成分为________。 (4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1∶2,目的是_____________________________________________;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是___________________________________。 (5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为____________,反应的化学方程式为____________(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。 答案 (1)防止产生H2的浓度过大而发生爆炸 (2)Zn+Cu2+===Zn2++Cu,Zn+2H+===Zn2++H2↑ (3)b Fe(OH)3、MnO2 (4)防止C粉过量,进而形成CO O2可能将BaS氧化为SO2,污染环境 (5)ZnSO4、BaS、Na2S 4ZnSO4+BaS+3Na2S===BaSO4·4ZnS+3Na2SO4 解析 (3)反应的目的是除掉Fe2+,但该过程不能引入新的杂质,故MnO不能转化为Mn2+或MnO,需将溶液调节至弱酸性。(5)设ZnS为x mol,BaSO4为y mol,=62.5%,解得x∶y=4∶1。 1.(2019·原创预测卷九)甘氨酸亚铁[(NH2CH2COO)2Fe]是新一代畜禽饲料补铁添加剂。某实验小组以硫酸亚铁为铁源制备甘氨酸亚铁,其简要流程如下。 已知相关物质的信息如下: 甘氨酸 (NH2CH2COOH) 柠檬酸 (3羟基1,3,5戊三酸) 甘氨酸亚铁[(NH2CH2COO)2Fe] 易溶于水,微溶于乙醇,具有两性 易溶于水和乙醇,具有较强的酸性和还原性 浅黄褐绿色结晶粉末,易溶于水,难溶于乙醇,结构如下图: 回答下列问题: (1)步骤(a)中加入铁粉的作用是___________________________________________________; 写出生成沉淀的化学方程式:______________________________________________________ _______________________________________________________________________________。 (2)步骤(b)中为了提高甘氨酸亚铁的产率,需要控制溶液的pH在5.5~6.0之间,pH过低甘氨酸亚铁产率将下降,其原因为_____________________________________;柠檬酸的作用包括________(填字母)。 A.调节溶液的pH B.除去步骤(a)中加入的铁粉 C.防止Fe2+被氧化 D.促进沉淀的溶解,加快反应速率 (3)步骤(b)中趁热过滤的目的是_________________________________________________。 (4)步骤(c)中加入乙醇的目的是__________________________________________________。 (5)产品中Fe2+含量的检测:称取m g样品溶解于适量蒸馏水中,配制成100.0 mL溶液。用移液管取出25.00 mL溶液于锥形瓶中,向其中加入一定量混酸X进行酸化,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为V mL。 ①混酸X可以是________(填字母)。 A.HCl和H2SO4 B.HCl和H3PO4 C.H2SO4和H3PO4 D.H2SO4和HNO3 E.HCl和HNO3 ②滴定终点的现象为_____________________________________________________________ _______________________________________________________________________________。 ③据此计算Fe2+的质量分数为_____________________________________________________。 答案 (1)防止Fe2+被氧化 FeSO4+2NH4HCO3===FeCO3↓+(NH4)2SO4+H2O+CO2↑ (2)H+会与NH2CH2COOH反应,不利于甘氨酸亚铁的生成 ACD (3)除去铁粉,减少因温度降低甘氨酸亚铁析出带来的损失 (4)降低甘氨酸亚铁的损失 (5)①C ②当滴入最后一滴标准溶液时,溶液变为紫色或浅紫色,且半分钟内不变色 ③×100% 解析 (1)Fe2+在空气中易被氧化,加入Fe粉可防止其被氧化;Fe2+与HCO电离出的CO结合,H+再和过量的HCO反应生成CO2。 (2)NH2CH2COOH中有碱性基团—NH2,可以和H+反应,故pH应控制在5.5~6.0之间。 (4)甘氨酸亚铁难溶于乙醇,加入乙醇可降低其损失。 (5)①HCl有还原性、HNO3有氧化性,两者都会影响滴定结果,故选C;③由关系式MnO~5Fe2+可得n(Fe2+)=5cV×10-3mol,则Fe2+的质量分数为×100%=×100%。 2.(2019·山东德州一模)金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛。现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下: (1)酸浸时SO2的作用是__________________________________________________________。 (2)除铝时加入碳酸钠产生沉淀的离子方程式:_______________________________________ _______________________________________________________________________________。 (3)有机层提取出的Ni2+可用于制备氢镍电池,该电池工作原理:NiOOH+MHNi(OH)2+M,电池放电时正极的电极反应式为_____________________________________________。 (4)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)。如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10 ℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。 ①H2O2的电子式________________。 ②由图中信息可知:________法制取的催化剂活性更高。 ③Co2+、Ni2+两种离子中催化效果更好的是________。 (5)已知煅烧CoCO3时,温度不同,产物不同。在400 ℃充分煅烧CoCO3,得到固体氧化物的质量为2.41 g,CO2的体积为0.672 L(标准状况下),则此时所得固体氧化物的化学式为__________。 答案 (1)还原剂(或将Co3+还原为Co2+) (2)2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑ (3)NiOOH+e-+H2O===Ni(OH)2+OH- (4)① ②微波水热 ③Co2+ (5)Co3O4 解析 (1)从流程图可知,在酸浸过程中Co2O3转化为Co2+,故SO2为还原剂。 (2)Al3+与CO会发生相互促进的水解反应生成Al(OH)3沉淀和CO2气体:2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑。 (3)从电池的总反应方程式可知,该电池为碱性电池,放电过程中正极NiOOH转化为Ni(OH)2:NiOOH+e-+H2O===Ni(OH)2+OH-。 (4)②从图像可知,微波水热法制取的催化剂的催化效果更好。③x值越大,Co2+的含量越大,H2O2分解的相对初始速率越大,故Co2+的催化效果更好。 (5)根据元素守恒,n(Co)=n(CO2)==0.03 mol,m(Co)=0.03 mol×59 g·mol-1=1.77 g;该氧化物中氧原子的质量;m(O)=2.41 g-1.77 g=0.64 g,n(O)==0.04 mol,所以该氧化物的化学方程式为Co3O4。 3.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: 已知:①部分金属阳离子完全沉淀时的pH如下表 金属阳离子 Fe3+ Al3+ Mn2+ Mg2+ 完全沉淀时的pH 3.2 5.2 10.4 12.4 ②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。 (1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 ________________________________________________________________________。 (2)第1步除杂中加入H2O2的目的是_______________________________________________。 (3)第1步除杂中形成滤渣1的主要成分为__________(填化学式),调pH至5~6所加的试剂,可选择________(填字母)。 a.CaO b.MgO c.Al2O3 d.氨水 (4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:_____________________________________________________________,该反应的平衡常数数值为________。 (已知:MnF2的Ksp=5.3×10-3 mol3·L-3;CaF2的Ksp=1.5×10-10 mol3·L-3;MgF2的Ksp=7.4×10-11 mol3·L-3) (5)采用“趁热过滤”操作的原因是________________________________________________。 (6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是____________ _____________________________(用离子方程式表示)。 答案 (1)MnO2+SO2===SO+Mn2+ (2)将Fe2+氧化为Fe3+ (3)Al(OH)3、Fe(OH)3 ab (4)MnF2+Mg2+Mn2++MgF2 7.2×107 (5)减少MnSO4·H2O在水中的溶解,得到更多产品 (6)Mn2++2H2OMn(OH)2+2H+ 解析 (1)“浸出”过程中MnO2与SO2发生氧化还原反应,离子方程式为MnO2+SO2===SO+Mn2+。 (2)第1步除杂中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,以便于形成Fe(OH)3沉淀,过滤将沉淀除去。 (3)第1步除杂时调整溶液的pH在5~6,可以使溶液中的Al3+、Fe3+分别形成Al(OH)3、Fe(OH)3沉淀,所以形成滤渣1的主要成分为Al(OH)3、Fe(OH)3;在调pH至5~6时,为了不引入新的杂质离子,所加的试剂应该可以与酸发生反应,可选择含有Ca2+、Mg2+的化合物CaO、MgO,a、b正确。 (4)第2步除杂,主要是将Ca2+、Mg2+转化为相应的氟化物沉淀除去,MnF2除去Mg2+的离子方程式是MnF2+Mg2+Mn2++MgF2;该反应的平衡常数K===≈7.2×107。 (5)由已知②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低,故采用“趁热过滤”操作可以减少MnSO4·H2O在水中的溶解,得到更多产品。 (6)MnSO4是强酸弱碱盐,Mn2+发生水解反应。查看更多