- 2021-06-23 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第7章 专项提能特训15 速率图像与实验探究
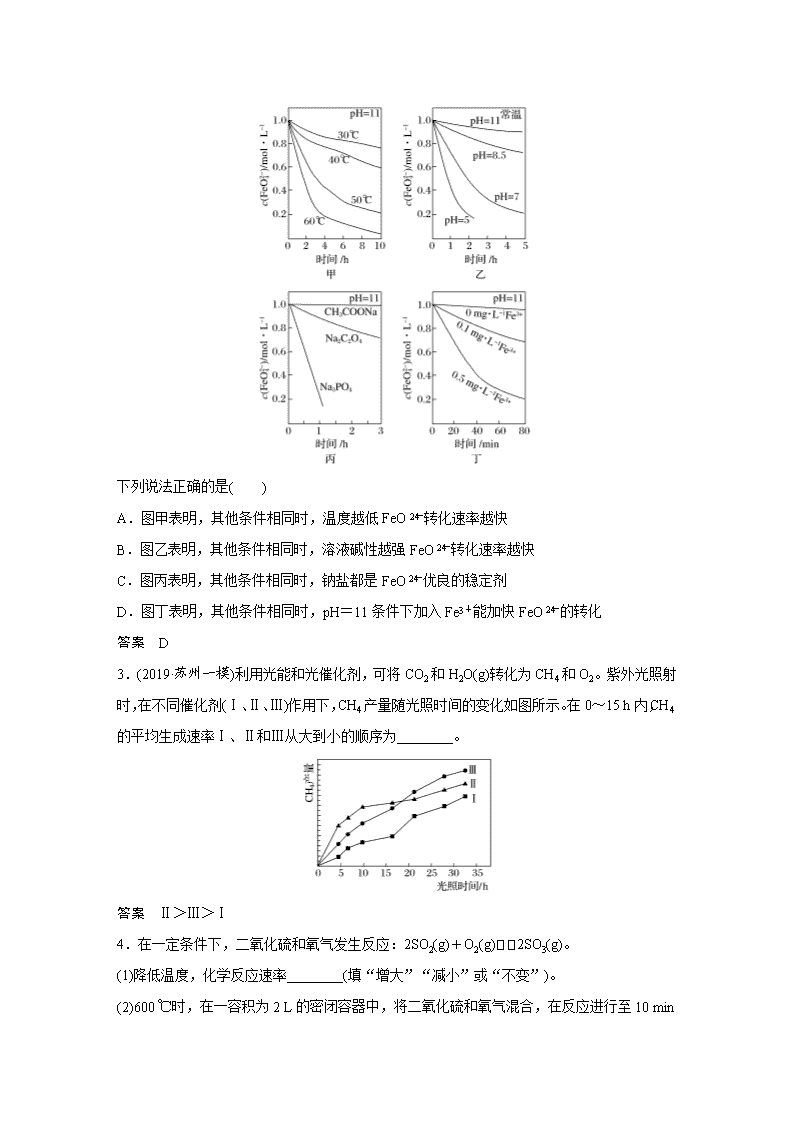
专项提能特训15 速率图像与实验探究 1.为研究硫酸铜的量对锌与稀硫酸反应生成氢气速率的影响,某同学设计了如下一系列实验。表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。下列说法正确的是( ) 实验 混合溶液 A B C D E F 4 mol·L-1H2SO4溶液/mL 30 V1 V2 V3 V4 V5 饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20 H2O/mL V7 V8 V9 V10 10 0 A. V1=30,V6=10 B.反应一段时间后,实验A、E中的金属呈暗红色 C.加入MgSO4与Ag2SO4可以与硫酸铜起相同的加速作用 D.硫酸铜的量越多,产生氢气的速率肯定越快 答案 A 解析 A项,反应的总体积应该相同。A组中硫酸为30 mL,那么其他组硫酸量也都为30 mL,因此V1=30,而硫酸铜溶液和水的总量应相同,F组中硫酸铜为20 mL,水为0 mL,那么总量为50 mL,因此V6=10,故正确;B项,A中Zn反应较慢,反应一段时间后金属呈灰黑色,而E中置换出大量的Cu,反应一段时间后金属呈暗红色,故错误;C项,硫酸镁与锌不反应,不能形成原电池,故错误;D项,如果硫酸铜过多,生成的铜附着在锌表面,会阻碍锌与硫酸的反应,反而会降低反应速率,故错误。 2.(2018·南京、盐城一模)已知:4FeO+10H2O===4Fe(OH)3↓+8OH-+3O2↑。测得c(FeO)在不同条件下变化如图甲、乙、丙、丁所示。 下列说法正确的是( ) A.图甲表明,其他条件相同时,温度越低FeO转化速率越快 B.图乙表明,其他条件相同时,溶液碱性越强FeO转化速率越快 C.图丙表明,其他条件相同时,钠盐都是FeO优良的稳定剂 D.图丁表明,其他条件相同时,pH=11条件下加入Fe3+能加快FeO的转化 答案 D 3.(2019·苏州一模)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~15 h内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为________。 答案 Ⅱ>Ⅲ>Ⅰ 4.在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)2SO3(g)。 (1)降低温度,化学反应速率________(填“增大”“减小”或“不变”)。 (2)600 ℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10 min 和20 min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,前10 min正反应速率逐渐________(填“增大”“减小”或“不变”);前15 min内用SO3表示的平均反应速率为____________________________________________________。 (3)图中反应进程,表示正反应速率与逆反应速率相等的时间段是___________________。 (4)根据如图判断,10 min时改变的条件可能是____________________________________; 20 min时改变的反应条件可能是________。 a.加入催化剂 b.缩小容器容积 c.降低温度 d.增加O2的物质量 答案 (1)减小 (2)减小 1.33×10-3mol·L-1·min-1 (3)15~20 min,25~30 min (4)ab d 解析 (2)前10 min随着反应的不断进行,反应物SO2和O2的浓度不断减小,正反应速率减小,前15 min内用SO3表示的平均反应速率为≈1.33×10-3mol·L-1·min-1。(3)反应过程中SO2、O2、SO3物质的量不随时间变化的时间段,即15~20 min和25~30 min 反应处于平衡状态。(4)10~15 min三条曲线的斜率突然增大,说明反应速率突然加快,其原因可能是加入催化剂或缩小容器容积。反应进行至20 min时,曲线发生的变化是O2 的物质的量突然增大,平衡发生移动,引起SO2、SO3物质的量随之发生变化。 5.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。 (1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)CO(g)+H2(g) ΔH=131.3 kJ·mol-1。能使化学反应速率加快的措施有____________。 ①增加C的物质的量 ②升高反应温度 ③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g) (2)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol 的H2,在一定条件下发生如下反应:CO(g)+2H2(g)CH3OH(g) ΔH<0。该反应的逆反应速率与时间的关系如图所示: ①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________________。 ②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4~t6时逆反应速率与时间的关系曲线。 答案 (1)②④ (2)①使用了催化剂 ② 解析 (1)增加C的物质的量,不能改变其浓度,不能加快化学反应速率;吸收CO、H2相当于降低生成物的浓度,其化学反应速率减慢;充入CO增大生成物的浓度,可使化学反应速率加快。(2)①本反应前后气体物质的化学计量数之和不等,t8时逆反应速率急剧提高且与正反应速率相等,故只能是加催化剂的原因。②t4时降压,平衡左移,v逆急降,然后在t5时平衡。查看更多