山东专用2020届高考化学二轮复习题组30陌生图像读图专练含解析
题组30 陌生图像读图专练
1.用CO合成甲醇(CH3OH)反应的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
(1)a、b、c三点平衡常数K(a)、K(b)、K(c)的大小顺序是 。
(2)b、d两点的平均相对分子质量为M(b)、M(d),则M(b) (填“>”“<”或“=”)M(d)。
答案 (1)K(a)>K(b)>K(c) (2)>
解析 (1)由题图可知a、b、c三点压强相同;由化学方程式可知,温度升高,平衡逆向(吸热方向)移动,CO的平衡转化率减小,故T1
K(b)>K(c)。(2)由d到b压强增大,CO的转化率增大,正向气体分子数减少,因而平均相对分子质量增大,即M(b)>M(d)。
2.常温下,在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
(1)由图分析可得,在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存。
(2)已知在25 ℃时,CO32-水解反应的平衡常数(水解常数用Kh表示)Kh=c(HCO3-)·c(OH-)c(CO32-)=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH= 。
(3)当混合液的pH= 时,开始放出CO2气体。
答案 (1)不能 (2)10 (3)6
解析 由题图可知,常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40
- 4 -
mL,先反应生成碳酸氢钠,碳酸氢根离子再与盐酸反应生成碳酸,进而分解产生二氧化碳、水。(1)由反应及题图可知,在同一溶液中H2CO3与CO32-不能大量共存,故H2CO3、HCO3-、CO32-不能大量共存。(2)当溶液中c(HCO3-)∶c(CO32-)=2∶1时,根据Kh=c(HCO3-)·c(OH-)c(CO32-)=2×10-4,则有c(OH-)=2×10-4×c(CO32-)c(HCO3-)=1×10-4 mol·L-1,c(H+)=1×10-141×10-4 mol·L-1=1×10-10mol·L-1,pH=-lg10-10=
10。(3)当溶液中H2CO3达到饱和后,开始放出CO2气体,由题图可以看出,当溶液pH=6时,H2CO3达到饱和,开始放出CO2气体。
3.炼铅和用铅都会使水体因重金属铅的含量大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态铅的浓度分数x与溶液pH变化的关系如图所示。
(1)向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为 。
(2)科研小组发现一种新型试剂DH(s)去除Pb2+的效果最好,可除去水中的痕量铅和其他杂质离子。若DH(s)在脱铅过程中发生的主要反应为2DH(s)+Pb2+ D2Pb(s)+2H+,则脱铅时最合适的pH约为 。
答案 (1)Pb(OH)3-+OH- Pb(OH)42- (2)6
解析 (1)pH≥13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子结合为Pb(OH)42-,反应的离子方程式为Pb(OH)3-+OH- Pb(OH)42-。(2)脱铅过程中发生的主要反应为2DH(s)+Pb2+ D2Pb(s)+2H+,参加反应的是Pb2+,由题图可知,选择pH要使铅全部以Pb2+形式存在,则脱铅时最合适的pH约为6。
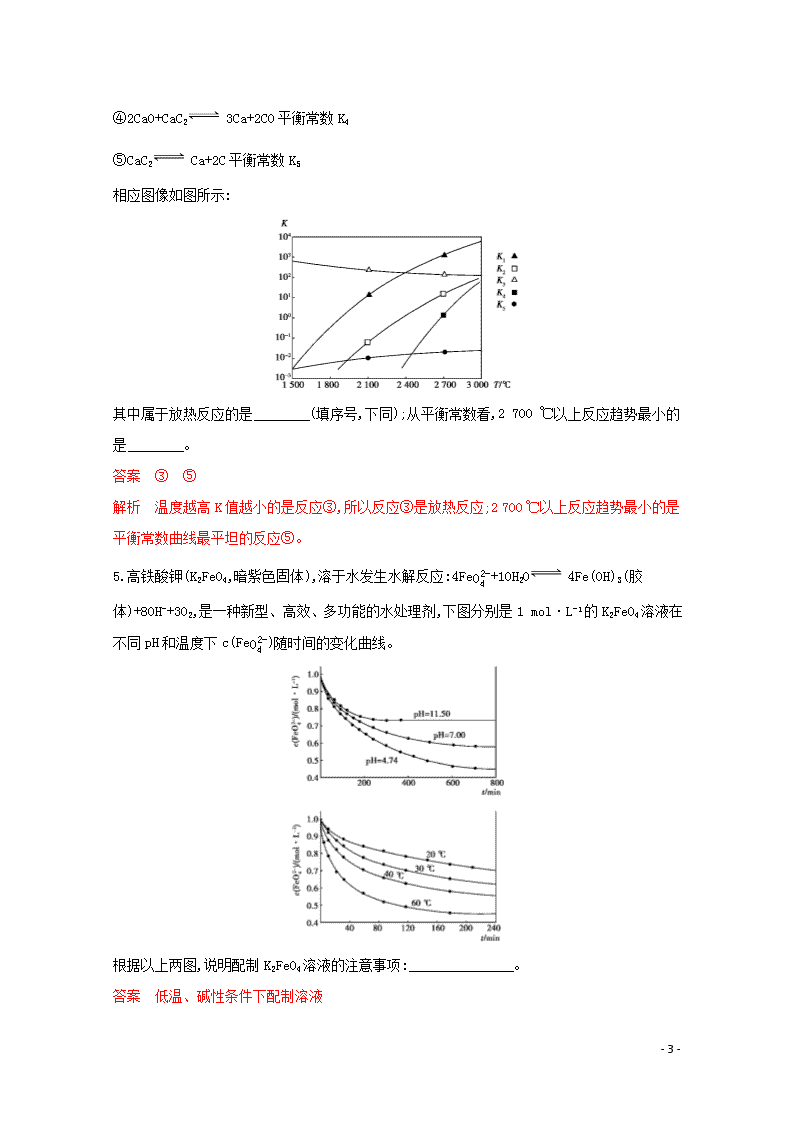
4.为探究碳化钙合成机理,有学者认为可能存在以下5种反应(状态已省略):
①CaO+3C CaC2+CO平衡常数K1
②CaO+C Ca+CO平衡常数K2
③Ca+2C CaC2平衡常数K3
- 4 -
④2CaO+CaC2 3Ca+2CO平衡常数K4
⑤CaC2 Ca+2C平衡常数K5
相应图像如图所示:
其中属于放热反应的是 (填序号,下同);从平衡常数看,2 700 ℃以上反应趋势最小的是 。
答案 ③ ⑤
解析 温度越高K值越小的是反应③,所以反应③是放热反应;2 700 ℃以上反应趋势最小的是平衡常数曲线最平坦的反应⑤。
5.高铁酸钾(K2FeO4,暗紫色固体),溶于水发生水解反应:4FeO42-+10H2O 4Fe(OH)3(胶体)+8OH-+3O2,是一种新型、高效、多功能的水处理剂,下图分别是1 mol·L-1的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
根据以上两图,说明配制K2FeO4溶液的注意事项: 。
答案 低温、碱性条件下配制溶液
- 4 -
解析 高铁酸根离子水解方程式:4FeO42-+10H2O 4Fe(OH)3(胶体)+8OH-+3O2,依据图中信息可知升高温度,减小pH,高铁酸根离子浓度降低,所以应在低温、碱性条件下配制高铁酸钾溶液。
6.研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
已知:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH=-1 810 kJ·mol-1
(1)相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化如图1所示。
图1 图2
①0~50 s在A催化剂作用下,反应速率v(N2)= 。
②在A、B、C三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图1曲线,判断三种催化剂条件下,活化能由大到小的顺序为 。
(2)在氨气足量时,反应在催化剂A作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,温度对脱氮率的影响是
,其可能的原因是 (已知A、B催化剂在此温度范围内不失效)。
答案 (1)①2.5×10-5 mol·L-1·s-1 ②Ea(C)>Ea(B)>Ea(A) (2)300 ℃之前,温度升高脱氮率逐渐增大,300 ℃之后,温度升高脱氮率逐渐减小 300 ℃之前反应未平衡,脱氮率主要取决于反应速率,温度越高,反应速率越快,所以脱氮率增大,300 ℃之后脱氮率主要取决于平衡移动,该反应的正反应是放热反应,升高温度平衡逆向移动,脱氮率减小
解析 (1)①v(N2)=2.5×10-3mol2 L50 s=2.5×10-5 mol·L-1·s-1。②由图1明显看出在A、B、C三种催化剂下N2的反应速率依次减小,活化能越大,反应速率越小,因而Ea(C)>Ea(B)>Ea(A)。
- 4 -