- 2021-06-21 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020版高中化学(人教版 选修3)练习:章末综合检测2
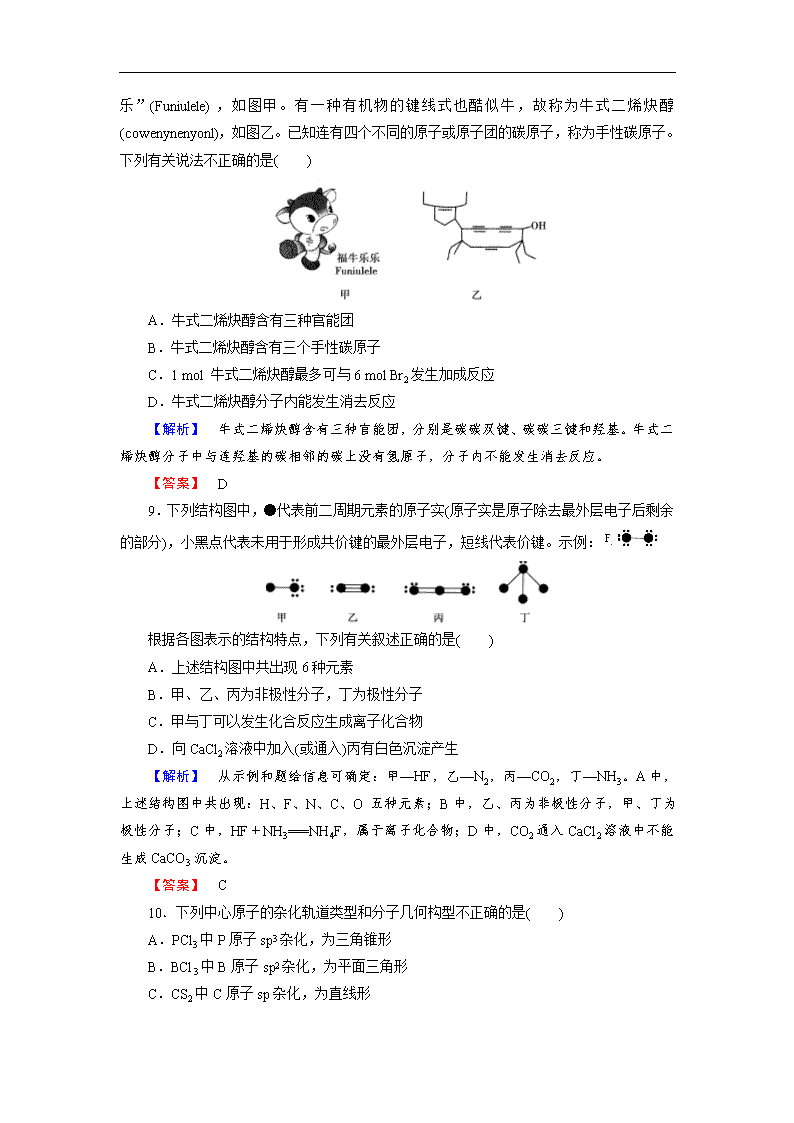
章末综合检测 (90分钟,100分) 一、选择题(本题包括18个小题,每小题3分,共54分) 1.只有在化合物中才能存在的化学键是( ) A.离子键 B.共价键 C.金属键 D.非极性键 【解析】 离子键是阴、阳离子之间的静电作用,要产生阴、阳离子,一定是不同种元素的原子;含离子键的一定是化合物;非极性键是共价键的一种,可能存在于化合物中(如H2O2、C2H4等),也可能存在于单质分子中;金属键只能存在于金属单质中。 【答案】 A 【点评】 化学键存在的几个特殊情况:①稀有气体为单原子分子,不存在化学键;②金属单质中只存在金属键;③非金属单质中只存在非极性键;④极性键和离子键只能存在于化合物中。 2.下列化学键中,键的极性最强的是( ) A.C—F B.C—O C.C—N D.C—C 【解析】 共价键的极性与元素电负性大小有关,元素间的电负性相差越大,形成的共价键极性越强。因电负性大小顺序为:F>O>N>C,故选A。 【答案】 A 3.(2014·合肥模拟)下列各组分子中,都属于含极性键的非极性分子的是( ) A.CO2 H2O B.C2H4 CH4 C.Cl2 C2H2 D.NH3 HCl 【解析】 属于非极性分子的有:CO2、C2H4、CH4、Cl2、C2H2,其中Cl2不含极性键。 【答案】 B 4.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( ) A.CCl4、SiCl4、SiH4 B.H2S、NF3、CH4 C.BCl3、CH2===CHCl、环已烷 D.SO3、C6H6(苯)、CH3C≡CH 【解析】 A项,中心原子都是sp3杂化,其键角相同;B项,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同;C项,三氯化硼和氯乙烯的中心原子都是sp2杂化,环已烷中碳原子为sp3杂化;D项,三氧化硫和苯的中心原子为sp2杂化,而丙炔中碳原子为sp和sp3杂化。 【答案】 B 5.(2014·盐城模拟)下列关于化学键的叙述正确的是( ) A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.化学键是原子或离子间较强烈的引力 D.含有共价键的化合物一定是共价化合物 【解析】 含有离子键的化合物一定是离子化合物,含有共价键的化合物不一定是共价化合物,离子化合物中也可能含有共价键,如NaOH,A项正确,D项错误。单质分子中也可能存在化学键,如H2、O2、N2等分子中均存在非极性共价键,B项错误。化学键是一种静电作用,既有引力也有斥力,C项错误。 【答案】 A 6.(2014·江苏宿迁中学期中)下列分子中所有原子都满足最外层8电子稳定结构的是( ) A.光气(COCl2) B.六氟化硫 C.五氯化磷 D.三氟化硼 【解析】 四个选项给出的物质都为共价化合物,原子间形成共用电子对。A项可由CO2结构联想到光气的结构式为。C、O、Cl原子最外层均为8个电子。B项SF6中S有6个共用电子对,C项PCl5中P有5个共用电子对,S与P最外层均多于8个电子。硼原子最外层只有3个电子,与3个F原子形成3个共价键后,BF3分子中B原子最外层只有6个电子。 【答案】 A 7.下列物质中都存在离子键、极性键和配位键的是( ) A.氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠 B.硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵 C.硫酸、氢氧化钠、氮化钙、氢氧化钡 D.氯化铵、氢氧化钠、双氧水、过氧化钙 【解析】 铵离子中存在极性共价键和配位键,氨分子中氮原子上有孤电子对,H+、Cu2+、Ag+有空轨道,能形成配位键。A项,只有硫酸四氨合铜中含有离子键、共价键和配位键,A项错误;C项和D项中都不含配位键,C和D项错误。 【答案】 B 8.(2014·天津调研)2008年北京残奥会吉祥物是以牛为形象设计的“ 福牛乐乐”(Funiulele),如图甲。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenyonl),如图乙。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( ) A.牛式二烯炔醇含有三种官能团 B.牛式二烯炔醇含有三个手性碳原子 C.1 mol 牛式二烯炔醇最多可与6 mol Br2发生加成反应 D.牛式二烯炔醇分子内能发生消去反应 【解析】 牛式二烯炔醇含有三种官能团,分别是碳碳双键、碳碳三键和羟基。牛式二烯炔醇分子中与连羟基的碳相邻的碳上没有氢原子,分子内不能发生消去反应。 【答案】 D 9.下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例: 根据各图表示的结构特点,下列有关叙述正确的是( ) A.上述结构图中共出现6种元素 B.甲、乙、丙为非极性分子,丁为极性分子 C.甲与丁可以发生化合反应生成离子化合物 D.向CaCl2溶液中加入(或通入)丙有白色沉淀产生 【解析】 从示例和题给信息可确定:甲—HF,乙—N2,丙—CO2,丁—NH3。A中,上述结构图中共出现:H、F、N、C、O 五种元素;B中,乙、丙为非极性分子,甲、丁为极性分子;C中,HF+NH3===NH4F,属于离子化合物;D中,CO2通入CaCl2溶液中不能生成CaCO3沉淀。 【答案】 C 10.下列中心原子的杂化轨道类型和分子几何构型不正确的是( ) A.PCl3中P原子sp3杂化,为三角锥形 B.BCl3中B原子sp2杂化,为平面三角形 C.CS2中C原子sp杂化,为直线形 D.H2S分子中,S为sp杂化,为直线形 【解析】 PCl3中P原子为sp3杂化,与NH3、NCl3中的N原子相似,分子构型为三角锥形;BCl3与BF3相似,B原子为sp2杂化,分子构型为平面三角形;CS2和CO2相似,C原子为sp杂化,分子构型为直线形;H2S和H2O结构相似,H2O中O为sp3杂化,H2O为V形,故H2S中S也为sp3杂化,结构为V形。 【答案】 D 11.(2014·孝昌质检)下列物质在水中溶解度的顺序正确的是( ) A.NH3>HCl>CO2>SO2>Cl2 B.SO2>CS2>H2S>S8 C.HOCH2(CHOH)4CHO>C17H35COOH>HCOOH D.HF>CO2>CH4 【解析】 水为极性分子,与水形成氢键、与水反应的气体在水中溶解度大。二氧化碳是非极性分子,二氧化硫是极性分子,二氧化硫在水中的溶解度大于二氧化碳,A项错误;CS2是非极性分子,溶解度小于SO2、H2S,B项错误;HCOOH与水形成氢键,能与水混溶,同类有机物的相对分子质量越大,极性越弱,在水中的溶解度越小,C项错误;HF与水形成氢键,CH4和二氧化碳都是非极性分子,而二氧化碳与水反应,所以HF的溶解度最大,CH4最小,D项正确。 【答案】 D 12.(2014·温州联考)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的几何构型和中心原子(S)采取杂化方式的说法正确的是( ) A.三角锥形、sp3 B.V形、sp2 C.平面三角形、sp2 D.三角锥形、sp2 【解析】 SOCl2分子中S原子的杂化轨道数为1+3=4,S原子采取sp3杂化,由于孤对电子占据一个杂化轨道,分子构型为三角锥形。 【答案】 A 13.有关苯分子中的化学键描述正确的是( ) A.每个碳原子的sp2杂化轨道中的其中一个形成大π键 B.每个碳原子的未参加杂化的2p轨道形成大π键 C.碳原子的三个sp2杂化轨道与其他形成两个σ键 D.碳原子的未参加杂化的2p轨道与其他形成σ键 【解析】 根据必修②所学知识,知道苯分子是平面结构,则可推测:中心碳原子以sp2杂化形成三个杂化轨道,还有一个未杂化的p轨道。所以,其结合形式为:每个碳原子分别以三个sp2杂化轨道与其他两个C和一个H原子形成σ键,未杂化的p轨道上电子与其他五个碳原子上的p电子形成大π键。 【答案】 B 14.用杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是( ) A.C原子的四个杂化轨道的能量一样 B.C原子的sp3杂化轨道之间夹角一样 C.C原子的4个价电子分别占据4个sp3杂化轨道 D.C原子有1个sp3杂化轨道由孤电子对占据 【解析】 在甲烷分子中,C原子以sp3杂化,每个杂化轨道上1个电子分别与1个氢原子上的1个s电子结合生成共价键,这四个共价键完全相同,轨道间夹角为109°28′。 【答案】 D 15.(2014·武汉四校联考)下列说法中正确的是( ) A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 B.水很稳定是因为水中含有大量的氢键所致 C.H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3杂化 D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO,配位数是1 【解析】 依据判断极性分子和非极性分子的经验规律可知A项正确;H2O很稳定是因为H—O键键能大,B项错误;在NH3、H2O、CH4中N、O、C均采取sp3杂化,只不过NH3、H2O分子中孤电子对占据着杂化轨道,C项错误;[Cu(H2O)4]SO4中配位体是H2O,配位数是4,D项错误。 【答案】 A 16.(2014·福建六市联考)有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( ) A.元素Y和Q可形成一种化合物Y2Q3 B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强,是因为前者的非羟基氧原子数目大于后者 C.X和Q结合生成的化合物为离子化合物 D.ZQ2是极性键构成的非极性分子 【解析】 X的电子排布式为1s22s22p63s23p4,为S元素;Y的电子排布式为1s22s22p63s23p63d64s2,为Fe元素;Z的电子排布式为1s22s22p2,为C元素;Q的电子排布式为1s22s22p4,为O元素;T的电子排布式为1s22s22p63s23p3,为P元素。C项中,X与Q形成的化合物SO2或SO3都为共价化合物,故C项不正确。 【答案】 C 17.下列说法中,不正确的是( ) A.N2O与CO2、CCl3F与CCl2F2互为等电子体 B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 C.H2CO3与H3PO4的非羟基氧原子数均为1,二者的酸性(强度)非常相近 D.由ⅠA族和ⅥA族元素形成的原子个数比为11、电子总数为38的化合物,是含有共价键的离子化合物 【解析】 N2O与CO2的原子数相同,电子数相同,CCl3F与CCl2F2的原子数相同,原子的最外层电子数之和相同,它们都是等电子体;CCl2F2无同分异构体,说明它是立体结构而不是平面结构,则碳原子采用sp3杂化方式;由于CO2与H2O的化合程度小,H2CO3的酸性比H3PO4弱得多,C错;D项中的物质指的是Na2O2,它是含有(非极性)共价键的离子化合物。 【答案】 C 18.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( ) A.配合物中中心原子的电荷数和配位数均为6 B.该配合物可能是平面正方形结构 C.Cl-和NH3分子均为Pt4+配体 D.配合物中Cl-与Pt4+配位,而NH3分子不配位 【解析】 PtCl4·2NH3水溶液不导电,说明配合物溶于水不会产生自由移动的离子;加入AgNO3溶液反应不产生沉淀并且以强碱处理并没有NH3放出,说明Cl-和NH3都参与配位,配位数是6;配位数是6的配合物不可能是平面结构,可能是正八面体或变形的八面体。 【答案】 C 二、非选择题(本题包括5小题,共46分) 19.(2014·江西七校联考)(7分)氧元素与多种元素具有亲和力,所形成化合物的种类很多。 (1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。 (2)根据等电子体原理,在NO中氮原子轨道杂化类型是__________;1 mol O中含有的π键数目为__________个。 (3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。 (4)下列物质的分子与O3分子的结构最相似的是__________。 A.H2O B.CO2 C.SO2 D.BeCl2 (5)O3分子是否为极性分子?__________。 【解析】 (1)由洪特规则的特例可知,氮元素的第一电离能大于氧元素(大于氮元素的“左邻右舍”),小于氟元素;由价层电子对互斥理论可知,OF2分子的空间构型是V形。(2)根据等电子体原理,NO与CO2互为等电子体,两者的结构相似,NO中氮原子的杂化方式与CO2中碳原子的杂化方式相同,都是sp杂化;O与N2(其中有一个σ键和两个π键)互为等电子体,因此O中有2个π键。(5)(6)可根据价层电子对互斥理论分析,SO2与O3分子的结构最相似,且都是极性分子。 【答案】 (1)F>N>O V形 (2)sp 2NA (3)1s22s22p63s23p63d3 (4)C (5)是 20.(2014·江汉三市联考)(12分)回答下列问题。 (1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是________,键长较长的是________。 (2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。 (3)SO2与CO2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是______________________________________。 (4)醋酸的球棍模型如图1所示。 ①在醋酸中,碳原子的轨道杂化类型有________; ②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。 A.极性键 B.非极性键 C.配位键 D.金属键 【答案】 (1)2 H—Cl H—S (2)CO2 (3)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大 (4)①sp3、sp2 ②A、B、C 21.(2014·青岛调研)(9分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并且在DB2和EB2中,D与B的质量比为78,E与B的质量比为11。试回答: (1)写出D原子的电子排布式________。 (2)用电子式表示AE2的形成过程________。 (3)B、C两元素的第一电离能较大的元素是________(填写元素符号)。 (4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。 (5)C的单质中π键的数目为________个,B、D两元素的气态氢化物的稳定性大小关系为________>________(填写化学式)。 【答案】 (1)1s22s22p63s23p2 (3)N (4)三角锥形 sp3杂化 (5)2 H2O SiH4 22.(2014·长沙质检)(9分)甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料。 (1)与甲醇互为等电子体的有机物分子式为:________,甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:_________________________________________________________。 (2)N2H4中N—N键键能________(填“>”“<”或“=”)CH3CH3中C—C键键能,工业上将NH3或(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为________、________,1 mol(CH3)2 CO中的π键数目为________。 (3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍为0价,镍原子在基态时,核外电子排布式为________;[Ni(CO)4]的配体是________,配位原子是________。 【答案】 (1)CH3SH 甲醇分子间形成氢键,分子间作用力大 (2)> sp3 sp2 NA(或6.02×1023) (3)1s22s22p63s23p63d84s2或[Ar]3d84s2 CO C 23.(2014·东北三校联考)(9分)X、Y、Z、W、R为前四周期原子序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,Z元素原子核外电子的运动状态共有8种;R元素与比它核电荷数大的另外两种元素位于第四周期同一族。 (1)X的一种核素用于鉴定文物年代,该核素的符号为________。 (2)X、Y、Z、W四种元素第一电离能由大到小的顺序为________(用元素符号表示)。 (3)用氢键表示式写出W的气态氢化物水溶液中不同种分子间存在的氢键________。 (4)Y的一种氢化物分子中共有18个电子,该分子中存在的共价键类型有________(填选项字母)。 A.非极性键 B.极性键 C.s-s σ键 D.s-p σ键 E.p-p π键 F.s-sp3 σ键 G.sp3-sp3 σ键 H.sp3-sp3 π键 (5)R的基态原子的价层电子排布式为________,R元素位于周期表的________区。 【解析】 由题干中信息可知,X为C,Y为N,Z为O,W为F,R为Fe。 【答案】 (1)C(或14C) (2)F、N、O、C (3)F—H…O、O—H…F (4)ABFG (5)3d64s2 d查看更多