- 2021-06-21 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年福建省闽侯县第八中学高二上学期期末考试化学试题 Word版
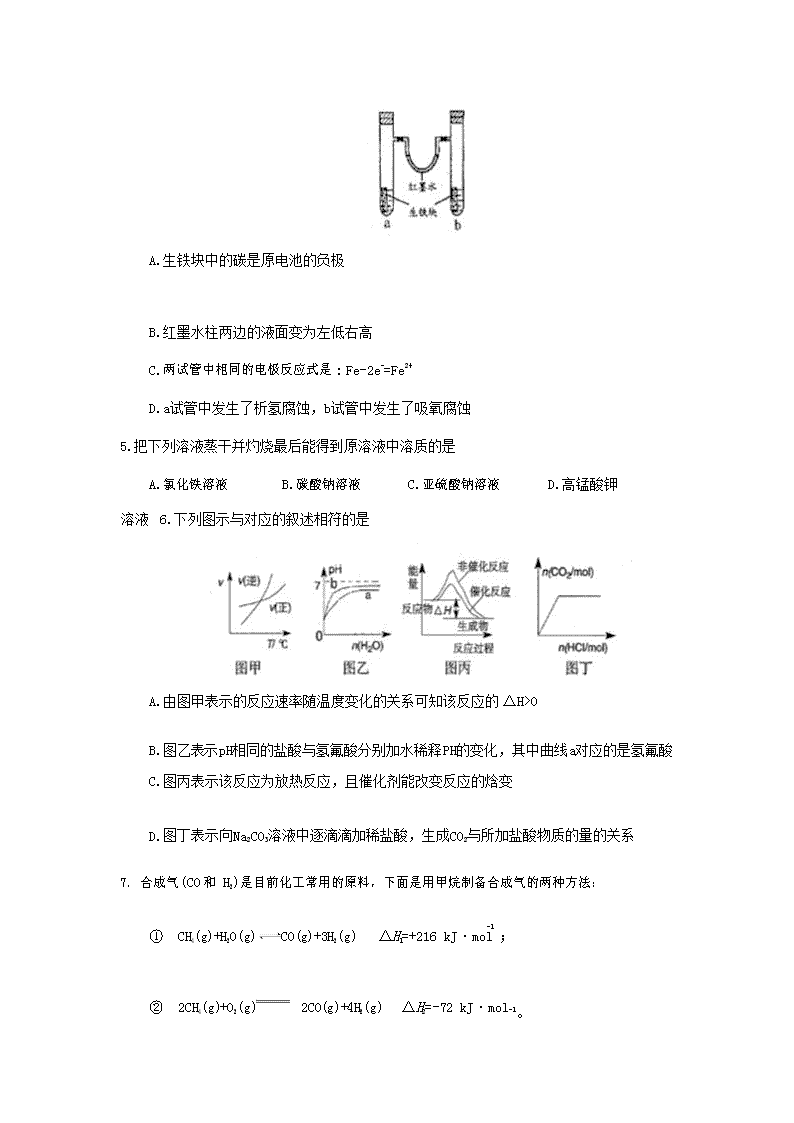
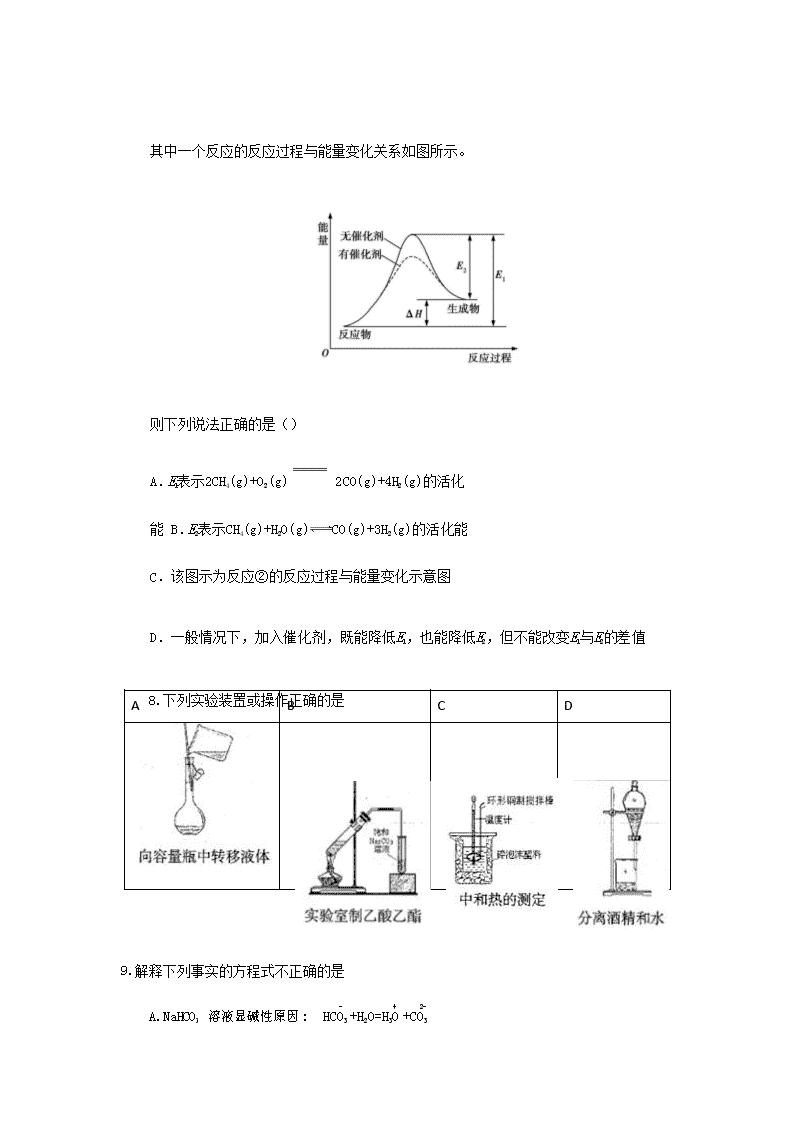
福建省闽侯县第八中学 2017-2018 学年高二上学期期末化学考试试题 本试卷分第Ⅰ卷(选择题)和第 II 卷(非选择题)两部分。考生作答时,将答案答在答题卡 上,在本试卷上答题无效。 本卷满分: 100 分; 考试时间: 90 分钟 可能用到的相对原子质量: H- 1 C- 12 O-16 Al-27 Fe- 56 I-127 第 I 卷(选择题共 54 分) 一、选择题: (共 18 小题,每小题只有个选项符合题意。每小题 3 分,共 54 分。) 1、下列能量转化过程中化学能转化为热能的是 A.盐类的水解 B.冰雪融化 C.酸碱的中和 D.煅烧石灰石制生石灰 2.下列各化合物的命名中正确的是 A.CH2=CH-CH=CH2 1,3—二丁烯 B. C 甲基苯酚 D 2—甲基丁烷 3.NA 为阿伏加德罗常数,下列说法不正确的是 A.500mL2mol/L 葡萄糖溶液中所含分子总数是 NA B.1L0.1mol/LNa2CO3 溶液中的阴离子总数大于 0.1NA C.1molNa2O 和 Na2O2 固体混合物中含有的阴、阳离子总数是 3NA D.1L2mol/L 的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于 2NA 4.如图所示装置中,U 型管内为红墨水,a、b 试管内分别盛有食盐水和氯化铵溶液,各加入 一块生铁块,放置一段时间。下列有关描述正确的是 A.生铁块中的碳是原电池的负极 B.红墨水柱两边的液面变为左低右高 C.两试管中相同的电极反应式是: Fe-2e-=Fe2+ D.a 试管中发生了析氢腐蚀,b 试管中发生了吸氧腐蚀 5.把下列溶液蒸干并灼烧最后能得到原溶液中溶质的是 A.氯化铁溶液 B.碳酸钠溶液 C.亚硫酸钠溶液 D.高锰酸钾溶液 6.下列图示与对应的叙述相符的是 A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 B.图乙表示 pH 相同的盐酸与氢氟酸分别加水稀释 PH 的变化,其中曲线 a 对应的是氢氟 酸 C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变 D.图丁表示向 Na2CO3 溶液中逐滴滴加稀盐酸,生成 CO2 与所加盐酸物质的量的关系 7.合成气(CO和 H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法: -1 ① CH4(g)+H2O(g) CO(g)+3H2(g) ΔH 1=+216 kJ·mol ; ② 2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH 2=-72 kJ·mol-1。 其中一个反应的反应过程与能量变化关系如图所示。 则下列说法正确的是() A.E 1 表示 2CH4(g)+O2(g) 2CO(g)+4H2(g)的活化能 B.E 2 表示 CH4(g)+H2O(g)CO(g)+3H2(g)的活化能 C.该图示为反应②的反应过程与能量变化示意图 A B C D D.一般情况下,加入催化剂,既能降低 E 1,也能降低 E 2,但不能改变 E 1 与 E 2 的差值 8.下列实验装置或操作正确的是 9.解释下列事实的方程式不正确的是 - + 2- A.NaHCO3 溶液显碱性原因: HCO3 +H2O=H3O +CO3 3+ 2+ 2+ B.用 FeCl3 溶液腐蚀印刷电路板上的铜:2Fe+Cu=2Fe+Cu C.盛装 NaOH 溶液试剂瓶不能用玻璃塞:2OH-+SiO =SiO 2-+H O 2 3 2 D.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的方铅矿 (PbS),慢慢转变为铜蓝(CuS): CuSO4+PbS=CuS+PbSO4 10.浓度和体积都相等的盐酸(甲)和醋酸(乙),分别与形状相同且足量的锌反应,下列说法正 确的是 A.反应所需时间:甲=乙 B.反应开始时的速率:甲=乙 C.反应结束所消耗的锌的质量:甲=乙 D.反应结束时的 pH 值:甲=乙 11.下列说法不正确的是 A.用灼烧的方法鉴别羊毛线和棉线 B.石油分馏时,温度计的水银球必须插入液面下 C.做银镜反应实验后,试管壁上的银镜用稀硝酸洗涤 D.纤维素和淀粉在硫酸的催化作用下最终水解产物相同 12.常温下,下列说法正确的是 + - -5 A.pH=5 的 H2S 溶液中,c(H )=c(HS )=1×10mol/L B.pH=12 的氨水加水稀释后溶液中所有离子浓度都减小 C.pH=2 的 HCl 溶液与 pH=13 的 NaOH 溶液按体积比 1:10 混合后溶液呈中性 D.c(Na+)相同的①CH COONa②NaHCO ③NaClO 三种溶液的 pH 大小:③>②>① 3 3 13.下列有关实验或做法合理有效的是 A.配制 FeSO4 溶液可加 Zn 粉防止溶液氧化变质 2 3 4 B.0.01mol/LKMnO4 和 0.1mol/LH2C2O4 的酸性溶液中加 MnSO4 能使溶液褪色时间变短 C 先加 BaCl 溶液再加稀 HNO 可检验溶液中是否含有 SO 2- 3+ D.可用 K3[Fe(CN)6]检验某溶液中是否含有 Fe 14.在恒温、恒容密闭容器中发生反应: A(s) +2B(g)C(g)+D(g),当下列物理量不再发生 变化时,表明该反应已达到平衡状态的是 ①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量 浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 A.②③⑤ B.①②③ C.②③④⑤ D.①③④⑤ 15.已知:2SO2(g) +O2(g)2SO3(g) △H =kJ·mol-1。现在一容积为 2 L 的密闭容 器中充入 2molSO2、1molO2,加入固体催化剂,保持温度在 450℃使之发生反应,5 min 时达 到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是 A. SO2 的转化率为 30% B.反应共放出了 196.6 kJ 的热量 C.用 SO2 表示的 5 min 内的平均反应速率为 0.36 mol·L-1·min-1 16.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.使酚酞呈红色的溶液: Na+、AlO -、NO -、CO 2- 2 3 3 B.由水电离产生的 c(H+)=10-12mol/L 的溶液: NH +、SO 2-、HCO -、Cl- 4 4 3 - + 3+ - - C .含有 0.1mol/LHCO3 的溶液: Na 、Fe、NO3 、SCN D .无色溶液: K+、Na+、MnO -、Cl- 17.下列有关物质的性质和应用均正确的是 A.氯化铝是强电解质,可电解熔融的氯化铝制铝 B.碳酸钠溶液显碱性,热的碳酸钠溶液可去除金属表面的油污 C.次氯酸钠具有强还原性,可用于配制“84”消毒液 D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 18.向体积为 Va 的 0.05 mol/L CH3COOH 溶液中加入体积为 Vb 的 0.05 mol/L KOH 溶液,下列 关系错误的是 - + A. Va>Vb 时:c(CH3COOH)+c(CH3COO )>c(K ) + - B. Va=Vb 时: c(CH3COOH)+c(H )=c(OH ) - + - + C. Va查看更多