- 2021-06-19 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学人教版选修三(学业分层测评)第三章 晶体结构与性质 学业分层测评10含解析
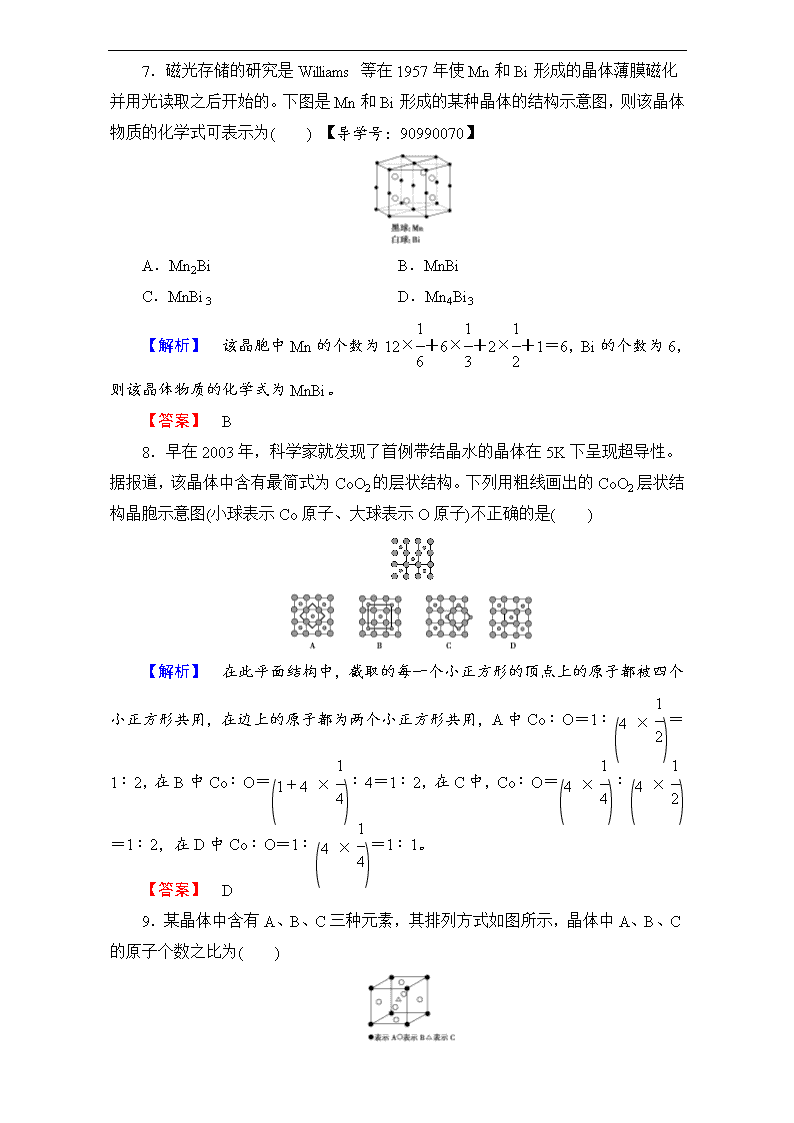
学业分层测评(十) 晶体的常识 (建议用时:45 分钟) [学业达标] 1.下列不属于晶体特点的是( ) A.一定有固定的几何外形 B.一定有各向异性 C.一定有固定的熔点 D.一定是无色透明的固体 【解析】 晶体的特点是有规则的几何外形(由晶体的自范性决定)、固定的熔 点及各向异性,但不一定是无色透明的固体,如紫黑色的碘晶体及蓝色的硫酸铜晶 体。 【答案】 D 2.下列关于晶体的说法正确的是( ) A.将饱和硫酸铜溶液降温,析出的固体不是晶体 B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品 C.石蜡和玻璃都是非晶体,但它们都有固定的熔点 D.蓝宝石在不同方向上的硬度一定相同 【解析】 将饱和 CuSO4 溶液降温,可析出胆矾,胆矾属于晶体,A 错误;一 般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无刻痕来鉴别,B 正确;非 晶体没有固定的熔点,C 错误;由于晶体的各向异性导致蓝宝石在不同方向上的硬 度有一些差异,D 错误。 【答案】 B 3.晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如 石墨在与层垂直的方向上的电导率是与层平行的方向上的电导率的 1 104。晶体的各向 异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 【解析】 晶体具有各向异性,常常表现在硬度、导热性、导电性、光学性质 等多项物理性质中。 【答案】 D 4.水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却 到 165 K 时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态 水的密度相同。有关玻璃态水的叙述正确的是( ) A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀 C.玻璃态是水的一种特殊状态 D.玻璃态水是一种晶体 【解析】 因为玻璃态水的密度与普通液态水的密度相同,所以水由液态变为 玻璃态,体积不变。因为玻璃态的水无固定形状,不存在晶体结构,所以不是一种 晶体,而是水的一种特殊状态。 【答案】 C 5.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻 璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是 ( ) A.是否是具有规则几何外形的固体 B.是否是具有固定组成的物质 C.是否是具有美观对称的外形 D.内部构成微粒是否在空间呈有规则的重复排列 【解析】 有规则几何外形或美观对称的固体不一定都是晶体,如玻璃;具有 固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。 晶体和非 晶体的本质区别在于微观结构不同。 【答案】 D 6.某离子化合物的晶胞如图所示。阳离子位于晶胞的中心,阴离子位于晶胞 的 8 个顶角上,则该离子化合物中阴、阳离子的个数比为( ) A.1∶8 B.1∶4 C.1∶2 D.1∶1 【解析】 阴离子位于晶胞的 8 个顶角,个数为 8×1 8 =1,阳离子位于晶胞的 中心,个数为 1。 【答案】 D 7.磁光存储的研究是 Williams 等在 1957 年使 Mn 和 Bi 形成的晶体薄膜磁化 并用光读取之后开始的。下图是 Mn 和 Bi 形成的某种晶体的结构示意图,则该晶体 物质的化学式可表示为( ) 【导学号:90990070】 A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3 【解析】 该晶胞中 Mn 的个数为 12×1 6 +6×1 3 +2×1 2 +1=6,Bi 的个数为 6, 则该晶体物质的化学式为 MnBi。 【答案】 B 8.早在 2003 年,科学家就发现了首例带结晶水的晶体在 5K 下呈现超导性。 据报道,该晶体中含有最简式为 CoO2 的层状结构。下列用粗线画出的 CoO2 层状结 构晶胞示意图(小球表示 Co 原子、大球表示 O 原子)不正确的是( ) 【解析】 在此平面结构中,截取的每一个小正方形的顶点上的原子都被四个 小正方形共用,在边上的原子都为两个小正方形共用,A 中 Co∶O=1∶(4 × 1 2)= 1∶2,在 B 中 Co∶O=(1+4 × 1 4)∶4=1∶2,在 C 中,Co∶O=(4 × 1 4)∶(4 × 1 2) =1∶2,在 D 中 Co∶O=1∶(4 × 1 4)=1∶1。 【答案】 D 9.某晶体中含有 A、B、C 三种元素,其排列方式如图所示,晶体中 A、B、C 的原子个数之比为( ) A.1∶3∶1 B.2∶3∶1 C.8∶6∶1 D.4∶3∶1 【解析】 N(A)=8×1 8 =1,N(B)=6×1 2 =3,N(C)=1,则晶体中 A、B、C 的 原子个数之比为 1∶3∶1。 【答案】 A 10.根据所学知识填空: (1)在下列物质中,属于晶体的是________,属于非晶体的是________; A.玻璃 B.雪花 C.橡胶 D.铁块 E.单晶 硅 F.沥青 (2)晶体中的微粒与晶胞的关系为: ①凡处于立方体顶角的微粒,同时为________个晶胞共有; ②凡处于立方体棱上的微粒,同时为________个晶胞共有; ③凡处于立方体面上的微粒,同时为________个晶胞共有; ④凡处于立方体体心的微粒,同时为________个晶胞共有。 【解析】 (1)晶体具有固定的熔点,雪花就是冰,有固定的熔点;铁块和单晶 硅都有固定的熔点;橡胶、玻璃、沥青(烃的混合物)没有固定的熔点,都属于非晶 体。(2)分析晶体中的微粒与晶胞的关系,关键是看该微粒为几个晶胞所围绕,就为 几个晶胞所共有。 【答案】 (1)B、D、E A、C、F (2)8 4 2 1 11.下图所示为热敏电阻 PTC 元件的主要成分的晶体结构,该结构是具有代表 性的最小重复单位。该晶体经 X 射线分析鉴定,重复单位为正方体,边长为 403.1 pm, 顶角位置为 B 原子所占,体心位置为 C 原子所占,所有棱的中点位置为 A 所占。 据图回答下列问题: 【导学号:90990071】 (1)若将 B 置于晶胞的体心,C 置于晶胞的顶点,则 A 处于立方体的什么位置? ________。 (2)在该物质的晶体中,每个 B 周围与它最邻近且距离相等的 B 有________个, 它们在空间呈________形状分布。 【解析】 (1)由原图可以看出它的化学式为 BCA3,当 B 位于晶胞的体心,C 位于晶胞的顶角时,要求化学式不变,则 A 的位置有两种可能,即在面心或棱的中 点。由原图可以看出,在每个 B 的周围和它等距离且最近的 A 有 6 个(距离为棱长 的一半);如果在棱的中点,则和它等距离且最近的 A 有 12 个(距离为面对角线的一 半),故只有 A 处于立方体的面心时才与原图相符。(2)由原图可以看出,在每个 B 的周围和它等距离且最近的 B 有 6 个,这 6 个 B 在空间构成了正八面体。 【答案】 (1)面心 (2)6 正八面体 12.某晶体的晶胞结构如右图所示。X(● )位于立方体顶角,Y()位于立方体 中心。试分析: (1)晶体中每一个 Y 同时吸引着______个 X,每个 X 同时吸引着______个 Y, 该晶体的化学式是________________。 (2)晶体中在每个 X 周围与它最接近且距离相等的 X 共有________个。 (3)晶体中距离最近的 2 个 X 与 1 个 Y 形成的夹角∠XYX 为__________。 【解析】 (2)晶体中每个 X 周围与它最接近的 X 之间的距离应为 右图所示立方体的面对角线。位置关系分为在此 X 的上层、下层和同一 层,每层均有 4 个,共有 12 个。(3)若将 4 个 X 连接,构成 1 个正四面体,Y 位于 正四面体的中心(如图),可联系 CH4 的键角,则∠XYX=109°28′。 【答案】 (1)4 8 XY2(或 Y2X) (2)12 (3)109°28′ [能力提升] 13.硼化镁在 39 K 时呈超导性,成为人类对超导认识的里程碑。在硼化镁晶 体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,Ⅰ图 是该晶体微观空间中取出的部分原子沿 Z 轴方向的投影,白球是镁原子投影,黑球 是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的 化学式为( ) A.MgB B.MgB2 C.Mg2B D.MgB6 【解析】 法一:由图Ⅰ中的平面结构可以找出最小的重复单元(如图Ⅱ所示), 有两种结构,在三角形结构中,每个镁原子为 6 个小三角形共用,故 Mg∶B= (3 × 1 6)∶1=1∶2;在六边形结构中,每个 B 原子为三个小六边形共用,故 Mg∶B =1∶(6 × 1 3)=1∶2,故化学式为 MgB2。 法二:将此平面结构还原成立体结构(如图Ⅲ所示),由此图可知,Mg 在顶角以 及上下底面的中心,B 原子在六棱柱内,故 Mg∶B=(12 × 1 6+2 × 1 2)∶6=1∶2。 【答案】 B 14.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为 0 价,部 分为-2 价,右图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说 法正确的是( ) 【导学号:90990072】 A.超氧化钾的化学式为 KO2,每个晶胞含有 14 个 K+和 13 个 O-2 B.晶体中每个 K+周围有 8 个 O-2 ,每个 O -2 周围有 8 个 K+ C.晶体中与每个 K+距离最近的 K+有 12 个 D.晶体中,所有原子之间都是离子键 【解析】 超氧化钾是离子化合物,阴、阳离子分别是 O -2 和 K+,两者之间 是离子键,而 O -2 中 O—O 键为非极性共价键,D 错误;每个晶胞中含有 K+的个 数=8×1 8 +6×1 2 =4 个,而 O -2 的个数=1+12×1 4 =4 个,A 错误;从晶胞的结构可 知,每个 K+的周围有 6 个 O-2 ,当然每个 O -2 周围也有 6 个 K+,晶体中与每个 K+ 最近的 K+有 12 个,因此 B 错误,C 正确。 【答案】 C 15.纳米材料的表面微粒数占总微粒数的比例极大,这是它有许多特殊性质的原 因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图 所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为( ) A.7∶8 B.13∶14 C.25∶26 D.26∶27 【解析】 表面微粒数=8+6+12=26。总微粒数=表面微粒数+中心粒子数 =26+1=27。 【答案】 D 16.回答下列问题: (1)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶角,Ba2+处 于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为________,每个 Ba2+与 ________个 O2-配位。 (2)X、Y、Z 可形成立方晶体结构的化合物,其晶胞中 X 占据所有棱的中心,Y 位于顶点,Z 处于体心位置,则该晶体的组成为 X∶Y∶Z=________。 (3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如 I 所示。该合金的化学式为________。 (4)葡萄糖与新制 Cu(OH)2 的碱性溶液反应生成砖红色 Cu2O 沉淀。在 1 个 Cu2O 晶胞中(结构如图Ⅱ所示),所包含的 Cu 原子数目为________;每个氧原子与 ________个铜原子配位。 (5)硒化铷晶体晶胞结构如图Ⅲ所示。每个晶胞中包含________个 Rb2Se 单元, 其中 Se2-周围与它距离最近且相等的 Rb+的离子数目为________。 (6)MgH2 是金属氢化物储氢材料,其晶胞结构如图Ⅳ所示,已知该晶体的密度 为 a g·cm-3,则晶胞的体积为________cm3(用 a、NA 表示,其中 NA 表示阿伏加德 罗常数)。 【解析】 (1)每个晶胞含有 Pb4+:8×1 8 =1 个,Ba2+:1 个,O2-:12×1 4 =3 个,故化学式为 PbBaO3。Ba2+处于晶胞中心,只有 1 个,O2-处于晶胞棱边中心, 共 12 个,故每个 Ba2+与 12 个 O2-配位。 (2)在晶胞中 12 条棱上有 12 个 X,每个 X 被四个晶胞共用,平均分在每个晶胞 中的 X 有 3 个。每个晶胞的 8 个顶角上有 8 个 Y,每个 Y 被 8 个晶胞共用,平均 分在每个晶胞中的 Y 只有 1 个,Z 完全属于其中的一个晶胞,故该晶体的组成 X∶Y∶Z=3∶1∶1。 (3)每个晶胞中含有 La 为 8×1 8 =1 个,Ni 为 1+8×1 2 =5 个,该合金的化学式 为 LaNi5。 (4)图Ⅱ中每个晶胞中含有黑球代表的微粒为 4 个,白球代表的微粒为 1+8×1 8 =2 个,由组成 Cu2O 知黑球代表 Cu 原子,白球代表氧原子,每个氧原子(白球)周 围有 4 个 Cu 原子(黑球)。 (5)每个晶胞中含有 Rb+8 个,即白球 8 个,每个晶胞中含有 Se2-:6×1 2 +8×1 8 =4(个),即黑球 4 个,所以每个晶胞中含有 4 个 Rb2Se 单元,Se2-周围与它距离最 近且相等的 Rb+的离子数目为 8 个。 (6)先计算出晶胞的质量,再根据密度即可求出晶胞的体积。晶胞中含有 MgH2 微粒数为 2 个,晶胞的质量 m=26 NA×2=52 NA(g),由 m=ρV 得 V=m ρ = 52 NAa(cm3)。 【答案】 (1)PbBaO3 12 (2)3∶1∶1 (3)LaNi5 (4)4 4 (5)4 8 (6) 52 aNA查看更多