2018届二轮复习非金属及其化合物课件(78张)(全国通用)
专题十 非金属及其化合物
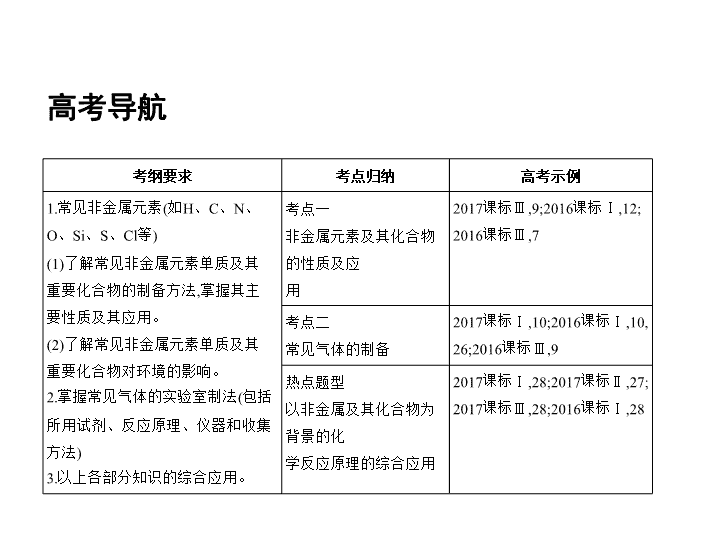
高考导航
考纲要求
考点归纳
高考示例
1.常见非金属元素(如H、C、N、
O、Si、S、Cl等)
(1)了解常见非金属元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。
(2)了解常见非金属元素单质及其重要化合物对环境的影响。
2.掌握常见气体的实验室制法(包括所用试剂、反应原理、仪器和收集方法)
3.以上各部分知识的综合应用。
考点一 非金属元素及其化合物的性质及应
用
2017课标Ⅲ,9;2016课标Ⅰ,12;
2016课标Ⅲ,7
考点二 常见气体的制备
2017课标Ⅰ,10;2016课标Ⅰ,10,26;2016课标Ⅲ,9
热点题型 以非金属及其化合物为背景的化
学反应原理的综合应用
2017课标Ⅰ,28;2017课标Ⅱ,27;
2017课标Ⅲ,28;2016课标Ⅰ,28
总纲目录
考点一 非金属元素及其化合物的性质及应用
考点二 常见气体的制备
热点题型突破
8
以非金属及其化合物为背景的化学反应原理的综合应用
考点一 非金属元素及其化合物的性质及应用
主干回扣
1.常见非金属元素及其化合物的性质
(1)有颜色的气体:
(黄绿色)、
(红棕色)等。
(2)有漂白作用的气体:Cl
2
(有水时)、SO
2
等,能使品红溶液褪色,加热后
恢复原色的是
。
(3)同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水,
该元素可能是
或
。
(4)同一元素的气态氢化物和最高价氧化物对应的水化物发生化合反
应,生成盐的元素一定是
。
(5)溶于水显碱性的气体只有
。
(6)在空气中迅速由无色变为红棕色的气体只有
。
(7)可溶于氢氟酸的酸性氧化物只有
。
(8)能与NaOH溶液作用产生H
2
的非金属单质只有
。
(9)常温下使铁、铝发生钝化的是
与
。
答案 (1)Cl
2
NO
2
(2)SO
2
(3)S N (4)N
(5)NH
3
(6)NO (7)SiO
2
(8)Si (9)浓硫酸 浓硝酸
2.常见物质的用途
硅——半导体材料、太阳能电池板、计算机芯片
活性炭——吸附剂、去除冰箱中的异味
臭氧(O
3
)——漂白剂、消毒剂
氯气——杀菌消毒、制盐酸、制漂白粉等
二氧化碳——灭火剂、用于人工降雨、用作气体肥料
二氧化硅——制石英玻璃、光导纤维
二氧化硫——漂白剂、杀菌消毒
双氧水——漂白剂、消毒剂、脱氧剂
氢氟酸——蚀刻玻璃制品
氨——制冷剂(液氨),制硝酸、铵盐
次氯酸钠(NaClO)——漂白剂、杀菌剂
硅胶——袋装食品干燥剂
3.非金属及其化合物之间的相互转化
(1)碳、硅及其化合物
写出下列转化的化学方程式或离子方程式:
①SiO
2
→Si:
;
②HC
→C
:
;
③Si
→H
2
SiO
3
:
。
写出下列转化的化学方程式:
①NH
3
→NO:
;
②NO
2
→NO:
;
③HNO
3
→NO:
。
(3)硫及其化合物
写出下列反应的化学方程式:
①SO
2
S:
;
②SO
2
H
2
SO
4
:
。
(2)氮及其化合物
(4)卤素单质及其化合物
写出图中标号反应的离子方程式:
①
;
②
;
③
;
④
。
答案 (1)①SiO
2
+2C
Si+2CO↑
②HC
+OH
-
C
+H
2
O
③Si
+2H
+
H
2
SiO
3
↓(合理即可)
(2)①4NH
3
+5O
2
4NO+6H
2
O
②3NO
2
+H
2
O
2HNO
3
+NO
③3Cu+8HNO
3
(稀)
3Cu(NO
3
)
2
+2NO↑+4H
2
O(合理即可)
(3)①2H
2
S+SO
2
3S↓+2H
2
O
②SO
2
+Cl
2
+2H
2
O
H
2
SO
4
+2HCl
(4)①Cl
2
+H
2
O
H
+
+Cl
-
+HClO
②Cl
2
+2Br
-
2Cl
-
+Br
2
③Br
2
+2I
-
I
2
+2Br
-
④Cl
2
+2OH
-
Cl
-
+ClO
-
+H
2
O
典题精练
题组一 非金属及其化合物的性质及应用
1.(2017江苏单科,3)下列有关物质性质与用途具有对应关系的是
( )
A.Na
2
O
2
吸收CO
2
产生O
2
,可用作呼吸面具供氧剂
B.ClO
2
具有还原性,可用于自来水的杀菌消毒
C.SiO
2
硬度大,可用于制造光导纤维
D.NH
3
易溶于水,可用作制冷剂
答案 A B项,ClO
2
具有很强的氧化性,可用于杀菌消毒;C项,SiO
2
用于
制造光导纤维与其硬度大无关;D项,NH
3
用作制冷剂是因为其易液化,液
氨汽化时会吸收大量的热,使周围温度降低。
2.用如图所示装置进行下列实验,实验结果与预测的现象不一致的是
( )
选项
①中的物质
②中的物质
预测装置中现象
A
NO
2
蒸馏水
试管中充满无色溶液
B
SO
2
紫色石蕊溶液
溶液逐渐变为红色
C
NH
3
AlCl
3
溶液
产生白色沉淀
D
Cl
2
AgNO
3
溶液
产生白色沉淀
答案 A A项,3NO
2
+H
2
O
2HNO
3
+NO,所以理论上液体充满试管
容积的
,错误;B项,SO
2
溶于水生成的H
2
SO
3
显酸性,可使紫色石蕊溶液
变红,正确;C项,Al(OH)
3
只能溶于强碱性溶液,不能溶于氨水,正确;D项,
Cl
2
溶于水后生成的Cl
-
与Ag
+
结合形成AgCl白色沉淀,正确。
3.(2017东北三省四市二模,10)下列有关实验操作、实验现象和所得结
论正确的是
( )
选项
实验操作
实验现象
结论
A
将SO
2
通入溴水中
溴水颜色褪去
SO
2
具有漂白性
B
将铁屑放入稀HNO
3
中
放出无色气体
Fe比H
2
活泼
C
将澄清石灰水滴入某溶液中
生成白色沉淀
溶液中存在C
D
将乙烯通入KMnO
4
酸性溶液中
溶液颜色褪去
乙烯具有还原性
答案 D A项,SO
2
使溴水褪色,体现了SO
2
的还原性;B项,铁屑与稀硝酸
反应放出NO,无法用于比较Fe与H
2
的活泼性;C项,能使澄清石灰水变浑
浊的溶液中不一定含有C
,可能含有S
、 HC
、 HS
等。
4.(2017江苏单科,7)在给定条件下,下列选项所示的物质间转化均能实
现的是
( )
A.Fe
FeCl
2
Fe(OH)
2
B.S
SO
3
H
2
SO
4
C.CaCO
3
CaO
CaSiO
3
D.NH
3
NO HNO
3
题组二 非金属单质及其化合物的相互转化
答案 C A项,铁在Cl
2
中燃烧只能生成FeCl
3
;B项,硫与O
2
反应生成SO
2
;
C项,CaCO
3
在高温条件下分解生成CaO和CO
2
,CaO与SiO
2
在高温条件下
化合生成CaSiO
3
,即CaCO
3
CaO+CO
2
↑,CaO+SiO
2
CaSiO
3
;D项,
NH
3
与O
2
在催化剂、加热条件下发生反应生成NO,NO不与水反应。
5.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们
之间具有如下转化关系:甲 乙
丙。下列有关物质的推断不正确
的是
( )
A.若甲为氮气,则丁可能是O
2
B.若甲为AlCl
3
溶液,则丁可能是NaOH溶液
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO
2
答案 A 若甲为N
2
,丁为O
2
,则乙为NO,丙为NO
2
,NO
2
与N
2
不反应,A项
错误;若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙为氢氧化铝,丙为偏铝
酸钠溶液,偏铝酸钠溶液与氯化铝溶液反应可生成氢氧化铝,B项正确;
若甲为铁,丁为稀硝酸,则乙为硝酸亚铁,丙为硝酸铁,硝酸铁与铁反应可
生成硝酸亚铁,C项正确;若甲为氢氧化钠溶液,丁为CO
2
,则乙为碳酸钠,
丙为碳酸氢钠,碳酸氢钠与氢氧化钠反应可生成碳酸钠,D项正确。
归纳总结 常见非金属单质及其化合物的转化关系
(1)连续转化
①N
2
(NH
3
)
NO
NO
2
HNO
3
②S(H
2
S)
SO
2
SO
3
H
2
SO
4
③C(或烃或烃的含氧衍生物)
CO
CO
2
H
2
CO
3
(2)三角转化
题组三 无机框图推断
6.(2017河南百校联盟3月联考,13)短周期主族元素W、X、Y、Z的原子
序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元
素Z、W、X、Y的气体单质,p和s均为有色气体,v的水溶液呈碱性。常
温下,0.1 mol/L t溶液与0.1 mol/L u溶液的pH 均为1。下列说法正确的
是
( )
A.原子半径:X
Y>W
C.v能分别与u、t反应生成离子化合物
D.Z的氧化物对应的水化物均为强酸
答案 C 根据题中信息及各物质的转化关系可知,p为Cl
2
,q为H
2
,m为
N
2
,n为O
2
,故W、X、Y、Z依次是H、N、O、Cl。A项,原子半径应为O<
NN>H,错误;C项,NH
3
分别
与HCl、HNO
3
反应生成NH
4
Cl、NH
4
NO
3
,NH
4
Cl、NH
4
NO
3
均为离子化
合物,正确;D项,如Cl
2
O对应的水化物是HClO,HClO为弱酸,故D错误。
7.在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子
质量大16,E是强酸,当X无论是强酸还是强碱时,都有如下的转化关系:
A
B
C
D
E
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、
C、D、E均含另外一种元素。请回答:
(1)A是
,Y是
,Z是
(填化学式,下同)。
(2)当X是强酸时,E是
,写出B生成C的化学方程式:
。
(3)当X是强碱时,E是
,写出B生成C的化学方程式:
。
答案 (1)(NH
4
)
2
S O
2
H
2
O
(2)H
2
SO
4
2H
2
S+3O
2
2SO
2
+2H
2
O
(3)HNO
3
4NH
3
+5O
2
4NO+6H
2
O
解析 A既能和强酸反应又能和强碱反应,且A是正盐,可推出A可能是
(NH
4
)
2
CO
3
或(NH
4
)
2
S或(NH
4
)
2
SO
3
等;又根据B
C
D
E,且C、D
的相对分子质量相差16,E为强酸,推出A是(NH
4
)
2
S;若X是强酸,则E为
H
2
SO
4
;若X是强碱,则E是HNO
3
。
考点二 常见气体的制备
主干回扣
1.巧用“神奇装置”制备以下气体,并写出反应的化学方程式。
(1)NH
3
:浓氨水—生石灰
;
(2)Cl
2
:KMnO
4
—浓盐酸
;
(3)O
2
:MnO
2
—H
2
O
2
(或Na
2
O
2
—H
2
O)
;
(4)NO
2
:Cu—浓硝酸
;
(5)NO:Cu—稀硝酸
;
(6)CO
2
:CaCO
3
—稀盐酸
;
(7)H
2
:Zn—稀硫酸
。
答案 (1)CaO+H
2
O
Ca(OH)
2
、NH
3
·H
2
O
NH
3
↑+H
2
O
(2)2KMnO
4
+16HCl(浓)
2KCl+2MnCl
2
+5Cl
2
↑+8H
2
O
(3)2H
2
O
2
2H
2
O+O
2
↑(或2Na
2
O
2
+2H
2
O
4NaOH+O
2
↑)
(4)Cu+4HNO
3
(浓)
Cu(NO
3
)
2
+2NO
2
↑+2H
2
O
(5)3Cu+8HNO
3
(稀)
3Cu(NO
3
)
2
+2NO↑+4H
2
O
(6)CaCO
3
+2HCl
CaCl
2
+H
2
O+CO
2
↑
(7)Zn+H
2
SO
4
(稀)
ZnSO
4
+H
2
↑
2.巧组制气装置,回答下列问题。
(1)实验室用MnO
2
和浓盐酸制取Cl
2
,选用的发生装置为
,反应
的离子方程式为
;若选用C装置制
取Cl
2
,锥形瓶中的固体物质是
(填化学式)。
(2)实验室用Na
2
SO
3
与较浓的H
2
SO
4
制取SO
2
,选用的发生装置为
,收集装置可用
,反应的化学方程式为
。
(3)实验室用氯化铵与熟石灰两种固体加热制取氨气,氨气的密度比空
气的小,极易溶于水。推断:实验室制取氨气应选用的发生装置为
,收集装置为
;反应的化学方程式为
;用C装置可以快速制取氨气,所用的试剂是
。
答案 (1)B MnO
2
+4H
+
+2Cl
-
Mn
2+
+Cl
2
↑+2H
2
O KMnO
4
(2)C E Na
2
SO
3
+H
2
SO
4
Na
2
SO
4
+SO
2
↑+H
2
O
(3)A F 2NH
4
Cl+Ca(OH)
2
CaCl
2
+2NH
3
↑+2H
2
O
浓氨水、生石灰(合理即可)
3.(1)除去Cl
2
中的HCl,用
;
(2)除去CO
2
中的HCl,用
;
(3)除去SO
2
中的HCl,用
。
答案 (1)饱和食盐水 (2)饱和NaHCO
3
溶液
(3)饱和NaHSO
3
溶液
4.(1)Cl
2
、SO
2
、NO
2
等有毒气体常用
吸收;
(2)HCl、NH
3
等易溶于水的气体用
吸收,但要防止倒吸。
(3)CO常用
法处理。
答案 (1)NaOH溶液 (2)水 (3)燃烧
1.利用如图所示装置进行下列实验,能得出相应实验结论的是
( )
典题精练
选项
①
②
③
实验结论
A
浓盐酸
CaCO
3
Na
2
SiO
3
溶液
非金属性:Cl>C>Si
B
浓硫酸
Na
2
SO
3
Ba(NO
3
)
2
溶液
验证SO
2
与可溶性钡盐可
生成白色沉淀
C
浓氨水
生石灰
酚酞溶液
氨气的水溶液呈碱性
D
浓硝酸
Fe
NaOH溶液
铁和浓硝酸反应可生成NO
2
答案 C 浓盐酸易挥发,挥发出的HCl能够与硅酸钠反应生成硅酸沉
淀,且HCl不是Cl元素的最高价含氧酸,故不能得出Cl、C、Si的非金属
性强弱,A错误;SO
2
通入硝酸钡溶液中,溶液显酸性,N
在酸性条件下能
把SO
2
氧化为S
,进而生成BaSO
4
白色沉淀,而SO
2
与BaCl
2
溶液不反应,
B错误;浓氨水与生石灰反应生成氨气,氨气溶于水所得溶液显碱性,可
使酚酞溶液变红,C正确;常温下浓硝酸能使Fe发生钝化,D错误。
2.(2017江苏单科,4)下列制取SO
2
、验证其漂白性、收集并进行尾气处
理的装置和原理能达到实验目的的是
( )
答案 B A项,制取SO
2
应用Cu和浓H
2
SO
4
,错误;B项,SO
2
能使品红溶液
褪色,可用品红溶液验证SO
2
的漂白性,正确;C项,收集SO
2
应用向上排空
气法,错误;D项,尾气处理时,应用NaOH溶液吸收,且要防止倒吸,错误。
3.(2017青海海东二次联考,26)某同学在实验室中对SO
2
、Cl
2
的混合气
体在水中发生的反应进行了探究。回答下列问题:
(1)氯气的发生装置可以选择图中的
(填序号),反应的化学方
程式为
。
(2)欲收集一瓶干燥的氯气,选择图中的装置,其连接顺序为:发生装置→
(用小写字母表示,装置不可重复使用)。
(3)实验室用亚硫酸钠粉末和硫酸反应制取二氧化硫,现有下列三种硫
酸,应选用
(填序号),理由是
。
A.98%浓硫酸 B.70%硫酸 C.10%稀硫酸
(4)该同学设计了如图所示的实验装置探究将SO
2
、Cl
2
同时通入水中发
生的反应。
①H装置中主要反应的离子方程式为
,I仪器的作用是
。
②为了验证通入H装置中的气体是Cl
2
过量还是SO
2
过量,可以取适量H
中溶液于洁净的试管中,向其中加入
,写出后续实验必要的
操作和结论
。
③若H中Cl
2
和SO
2
恰好完全反应,为了检验溶液中的阴离子,补充完整实
验操作,并写出结论:取少量H中溶液于洁净的试管中,
。
答案 (1)A(或B) 2KMnO
4
+16HCl(浓)
2MnCl
2
+2KCl+5Cl
2
↑+8H
2
O
[或MnO
2
+4HCl(浓)
MnCl
2
+Cl
2
↑+2H
2
O]
(2)ijghefk
(3)B 98%的浓硫酸中H
+
浓度小,不易与亚硫酸钠粉末反应;10%稀硫酸
中H
+
浓度小,不利于SO
2
放出
(4)①Cl
2
+SO
2
+2H
2
O
4H
+
+2Cl
-
+S
防倒吸
②品红溶液 品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复
原,说明二氧化硫过量
③向其中加入过量稀硝酸酸化的Ba(NO
3
)
2
溶液,产生白色沉淀,则含有
S
,过滤后取少量滤液,加入稀硝酸酸化的AgNO
3
溶液,产生白色沉淀,
则含有Cl
-
解析 (1)实验室可用KMnO
4
和浓盐酸或MnO
2
和浓盐酸反应制取氯
气。(2)浓盐酸易挥发,制取的Cl
2
中含有HCl、水蒸气,欲收集一瓶干燥
的氯气,应先通过饱和食盐水除去HCl,再通过浓硫酸除去水蒸气,然后
选择向上排空气法收集,最后用NaOH溶液吸收多余的Cl
2
。(3)硫酸和亚
硫酸钠粉末反应制取二氧化硫时,若硫酸浓度过大,则硫酸电离出的H
+
很少,很难反应生成SO
2
;若硫酸浓度很小,则不利于二氧化硫逸出,所以
应选取70%硫酸。(4)①H装置中主要反应的离子方程式为Cl
2
+SO
2
+
2H
2
O
4H
+
+2Cl
-
+S
;SO
2
易溶于水,I仪器的作用是防倒吸。②根据
HClO的漂白不可逆,而SO
2
的漂白可逆来检验Cl
2
过量还是SO
2
过量:取适
量H中的溶液于洁净的试管中,向其中加入品红溶液,若品红褪色,加热
不复原,说明氯气过量;若品红褪色,加热又复原,说明二氧化硫过量。③
若H中Cl
2
和SO
2
恰好完全反应,则溶液中的阴离子为Cl
-
、S
,为防止干
扰,要先检验S
,后检验Cl
-
。
规律总结 气体制取与性质实验的解题流程
热点题型突破8 以非金属及其化合物为背景的化学反应原理的综合应用
题型特点
以非金属元素的单质及其化合物的性质为载体,考查原子结构、陌
生化学方程式的书写、热化学、电化学、反应速率和化学平衡、电解
质溶液中的离子平衡、化学实验基础等知识的综合应用。
典例
(2017
河北唐山二模
,28)
现代煤化工产生的
H
2
S
是一种重要的工
业资源。请回答
:
(1)
用过量的
NaOH
溶液吸收
H
2
S,
请写出该反应的离子方程式
:
。硫化钠又称臭碱
,
其溶液盛装在带橡胶塞的试剂瓶
中
,
请用离子方程式解释其溶液呈碱性的原因
:
。已知:25 ℃时,H
2
S的
=1
×
10
-7
,
=1
×
10
-12
,计算此温度时1 mol/L
Na
2
S溶液的pH约为
(结果取整数)。
(2)用电解法处理Na
2
S溶液是处理硫化氢废气的一个重要环节。实验装
置如图:
已知:阳极的电极反应式为
x
S
2-
-2(
x
-1)e
-
,则阴极的电极反应式是
,当反应转移
n
mol e
-
时,产生标准状况下的气
体体积为
。
(3)H
2
S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H
2
(g)
H
2
S(g)+CO(g) Δ
H
=+7 kJ/mol
②CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g) Δ
H
=-42 kJ/mol
已知断裂1 mol气态分子中的化学键所需能量如下表所示。
分子
COS
H
2
H
2
O
CO
H
2
S
CO
2
能量(kJ/mol)
1 323
436
926
x
678
1 606
计算表中
x
=
。
(4)向2 L容积不变的密闭容器中充入2 mol COS(g)、2 mol H
2
(g)和2 mol
H
2
O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平
衡体积分数增大,解释其原因:
。
平衡体系中COS的物质的量为1.6 mol时,CO的体积分数为5%,则H
2
O的
平衡转化率为
,反应②的平衡常数为
(保
留两位有效数字)。
破题关键 (1)在计算时,要学会近似处理,
c
(OH
-
)与
c
(HS
-
)近似相等,
c
(S
2-
)
近似等于1 mol/L;(4)计算转化率和平衡常数时,须用“三段式”法。
答案 (1)H
2
S+2OH
-
S
2-
+2H
2
O S
2-
+H
2
O
HS
-
+OH
-
13
(2)2H
2
O+2e
-
2OH
-
+H
2
↑ 11.2
n
L
(3)1 074
(4)反应①为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增
大;反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也
增大 5% 0.30
解析 (1)1 mol/L Na
2
S溶液中存在 S
2-
+H
2
O
HS
-
+OH
-
,其中
c
(S
2-
)
≈
1 mol/L,
c
(HS
-
)
≈
c
(OH
-
),所以
K
h
=
K
W
/
=1
×
10
-14
/1
×
10
-12
=
≈
c
2
(OH
-
),则
c
(OH
-
)
≈
0.1 mol/L,pH
≈
13。
(2)当反应转移
n
mol e
-
时,生成氢气的物质的量为0.5
n
mol,在标准状况
下的体积为0.5
n
mol
×
22.4 L/mol=11.2
n
L。
(3)根据COS(g)+H
2
(g)
H
2
S(g)+CO(g) Δ
H
=+7 kJ/mol可得1 323+436
-678-
x
=+7,则
x
=1 074。
(4) COS(g)+H
2
(g)
H
2
S(g)+CO(g)
起始(mol) 2 2 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡(mol) 1.6 1.6 0.4 0.4
CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g)
起始(mol) 0.4 2 0 1.6
转化(mol)
n
n
n
n
平衡(mol) 0.4-
n
2-
n
n
1.6+
n
CO的体积分数为
×
100%=5%,解得
n
=0.1,则H
2
O的平衡转化率为
×
100%=5%;反应②的平衡常数
K
=
≈
0.30。
题组集训
1.硫的化合物丰富多彩,且都有一定的用途。
(1)用于橡胶工业的硫化剂S
2
Cl
2
的分子结构中每个原子均满足8电子稳
定结构,S
2
Cl
2
的电子式为
。S
2
Cl
2
遇水很容易发生反应
生成一种淡黄色固体和两种气体,该反应的化学方程式为
。
(2)用作氧化剂的过二硫酸铵[(NH
4
)
2
S
2
O
8
]属于离子化合物,易溶于水,其
可以硫酸铵[(NH
4
)
2
SO
4
]为原料制备。
①(NH
4
)
2
SO
4
溶液呈酸性的原因是
(用离子方程式表示),(NH
4
)
2
SO
4
溶液中各种离子的浓度由大到小的顺
序为
。
②若硫酸铵溶液的浓度为250 g·L
-1
,其溶质的物质的量浓度是
mol·L
-1
。
③(NH
4
)
2
S
2
O
8
在Ag
+
的催化作用下能将Mn
2+
氧化成Mn
,反应的离子方
程式为
。
(3)Na
2
S
2
O
4
在空气分析中常用来吸收氧气,当吸收氧气、水蒸气时,若还
原剂和氧化剂的物质的量之比为1∶1,则产物为
(填化学式)。
答案 (1) 2S
2
Cl
2
+2H
2
O
4HCl↑+SO
2
↑+3S↓
(2)①N
+H
2
O
NH
3
·H
2
O+H
+
c
(N
)>
c
(S
)>
c
(H
+
)>
c
(OH
-
)
②1.89 ③2Mn
2+
+5S
2
+8H
2
O
2Mn
+10S
+16H
+
(3)NaHSO
4
和NaHSO
3
解析 (1)S
2
Cl
2
的结构式为Cl—S—S—Cl,电子式为
;由题意可知S
2
Cl
2
与H
2
O反应生成S、HCl、SO
2
,化学方程式为2S
2
Cl
2
+2H
2
O
4HCl↑+SO
2
↑+3S↓。(2)①N
水解而使(NH
4
)
2
SO
4
溶液呈酸性,
水解方程式为N
+H
2
O
NH
3
·H
2
O+H
+
;(NH
4
)
2
SO
4
水解很微弱,则
c
(N
)>
c
(S
)>
c
(H
+
)>
c
(OH
-
)。②
c
=[250
÷
(18
×
2+32+16
×
4)]mol·L
-1
=1.89
mol·L
-1
。③根据得失电子守恒、电荷守恒及原子守恒可得离子方程式
2Mn
2+
+5S
2
+8H
2
O
2Mn
+10S
+16H
+
。(3)根据还原剂和氧化
剂的物质的量之比为1∶1可得反应的化学方程式为Na
2
S
2
O
4
+O
2
+H
2
O
NaHSO
4
+NaHSO
3
,则产物为NaHSO
4
和NaHSO
3
。
2.砷(
33
As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防
腐剂、染料和医药等领域及多种合金中。
(1)砷原子次外层上的电子数为
,砷化氢的电子式为
。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As
2
O
3
)的酒。As
2
O
3
是
两性偏酸性的氧化物,写出As
2
O
3
溶于浓盐酸的化学方程式
。
(3)As
2
O
3
溶于热水生成的亚砷酸(H
3
AsO
3
)具有较强的还原性,可用于治
疗白血病,其水溶液中存在多种微粒形态,各微粒的分布分数与溶液pH
的关系如下图:
①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式
为
。
②电离平衡常数
(H
3
AsO
3
)=
。
③Na
2
HAsO
3
溶液呈碱性,该溶液中
c
(H
2
As
)
c
(As
)(填“>”
“<”或“=”)。
④向含有HAs
的溶液中滴加氯水,反应的离子方程式为
。
答案 (1)18
(2)As
2
O
3
+6HCl
2AsCl
3
+3H
2
O
(3)①H
3
AsO
3
+OH
-
H
2
As
+H
2
O ②10
-9.2
③> ④HAs
+Cl
2
+H
2
O
H
3
AsO
4
+2Cl
-
解析 (1)砷与氮同主族,原子序数是33,最外层有5个电子,而K层、L层
最多分别只能排2、8个电子,故砷的原子结构示意图为
,则次外
层电子数是18;砷原子最外层有5个电子,可形成3个共价键,因此砷化氢
的电子式为
。
(2)类比Al
2
O
3
与盐酸的反应即可写出As
2
O
3
与盐酸的反应。
(3)①根据图示,pH=11时,溶液中存在的主要含砷微粒是H
2
As
,且亚砷
酸是弱酸,故反应的离子方程式为H
3
AsO
3
+OH
-
H
2
As
+H
2
O。
②
(H
3
AsO
3
)=
,结合图示可知pH=9.2时,
c
(H
2
As
)=
c
(H
3
AsO
3
),故
(H
3
AsO
3
)=10
-9.2
。
③Na
2
HAsO
3
溶液呈碱性,说明HAs
的水解大于电离,因此溶液中
c
(H
2
As
)>
c
(As
)。
④亚砷酸具有较强的还原性,能被氯水氧化生成H
3
AsO
4
,书写离子方程
式时,要注意H
3
AsO
4
是弱酸,应写成化学式。
3.氮的氢化物和氧化物及氰化物应用广泛。请回答下列问题:
(1)重要的氮的氢化物有氨和肼(N
2
H
4
),肼又叫联氨,可作为火箭发动机的
燃料,请用电子式表示肼的形成过程:
。
(2)氨是一种重要的化工原料,合成氨的原料气H
2
可以天然气为原料制
得,有关反应的能量变化如图所示。
则CH
4
(g)+H
2
O(g)
CO(g)+3H
2
(g) Δ
H
=
。
(3)将一定量的NO
2
气体充入一恒容绝热容器中,发生反应2NO
2
(g)
N
2
O
4
(g) Δ
H
<0,其相关图像如图所示。
①0~3 s时
v
(NO
2
)增大的原因是
。
②5 s时NO
2
转化率为
。
(4)KCN可用于溶解难溶金属卤化物,将AgCl溶于KCN溶液中,形成稳定
的Ag(CN
,该转化的离子方程式为
。
(5)常温下,肼为二元碱,在水中的电离方程式与氨相似,肼与磷酸形成的
酸式盐的化学式为
;肼第一步电离的方程式为
,该电离反应的平衡常数为
。(已
知:N
2
的水解常数
K
h
=1.15
×
10
-22
,
K
W
=1.0
×
10
-14
)
答案 (1)
(2)+171.1 kJ·mol
-1
(3)①容器为绝热体系,该反应正向进行放热,体系温度升高,
v
(NO
2
)增大
②75%
(4)AgCl+2CN
-
Ag(CN
+Cl
-
(5)N
2
H
6
(H
2
PO
4
)
2
和N
2
H
6
HPO
4
N
2
H
4
+H
2
O
N
2
+OH
-
8.70
×
10
7
解析 (1)肼的形成过程用电子式表示为 。
(2)分别根据图1、2、3可得热化学方程式:
CO(g)+
O
2
(g)
CO
2
(g) Δ
H
=-282.0 kJ·mol
-1
①
H
2
(g)+
O
2
(g)
H
2
O(g) Δ
H
=-241.8 kJ·mol
-1
②
CH
4
(g)+2O
2
(g)
CO
2
(g)+2H
2
O(g) Δ
H
=-836.3 kJ·mol
-1
③
由③-①-②
×
3可得:CH
4
(g)+H
2
O(g)
CO(g)+3H
2
(g) Δ
H
=+171.1 kJ·
mol
-1
。(3)①正反应是放热反应,在恒容绝热容器中,随反应进行温度升
高,反应速率增大;②5 s时二氧化氮的浓度变化了2.0 mol·L
-1
-0.5 mol·L
-1
=
1.5 mol·L
-1
,则其转化率为
×
100%=75%。(4)由题给信息可知,反应的
化学方程式为AgCl+2CN
-
Ag(CN
+Cl
-
。(5)肼与磷酸形成的酸式
盐有两种,化学式分别为N
2
H
6
(H
2
PO
4
)
2
和N
2
H
6
HPO
4
;肼第一步电离的方程
式为N
2
H
4
+H
2
O
N
2
+ OH
-
,电离平衡常数
K
=
=
≈
8.70
×
10
7
。
真题回访
1.(2017课标Ⅱ,26,14分)水泥是重要的建筑材料。水泥熟料的主要成分
为CaO、SiO
2
,并含有一定量的铁、铝和镁等金属的氧化物。实验室测
定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几
滴硝酸。加入硝酸的目的是
,还可使用
代替硝酸。
(2)沉淀A的主要成分是
,其不溶于强酸但可与一种弱酸反应,
该反应的化学方程式为
。
(3)加氨水过程中加热的目的是
。
沉淀B的主要成分为
、
(写化学式)。
(4)草酸钙沉淀经稀H
2
SO
4
处理后,用KMnO
4
标准溶液滴定,通过测定草酸
的量可间接获知钙的含量,滴定反应为:Mn
+H
+
+H
2
C
2
O
4
Mn
2+
+CO
2
+H
2
O。实验中称取0.400 g水泥样品,滴定时消耗了0.050 0 mol·L
-1
的
KMnO
4
溶液36.00 mL,则该水泥样品中钙的质量分数为
。
答案 (1)将样品中可能存在的Fe
2+
氧化为Fe
3+
H
2
O
2
(2)SiO
2
(或H
2
SiO
3
) SiO
2
+4HF
SiF
4
↑+2H
2
O(或H
2
SiO
3
+4HF
SiF
4
↑+3H
2
O)
(3)防止胶体生成,易沉淀分离 Al(OH)
3
Fe(OH)
3
(4)45.0%
解析 加入盐酸及氯化铵和硝酸后,只有SiO
2
不溶,故沉淀A为SiO
2
。滤
液中含有Ca
2+
、Mg
2+
、Fe
3+
、Al
3+
等离子,加入氨水调节pH至4~5时,Fe
3+
转化为Fe(OH)
3
,Al
3+
转化为Al(OH)
3
。
(1)加入硝酸的目的是将样品中可能存在的Fe
2+
氧化为Fe
3+
,还可以用H
2
O
2
代替硝酸。
(2)SiO
2
可以溶于氢氟酸,反应方程式为4HF+SiO
2
SiF
4
↑+2H
2
O。
(3)加入氨水时加热可以促进Fe
3+
、Al
3+
等水解,形成沉淀,沉淀B主要为
Fe(OH)
3
、Al(OH)
3
。
(4)2KMnO
4
~5H
2
C
2
O
4
~5CaC
2
O
4
~5Ca
2+
2 mol 5
×
40 g
0.050 0
×
36.00
×
10
-3
mol
m
(Ca
2+
)
m
(Ca
2+
)=0.180 g
故
ω
(Ca
2+
)=
×
100%=45.0%。
2.(2016课标Ⅰ,26,14分)氮的氧化物(NO
x
)是大气污染物之一,工业上在
一定温度和催化剂条件下用NH
3
将NO
x
还原生成N
2
。某同学在实验室
中对NH
3
与NO
2
反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的
,反应的化学方程式为
。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置
→
(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH
3
充入注射器X中,硬质玻璃管Y中加入少量催化剂,
充入NO
2
(两端用夹子K
1
、K
2
夹好)。在一定温度下按图示装置进行实
验。
操作步骤
实验现象
解释原因
打开K
1
,推动注射器活塞,使X中的气体缓慢通入Y管中
①Y管中
②反应的化学方程式
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K
2
③
④
答案 (1)①A 2NH
4
Cl+Ca(OH)
2
2NH
3
↑+CaCl
2
+2H
2
O(或B NH
3
·
H
2
O
NH
3
↑+H
2
O) ②dcfei
(2)①红棕色气体慢慢变浅 ②8NH
3
+6NO
2
7N
2
+12H
2
O ③Z
中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小
于外压
解析 (1)①制备氨气可用Ca(OH)
2
(s)和NH
4
Cl(s)混合加热,可选用装置
A;也可采用加热浓氨水的方法,此时可选用装置B。②欲得到干燥的氨
气,首先要干燥(干燥管要大口进,小口出),其次要收集(氨气密度比空气
小,要用向下排空气法),最后为尾气处理(因氨气极易溶于水,要用防倒
吸的F装置)。
(2)NH
3
和NO
2
在催化剂、一定温度下可发生反应,故Y管中红棕色气体
慢慢变浅;由化学方程式8NH
3
+6NO
2
7N
2
+12H
2
O可以得出,反应
后气体分子数减少,压强减小,故打开K
2
后,Z中NaOH溶液会产生倒吸现
象。
3.(2016课标Ⅰ,28节选)NaClO
2
是一种重要的杀菌消毒剂,也常用来漂白
织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO
2
中Cl的化合价为
。
(2)写出“反应”步骤中生成ClO
2
的化学方程式
。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg
2+
和Ca
2+
,
要加入的试剂分别为
、
。“电解”中阴极反应的主
要产物是
。
答案 (1)+3
(2)2NaClO
3
+SO
2
+H
2
SO
4
2ClO
2
+2NaHSO
4
(3)NaOH溶液 Na
2
CO
3
溶液 Cl
(或NaClO
2
)
解析 (2)根据图示可确定反应物和生成物,然后根据得失电子守恒和
原子守恒即可写出反应的化学方程式。
(3)粗盐水精制时用NaOH溶液除Mg
2+
,用Na
2
CO
3
溶液除Ca
2+
;根据图示可
知“电解”过程中发生的反应为2ClO
2
+2NaCl
Cl
2
+2NaClO
2
,由此
可知,在电解池的阴极上ClO
2
得电子生成NaClO
2
,故阴极反应的主要产
物为NaClO
2
。
4.(2016课标Ⅱ,26,14分)联氨(又称肼,N
2
H
4
,无色液体)是一种应用广泛的
化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为
,其中氮的化合价为
。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式
为
。
(3)①2O
2
(g)+N
2
(g)
N
2
O
4
(l) Δ
H
1
②N
2
(g)+2H
2
(g)
N
2
H
4
(l) Δ
H
2
③O
2
(g)+2H
2
(g)
2H
2
O(g) Δ
H
3
④2N
2
H
4
(l)+N
2
O
4
(l)
3N
2
(g)+4H
2
O(g) Δ
H
4
=-1 048.9 kJ·mol
-1
上述反应热效应之间的关系式为Δ
H
4
=
,联氨和N
2
O
4
可
作为火箭推进剂的主要原因为
。
(4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反
应的平衡常数值为
(已知:N
2
H
4
+H
+
N
2
的
K
=8.7
×
10
7
;
K
W
=
1.0
×
10
-14
)。联氨与硫酸形成的酸式盐的化学式为
。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶
液,观察到的现象是
。联氨可用于
处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水
中溶解的O
2
kg;与使用Na
2
SO
3
处理水中溶解的O
2
相比,联氨的优点是
。
答案 (1) -2
(2)2NH
3
+NaClO
N
2
H
4
+NaCl+H
2
O
(3)2Δ
H
3
-2Δ
H
2
-Δ
H
1
反应放热量大、产生大量气体
(4)8.7
×
10
-7
N
2
H
6
(HSO
4
)
2
(5)固体逐渐变黑,并有气泡产生 1 N
2
H
4
的用量少,不产生其他杂质
(产物为N
2
和H
2
O,而Na
2
SO
3
产生Na
2
SO
4
)
解析 (1)联氨的结构式为
,故其电子式为 ;
N
2
H
4
中H为+1价,故N为-2价。
(2)NaClO具有强氧化性,可将NH
3
氧化为N
2
H
4
,本身被还原为NaCl,据此
可写出反应的化学方程式。
(3)根据盖斯定律,由2
×
(③-②)-①可得④,故Δ
H
4
=2Δ
H
3
-2Δ
H
2
-Δ
H
1
。
(4)NH
3
在水中的电离方程式为NH
3
+H
2
O
N
+OH
-
,则N
2
H
4
在水中的
第一步电离方程式为N
2
H
4
+H
2
O
N
2
+OH
-
,该步电离的平衡常数
K
1
=
,又知N
2
H
4
+H
+
N
2
的
K
=
=
=8.7
×
10
7
,则
K
1
=
K
·
K
W
=(8.7
×
10
7
)
×
(1.0
×
10
-14
)=8.7
×
10
-7
。
(5)联氨与AgBr反应时,AgBr可将N
2
H
4
氧化为N
2
,自身被还原为Ag,反应
的化学方程式为4AgBr+N
2
H
4
N
2
↑+4Ag+4HBr,因此可观察到固体
逐渐变黑,并有气泡产生。