- 2021-06-19 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末考试试题 新人教版
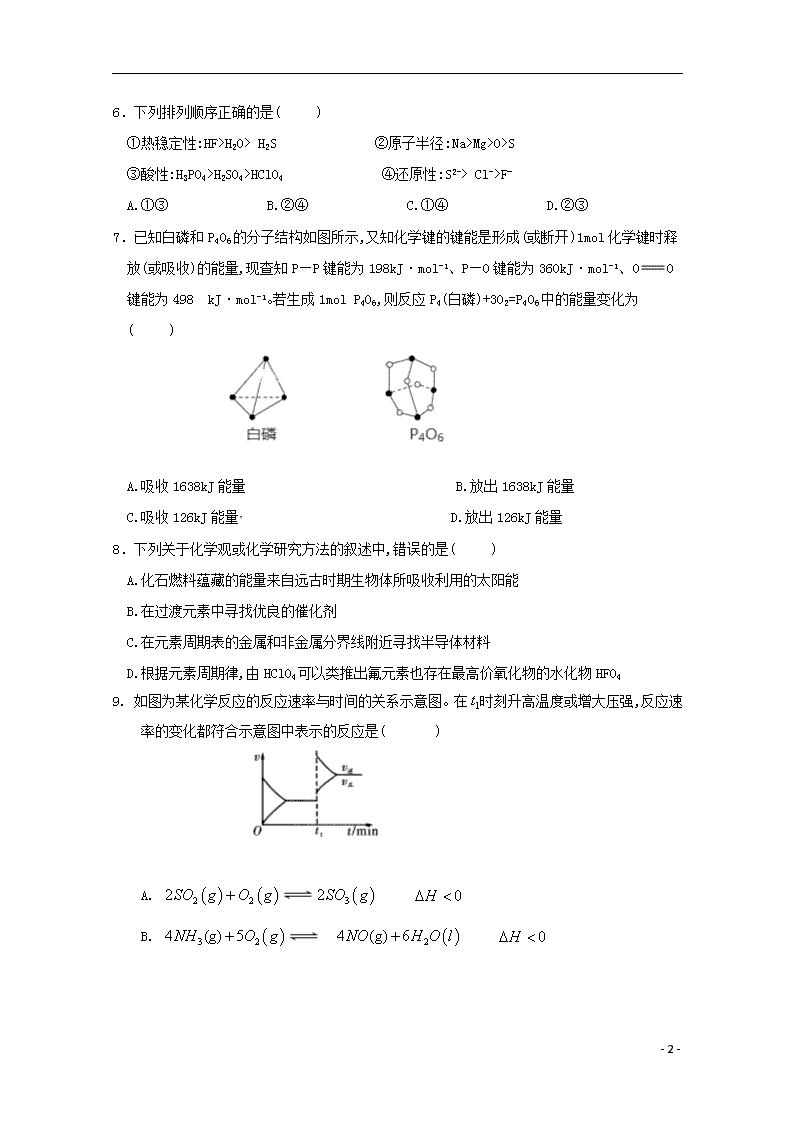
2019学年度下学期期末试题 高 一 化 学 本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试结束后,只交答题纸和答题卡,试题自己保留。(考试时间:90分钟。试卷总分:100分)。 第I卷 (54分) 可能用到的相对原子质量: H: 1 O: 16 Cu: 64 Fe: 56 Na: 23 N:14 C:12 S:32 一、选择题(共18小题,每题3分,共54分。每题只有1个选项符合题意) 1.下列有关反应限度的说法正确的是( ) A.大多数化学反应在一定条件下都有一定的限度 B.NH4HCO3受热分解可自发进行 C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 2.100 mL 浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又基本不影响生成氢气的总量,可采用的方法是( ) A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液 C.加入适量蒸馏水 D.加入适量的氯化钠溶液 3. 以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉),下列说法错误的是( ) A.阴极附近溶液呈红色 B.阴极逸出气体 C.阳极附近溶液呈蓝色 D.溶液的PH变小 4.下列叙述中,正确的是( ) A. 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ B. Mg-Al及NaOH溶液构成的原电池中负极材料为Mg C. 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO D. H2-O2燃料电池中电解液为H2SO4 , 则正极反应式为:O2+4e-=2O2- 5. 下列自发反应可用焓判据来解释的是( ) A.氢氧化钡和氯化铵的反应 B.2N2O5(g) 4NO2(g)+O2(g) ∆H=+56.7 kJ/mol C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) ∆H=+74.9 kJ/mol D.2H2(g)+O2(g) H2O(l) ∆H=-285.8 kJ/mol - 10 - 6.下列排列顺序正确的是( ) ①热稳定性:HF>H2O> H2S ②原子半径:Na>Mg>O>S ③酸性:H3PO4>H2SO4>HClO4 ④还原性:S2-> Cl->F- A.①③ B.②④ C.①④ D.②③ 7.已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量,现查知P—P键能为198kJ·mol-1、P—O键能为360kJ·mol-1、OO键能为498 kJ·mol-1。若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( ) A.吸收1638kJ能量 B.放出1638kJ能量 C.吸收126kJ能量 D.放出126kJ能量 8.下列关于化学观或化学研究方法的叙述中,错误的是( ) A.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 B.在过渡元素中寻找优良的催化剂 C.在元素周期表的金属和非金属分界线附近寻找半导体材料 D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 9. 如图为某化学反应的反应速率与时间的关系示意图。在时刻升高温度或增大压强,反应速率的变化都符合示意图中表示的反应是( ) A. B. - 10 - C. D. 10.国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( ) A.宇航员喝茶时注入的H2O的摩尔质量是18g B.H2O+Cl2HCl+HClO这反应属于氧化还原反应 C.氢的三种同位素1H、2D、3T与16O只能形成三种水分子 D.在标准状况下,1mol水的体积约是22.4L 11.海水提溴工业的设计思想是在海水中富集溴元素。在有关工艺流程的以下化学用语中,正确的是( ) A.用电子式表示溴化氢的形成过程为: B.海水中Br-的电子式为: C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl D.氯离子的结构示意图为: 12.低温脱硝技术可用于处理废气中的氮氧化物, 发生的化学反应为: , 在恒容的密闭容器中,下列有关说法正确的是( ) A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 B.平衡时,其他条件不变,增加的浓度,废气中氮氧化物的转化率减小 C.单位时间内消耗和的物质的量比为1:2时,反应达到平衡 D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 13.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: 已知碳的燃烧热 - 10 - 则为( ) A. B. C. D. 14.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的3倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法不正确的是( ) A.元素A、B组成的化合物常温下一定呈液态 B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 C.工业上常用电解法制备元素C、D、E的单质 D.化合物AE与CE含有相同类型的化学键 15.向某密闭容器中加入0.30、0.10和一定量的三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[阶段的变化未画出]。乙图为时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同, 阶段为使用催化剂。下列说法不正确的是( ) A.若,则用的浓度变化表示的阶段的平均反应速率为0.004 B. 阶段改变的条件一定为减小压强 C.若该容器的容积为2,则的起始的物质的量为0.02 D.若阶段,容器内的物质的量减少了0.03,而此过程中容器与外界的热交换总量为,则该反应的热化学方程式为: , - 10 - 16. 将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量减少 17.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O B.外电路电子的流向是从a到b C.电池工作时,盐桥中的SO42﹣移向甲烧杯 D.b电极上发生还原反应 18.工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3 . Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( ) A. 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 B. 甲装置中阴极的反应为Fe﹣2e﹣═Fe2+ C. 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 D. 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L 第II卷 (46分) 二、填空题(本题包括5小题,共46分) 19.(7分)可逆反应mA(g)+nB(g)===pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。 - 10 - (1)用“>”、“=”或“<”填空:该反应的ΔH______0,m+n______p。 (2)用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入B,则A的转化率________;升高温度,则平衡时B、C的浓度之比c(B)/c(C)将________;加入催化剂,平衡时气体混合物的总物质的量________。 (3)若A、C均为无色气体,B为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入C,平衡混合物的颜色________;而恒压充入氖气,平衡混合物颜色________。 20.(7分)氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。 在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应: N2(g)+3H2(g) ===2NH3(g)(正反应为放热反应) (1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。 (2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度________。(填“变大”“变小”或“不变”) (3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”“逆向”或“不”)移动。 (4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。 21.(12分) 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题: (1)已知某温度下某反应的化学平衡常数表达式为:K=,它所对应的化学反应为:________________________。 (2)已知在一定温度下, ①C(s)+CO2(g)2CO(g) ΔH1=a kJ/mol 平衡常数K1; ②CO(g)+H2O(g)H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2; ③C(s)+H2O(g)CO(g)+H2(g) ΔH3 平衡常数K3。 则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。 (3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示: - 10 - 温度/℃ 400 500 800 平衡常数K 9.94 9 1 该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。 (4)高炉炼铁产生的废气中的可进行回收,使其在一定条件下和反应制备甲醇: 。请回答下列问题; ①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表: 容器 反应物 投入的量 反应物 的转化率 的浓度 能量变化(、 、均大于0) 甲 1 和2 放出 热量 乙 1 放出 热量 丙 2 和4 放出 热量 则下列关系正确的是__________。 a. b. c. d. e.该反应若生成1 ,则放出(热量 ②若在一体积可变的密闭容器中充入1 、2 和1 ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。 22.(11分)研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义。将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l)。 (1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度减小,则反应的焓变△H_____0,熵变△S_______0(分别填“>”、“<”、或“=”)。 (2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示。 - 10 - ①图中0-4min内A的反应速率v(CO2)=________。该温度下平衡常数的表达式为________。 ②下列有关说法正确的是______(填字母序号)。 A.反应的活化能大小顺序是:Ea(A)查看更多