2020高考化学二轮复习层级题组快练4含解析
层级题组快练8+2(4)
1.十八大以来,习近平总书记在多个场合强调“绿水青山就是金山银山”,对环境生态保护尤为重视,下列说法不符合绿色化学理念的是( )
A.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
B.利用有机垃圾发酵生产沼气作生活燃料
C.将造纸废水通过高压水井压到地下,节约成本
D.积极开发废旧电池的综合利用技术,解决电池中的重金属对土壤和水体的污染
答案 C
2.有机物M()苯环上只有一个侧链的结构共有( )
A.5种 B.6种
C.7种 D.8种
答案 D
解析 戊烷有三种同分异构体:正戊烷、异戊烷和新戊烷,正戊烷等效氢有3种,异戊烷等效氢有4种,新戊烷等效氢有1种,则—C5H11的数目共8种,所以有机物M()苯环上只有一个侧链的结构共有8种,D项正确。
3.设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4 L H2和22.4 L F2混合后,气体分子数为2NA
B.0.3 mol二氧化氮与水反应转移电子数为0.2NA
C.1 L 2 mol·L-1 NaHCO3溶液中所含H原子数为2NA
D.0.1 mol NO与足量O2的混合物中含有的N原子数为0.2NA
答案 B
解析 标准状况下,22.4 L H2和22.4 L F2混合后生成的HF为非气体,A项错误;0.3 mol二氧化氮与水反应生成0.2 mol硝酸和0.1 mol NO,转移电子数为0.2NA,B项正确;NaHCO3溶液中水分子也含有氢原子,故所含H原子数大于2NA,C项错误;0.1 mol NO与足量O2的混合物中含有的N原子数为0.1NA,D项错误。
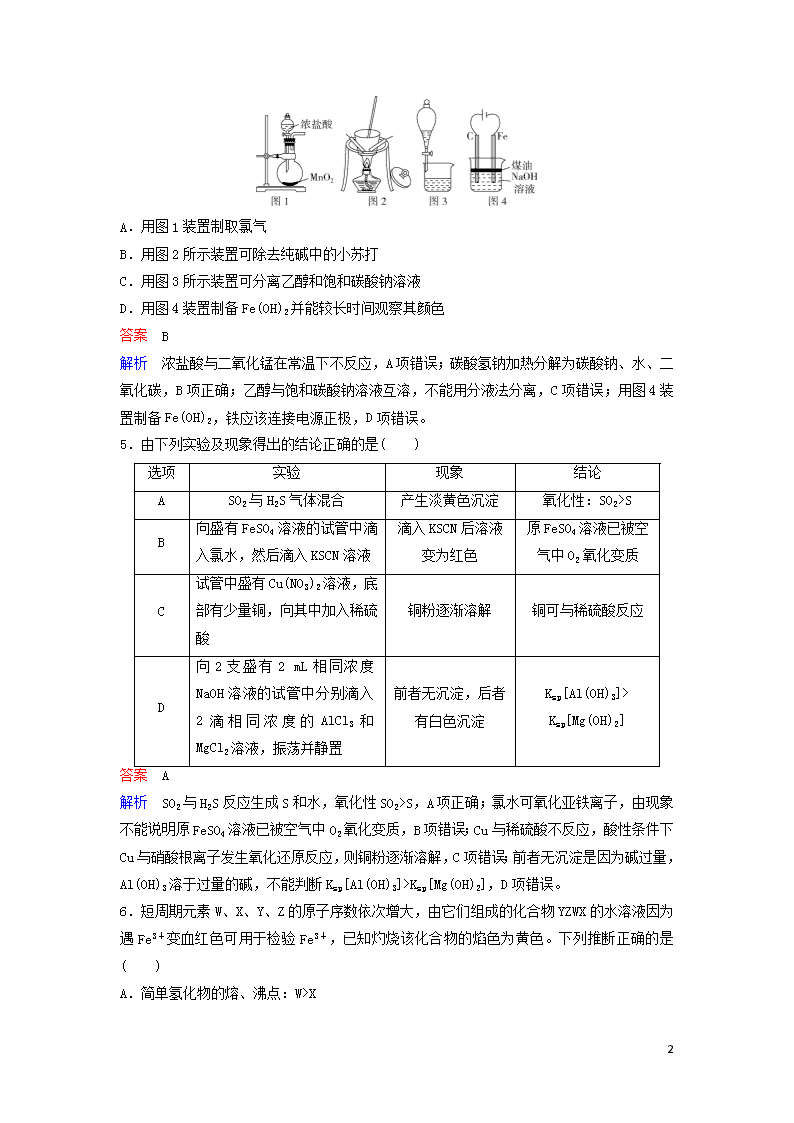
4.下列有关实验装置进行的相应实验,能达到实验目的的是( )
6
A.用图1装置制取氯气
B.用图2所示装置可除去纯碱中的小苏打
C.用图3所示装置可分离乙醇和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
答案 B
解析 浓盐酸与二氧化锰在常温下不反应,A项错误;碳酸氢钠加热分解为碳酸钠、水、二氧化碳,B项正确;乙醇与饱和碳酸钠溶液互溶,不能用分液法分离,C项错误;用图4装置制备Fe(OH)2,铁应该连接电源正极,D项错误。
5.由下列实验及现象得出的结论正确的是( )
选项
实验
现象
结论
A
SO2与H2S气体混合
产生淡黄色沉淀
氧化性:SO2>S
B
向盛有FeSO4溶液的试管中滴入氯水,然后滴入KSCN溶液
滴入KSCN后溶液变为红色
原FeSO4溶液已被空气中O2氧化变质
C
试管中盛有Cu(NO3)2溶液,底部有少量铜,向其中加入稀硫酸
铜粉逐渐溶解
铜可与稀硫酸反应
D
向2支盛有2 mL相同浓度NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置
前者无沉淀,后者有白色沉淀
Ksp[Al(OH)3]>
Ksp[Mg(OH)2]
答案 A
解析 SO2与H2S反应生成S和水,氧化性SO2>S,A项正确;氯水可氧化亚铁离子,由现象不能说明原FeSO4溶液已被空气中O2氧化变质,B项错误;Cu与稀硫酸不反应,酸性条件下Cu与硝酸根离子发生氧化还原反应,则铜粉逐渐溶解,C项错误;前者无沉淀是因为碱过量,Al(OH)3溶于过量的碱,不能判断Ksp[Al(OH)3]>Ksp[Mg(OH)2],D项错误。
6.短周期元素W、X、Y、Z的原子序数依次增大,由它们组成的化合物YZWX的水溶液因为遇Fe3+变血红色可用于检验Fe3+,已知灼烧该化合物的焰色为黄色。下列推断正确的是( )
A.简单氢化物的熔、沸点:W>X
6
B.原子半径和离子半径均满足:X
W
D.常温下,pH为12的Y2Z溶液中水电离的c(H+)为10-12 mol·L-1
答案 C
解析 由题意可推知,W、X、Y、Z分别是C、N、Na、S。熔、沸点NH3>CH4,A项错误;原子半径NNa+,B项错误;最高价氧化物对应水化物的酸性H2SO4>H2CO3,C项正确;Na2S水解促进水电离,常温下,pH为12的Na2S溶液中水电离的c(H+)为10-2 mol·L-1,D项错误。
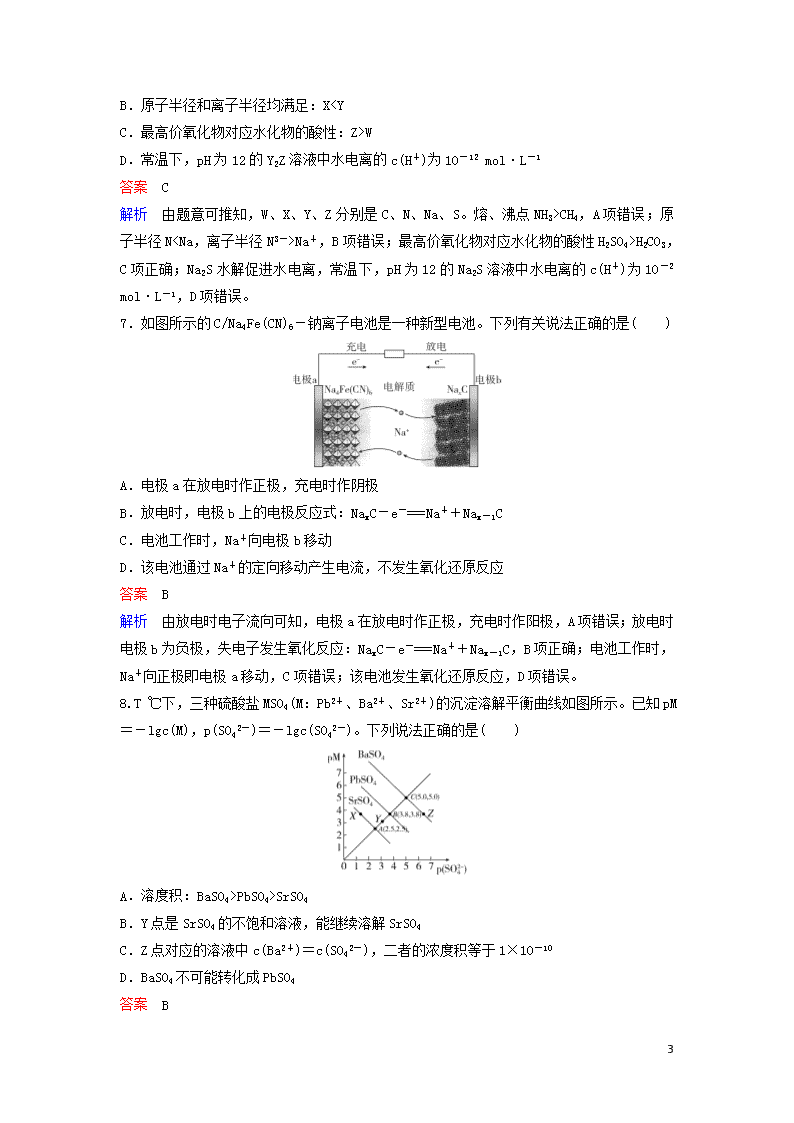
7.如图所示的C/Na4Fe(CN)6-钠离子电池是一种新型电池。下列有关说法正确的是( )
A.电极a在放电时作正极,充电时作阴极
B.放电时,电极b上的电极反应式:NaxC-e-===Na++Nax-1C
C.电池工作时,Na+向电极b移动
D.该电池通过Na+的定向移动产生电流,不发生氧化还原反应
答案 B
解析 由放电时电子流向可知,电极a在放电时作正极,充电时作阳极,A项错误;放电时电极b为负极,失电子发生氧化反应:NaxC-e-===Na++Nax-1C,B项正确;电池工作时,Na+向正极即电极a移动,C项错误;该电池发生氧化还原反应,D项错误。
8.T ℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
A.溶度积:BaSO4>PbSO4>SrSO4
B.Y点是SrSO4的不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)=c(SO42-),二者的浓度积等于1×10-10
D.BaSO4不可能转化成PbSO4
答案 B
6
解析 c(SO42-)相同时,pM越大,金属离子浓度越小,溶度积越小,所以溶度积BaSO4c(SO42-),二者的浓度积等于1×10-10,C项错误;增大Pb2+的浓度,BaSO4能转化成PbSO4,D项错误。
9.纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3。
请回答下列问题:
(1)仪器甲的名称是________,在该实验中,其作用是____________________________。
(2)将上述接口连接顺序补充完整:a→____________;b→________;d→________。
(3)装置D中选择的试剂是________(填序号,下同),装置E中选择的试剂是________。
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为_____________________________________________
________________________________________________________________________。
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为_____________________________________________________
________________________________________________________________________(结合化学方程式解释)。
(6)当生成5 g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为________。
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0 mol·L-1的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中的值(x)的取值范围为________。
答案 (1)干燥管 防止倒吸
(2)f→g→e c h
(3)② ③
6
(4)Ca2++2NH3+CO2+H2O===CaCO3↓+2NH4+
(5)CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2易溶于水
(6)3.36 L、7.84 L
(7)x>50
解析 (2)A中产生CO2,B中生成NH3,C中CaCl2、NH3、CO2和水反应生成CaCO3沉淀和NH4Cl;A中生成的CO2中混有HCl,可以通过D装置除去;E装置吸收未反应的NH3,防止污染空气。NH3在水中溶解度大,为避免发生倒吸,c中通入NH3,e中通入CO2。(3)除去CO2中HCl用饱和NaHCO3溶液;E中所装试剂为固体,碱石灰不能吸收NH3,无水CaCl2可吸收NH3。(6)n(CaCl2)=0.2 L×0.5 mol·L-1=0.1 mol、n(CaCO3)==0.05 mol。若CO2少量,由CO2+2NH3+CaCl2+H2O===CaCO3↓+2NH4Cl可知,生成0.05 mol CaCO3需要0.05 mol CO2和0.1 mol NH3,气体总体积为3.36 L(标准状况);若CO2过量,生成的CaCO3部分溶解,由CO2+2NH3+CaCl2+H2O===CaCO3↓+2NH4Cl可知,0.1 mol CaCl2消耗0.1 mol CO2和0.2 mol NH3,生成0.1 mol CaCO3,因最终沉淀为0.05 mol,所以还需继续通入0.05 mol CO2溶解0.05 mol CaCO3,消耗气体总物质的量为0.1 mol+0.2 mol+0.05 mol=0.35 mol,标准状况下气体体积为7.84 L。(7)要使CaCO3向CaSO3转化,需满足c(SO32-)·c(Ca2+)>Ksp(CaSO3),即c(SO32-)·>Ksp(CaSO3),则>=50。
10.某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
回答下列问题:
(1)加快“氧化浸出”速率的措施有__________________________________________ ______________________________(写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________________________________________________________________________。
(3)湿法炼铜后溶液中的主要物质有____________(填化学式)。
(4)氨浸实验时,需要在常温下进行的原因是____________________________________ ____________________________________;熔炼时加入Na2CO3的目的是除硅,写出反应的化学方程式:________________________________________________________________。
6
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________mol·L-1。
(6)写出流程中还原制银的化学方程式:________________________________________ ________________________________。
答案 (1)搅拌、粉碎炉渣
(2)加快水解速率,促进Bi3+的水解
(3)Fe(NO3)2、NaNO3
(4)温度高,氨气易挥发
SiO2+Na2CO3Na2SiO3+CO2↑
(5)10-2
(6)4Ag(NH3)2Cl+N2H4·H2O===4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O[或4Ag(NH3)2Cl+N2H4===4Ag↓+N2↑+4NH3↑+4NH4Cl或4Ag(NH3)2Cl+N2H4·H2O+3H2O===4Ag↓+N2↑+4NH3·H2O+4NH4Cl]
解析 (3)清液中主要含Cu2+、Na+、NO3-,加入铁屑与Cu2+反应生成Cu和Fe2+,故溶质主要为Fe(NO3)2和NaNO3。
(5)==·c(Cl-)=107c(Cl-),c(Cl-)= mol·L-1=0.01 mol·L-1。
6