- 2021-06-19 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省2020高考化学二轮复习专题题型九电化学原理及应用训练含解析
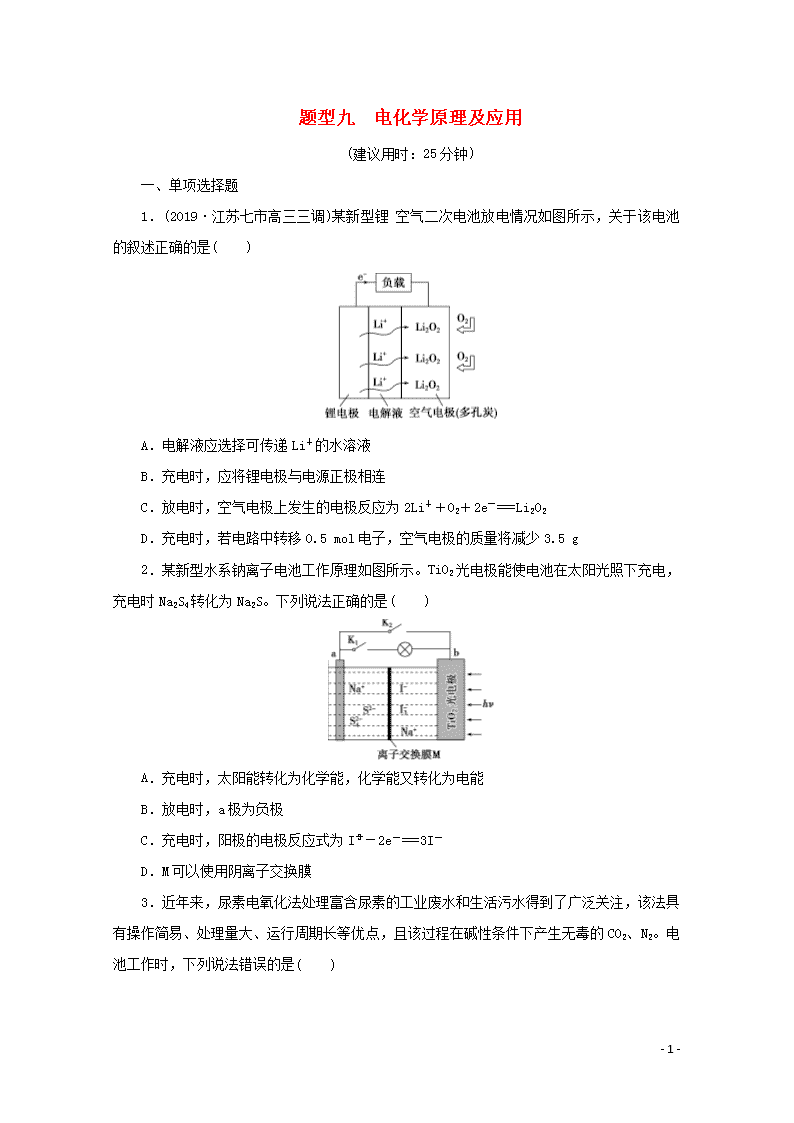
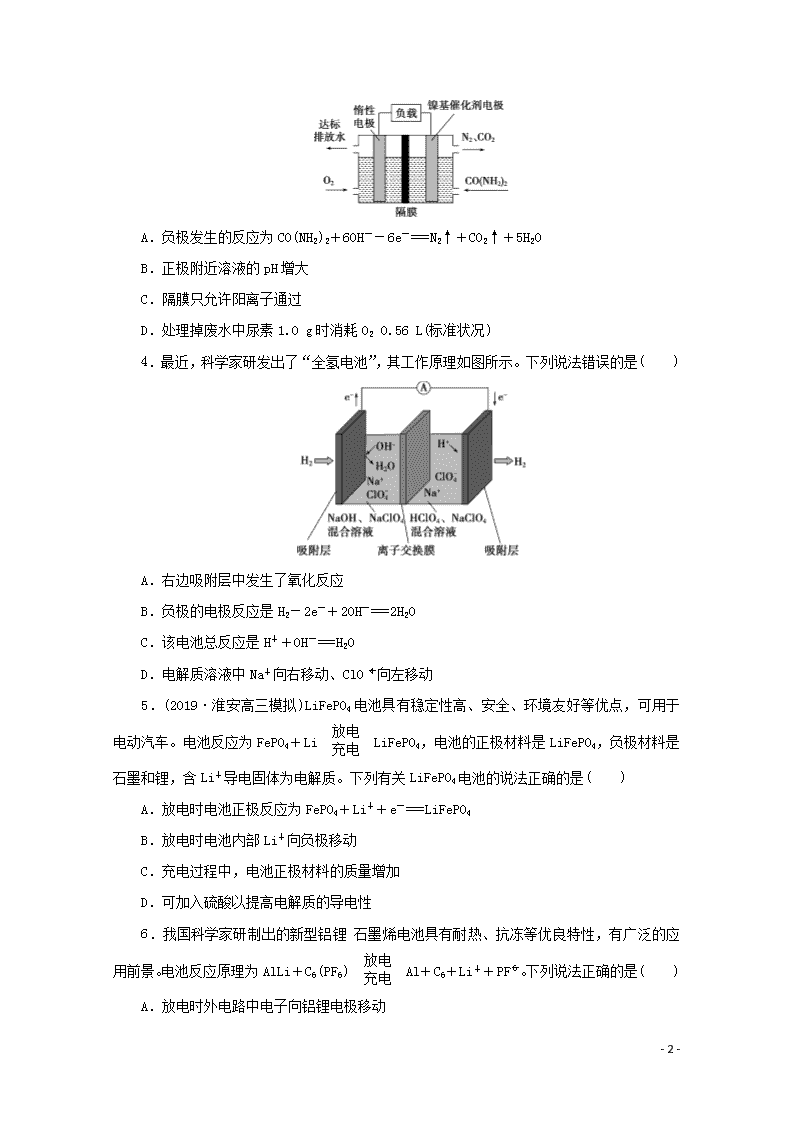
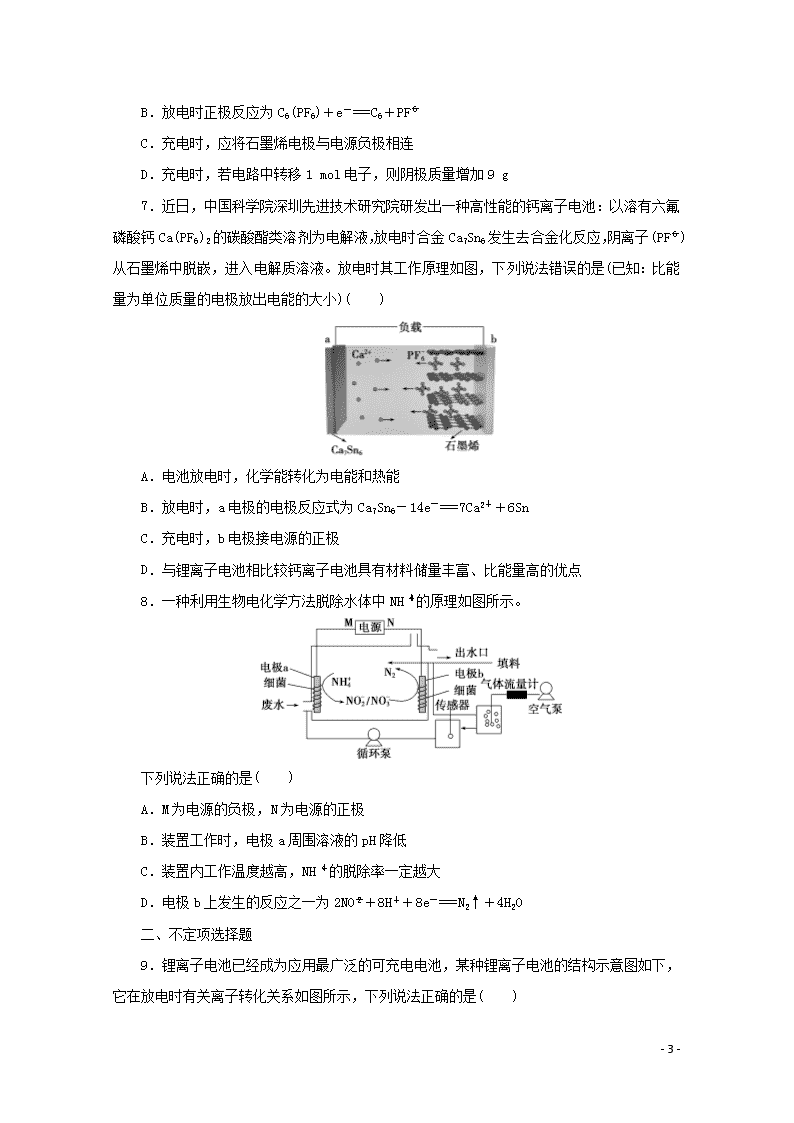
题型九 电化学原理及应用 (建议用时:25分钟) 一、单项选择题 1.(2019·江苏七市高三三调)某新型锂空气二次电池放电情况如图所示,关于该电池的叙述正确的是( ) A.电解液应选择可传递Li+的水溶液 B.充电时,应将锂电极与电源正极相连 C.放电时,空气电极上发生的电极反应为2Li++O2+2e-===Li2O2 D.充电时,若电路中转移0.5 mol电子,空气电极的质量将减少3.5 g 2.某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4转化为Na2S。下列说法正确的是( ) A.充电时,太阳能转化为化学能,化学能又转化为电能 B.放电时,a极为负极 C.充电时,阳极的电极反应式为I-2e-===3I- D.M可以使用阴离子交换膜 3.近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的CO2、N2。电池工作时,下列说法错误的是( ) - 7 - A.负极发生的反应为CO(NH2)2+6OH--6e-===N2↑+CO2↑+5H2O B.正极附近溶液的pH增大 C.隔膜只允许阳离子通过 D.处理掉废水中尿素1.0 g时消耗O2 0.56 L(标准状况) 4.最近,科学家研发出了“全氢电池”,其工作原理如图所示。下列说法错误的是( ) A.右边吸附层中发生了氧化反应 B.负极的电极反应是H2-2e-+2OH-===2H2O C.该电池总反应是H++OH-===H2O D.电解质溶液中Na+向右移动、ClO向左移动 5.(2019·淮安高三模拟)LiFePO4电池具有稳定性高、安全、环境友好等优点,可用于电动汽车。电池反应为FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池的说法正确的是( ) A.放电时电池正极反应为FePO4+Li++e-===LiFePO4 B.放电时电池内部Li+向负极移动 C.充电过程中,电池正极材料的质量增加 D.可加入硫酸以提高电解质的导电性 6.我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6)Al+C6+Li++PF。下列说法正确的是( ) A.放电时外电路中电子向铝锂电极移动 - 7 - B.放电时正极反应为C6(PF6)+e-===C6+PF C.充电时,应将石墨烯电极与电源负极相连 D.充电时,若电路中转移1 mol电子,则阴极质量增加9 g 7.近日,中国科学院深圳先进技术研究院研发出一种高性能的钙离子电池:以溶有六氟磷酸钙Ca(PF6)2的碳酸酯类溶剂为电解液,放电时合金Ca7Sn6发生去合金化反应,阴离子(PF)从石墨烯中脱嵌,进入电解质溶液。放电时其工作原理如图,下列说法错误的是(已知:比能量为单位质量的电极放出电能的大小)( ) A.电池放电时,化学能转化为电能和热能 B.放电时,a电极的电极反应式为Ca7Sn6-14e-===7Ca2++6Sn C.充电时,b电极接电源的正极 D.与锂离子电池相比较钙离子电池具有材料储量丰富、比能量高的优点 8.一种利用生物电化学方法脱除水体中NH的原理如图所示。 下列说法正确的是( ) A.M为电源的负极,N为电源的正极 B.装置工作时,电极a周围溶液的pH降低 C.装置内工作温度越高,NH的脱除率一定越大 D.电极b上发生的反应之一为2NO+8H++8e-===N2↑+4H2O 二、不定项选择题 9.锂离子电池已经成为应用最广泛的可充电电池,某种锂离子电池的结构示意图如下,它在放电时有关离子转化关系如图所示,下列说法正确的是( ) - 7 - A.Li+透过膜除允许Li+通过外,还允许H2O分子通过 B.充电时,电池内部发生的总反应为Li++Fe2+Li+Fe3+ C.充电时,钛电极与外电源的负极相连 D.放电时,进入贮罐的液体发生的离子反应方程式为S2O+Fe2+===Fe3++2SO 10.手持技术的氧电化学传感器可用于测定O2含量,如图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了b g。下列说法正确的是( ) A.Pt上发生氧化反应 B.Pb上发生的电极反应式为Pb+2OH--2e-===Pb(OH)2 C.反应过程中转移OH-的物质的量为0.125b mol D.待测气体中氧气的体积分数为 11.碳酸二甲酯(DMC)结构简式为(CH3O)2CO,化学性质非常活泼,极易水解。用电解法制备碳酸二甲酯的模拟装置如图所示。下列说法正确的是( ) - 7 - A.图中左侧电极为阳极,右侧电极为阴极 B.阳极反应:CO-2e-+2CH3OH===(CH3O)2CO+2H+ C.质子通过质子交换膜从阴极区移向阳极区 D.离子液体必须是水溶液,目的是传递电荷 12.(2019·江苏七市高三调研)某微生物电解池(MEC)制氢工作原理如图所示。用该电解池电解0.1 mol·L-1的CH3COOH溶液,下列说法正确的是( ) A.Y为电源的正极 B.该电解装置中,阳极的电极反应式为CH3COOH+2H2O-8e-===2CO2↑+8H+ C.当2 mol H+通过质子交换膜时,产生22.4 L H2 D.电解一段时间后,溶液中的值变小 参考答案与解析 1.解析:选C。A项,根据金属活动顺序可知,金属Li能和水发生反应,故电解液不能选择水溶液,错误;B项,根据题给图示可知,Li电极为电池负极,充电时作为电解池的阴极,与电源负极相连,错误;C项,根据工作原理图可知,空气电极为电池的正极,发生得电子的还原反应,生成Li2O2,电极反应为2Li++O2+2e-===Li2O2,正确;D项,充电时空气电极作为电解池的阳极,电极反应为Li2O2-2e-===2Li++O2↑,根据得失电子守恒,每转移0.5 mol e-,则有0.25 mol Li2O2参与反应,故电极质量减少11.5 g,错误。 2.解析:选B。充电时,太阳能转化为电能,电能又转化为化学能贮存起来,A错误;放电时,a极为负极,Na2S失电子被氧化为Na2S4,B正确;充电时,阳极失电子被氧化,电极反应式为3I--2e-===I,C错误;M是阳离子交换膜,防止阴离子相互反应,D错误。 3.解析:选C。由题图可知,通尿素的一极为负极,发生氧化反应,电极反应为CO(NH2)2+6OH--6e-===N2↑+CO2↑+5H2O;通氧气的一极为正极,发生还原反应,电极反应为O2+4e-+2H2O===4OH-,以此解答该题。A.负极发生的反应为CO(NH2)2+6OH--6e-===N2↑+CO2↑+5H2O,A正确;B.正极附近发生电极反应O2+4e-+2H2O===4OH-,产生OH-, - 7 - 使溶液的pH增大,B正确;C.为维持溶液的电中性,正极附近产生的OH-通过隔膜进入负极被消耗,隔膜允许阴离子通过,C错误;D.根据电极反应可知负极每消耗尿素1.0 g时转移的电子为0.1 mol,根据正极反应可得消耗的O2为0.1 mol××22.4 L/mol=0.56 L,D正确。 4.解析:选A。由电子的流动方向可知左边吸附层为负极,发生氧化反应,右边吸附层为正极,发生还原反应,A错误;负极的电极反应为H2-2e-+2OH-===2H2O,B正确;正极的电极反应为2H++2e-===H2↑,根据正、负极的反应可知总反应为OH-+H+===H2O,C正确;在原电池中,阳离子向正极移动,阴离子向负极移动,D正确。 5.解析:选A。当其为原电池时,负极材料为石墨和锂,锂失去电子,正极得到电子,电极反应为FePO4+Li++e-===LiFePO4,故A正确;放电时阳离子向正极移动,故B错误;充电过程为电解池,阳极反应为LiFePO4-e-===FePO4+Li+,电池的正极材料质量减少,故C错误;因为锂可以和硫酸反应,则电解质中不能加入硫酸,故D错误。 6.解析:选B。放电时,铝锂电极为负极,石墨电极为正极,放电时外电路中电子向石墨电极移动,A项错误;充电时,应将石墨烯电极与电源正极相连,C项错误;充电时,阴极反应为Al+Li++e-===AlLi,若电路中转移1 mol电子,则阴极质量增加7 g,D项错误。 7.解析:选D。电池放电时为原电池,化学能转化为电能和热能,A正确;根据图示可知,Ca2+向b电极移动,因此a电极为负极,发生氧化反应:Ca7Sn6-14e-===7Ca2++6Sn,B正确;充电时为电解池,b电极为原电池的正极,应该接电源的正极,C正确;由于提供1 mol e-时,钙的质量大于锂的质量,所以单位质量的电极放出电能,钙离子电池比能量比锂离子电池要低,D错误。 8.解析:选B。电极a上NH失电子,反应生成NO或NO,电极a为阳极,所以M为电源的正极,N为电源的负极,故A错误;电极a上发生的反应为NH+2H2O-6e-===NO+8H+或NH+3H2O-8e-===NO+10H+,电极a周围溶液的pH降低,故B正确;细菌需要在正常温度范围内才能有效工作,温度太高会使细菌死亡,故C错误;电极b上发生的反应之一应该是2NO+8H++6e-===N2↑+4H2O,故D错误。 9.解析:选B。该电池的负极是金属锂,Li+透过膜只允许Li+通过,不允许H2O分子通过,故A错误;电池反应为Li+Fe3+===Li++Fe2+,则充电时发生的反应为Li++Fe2+Li+Fe3+,故B正确;钛电极是电池的正极,充电时,应该与外电源的正极相连,故C错误;放电时,正极上发生得电子的还原反应,即Fe3++e-===Fe2+,Fe2+与S2O发生氧化还原反应:S2O+2Fe2+===2Fe3++2SO,故D错误。 - 7 - 10.解析:选CD。由题图可知,O2在Pt电极上发生还原反应,电极反应式为O2+2H2O+4e-===4OH-,所以Pt电极为正极,Pb电极则为负极,发生氧化反应,电极反应式为Pb+2OH--2e-===PbO+H2O,电池总反应为2Pb+O2===2PbO。根据以上分析,Pt上发生还原反应,A错误;Pb上发生的电极反应式为Pb+2OH--2e-===PbO+H2O,B错误;反应过程中,负极增加的质量为O的质量,正极消耗氧气 mol,根据O2+2H2O+4e-===4OH-,转移OH-的物质的量为 mol×4=0.125b mol,C正确;电极增加的质量为O的质量,待测气体为a L,含有的氧气体积为 mol×22.4 L/mol=0.7b L,则待测气体中氧气的体积分数为,D正确。 11.解析:选AB。左侧放电物质CO是还原剂,发生氧化反应为阳极,右侧O2放电为阴极,A正确;质子(H+)在阳极区生成,通过质子交换膜从阳极区移向阴极区,C错误;依据题干信息“碳酸二甲酯(DMC)极易水解”可知,离子液体必须是非水体系,D错误。 12.解析:选B。A项,由题图可知,右边电极上H+得电子生成H2,该电极为阴极,所以Y为电源的负极,错误;B项,由题图可知左边电极上CH3COOH失电子生成CO2,正确;C项,未标明标准状况,无法计算H2的体积,错误;D项,电解反应总方程式为CH3COOH+2H2O2CO2↑+4H2↑,溶液中==,Ka不变,电解一段时间后c(H+)减小,故的值变大,错误。 - 7 -查看更多