- 2021-06-19 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末考试(7月)试题(新版)新人教版
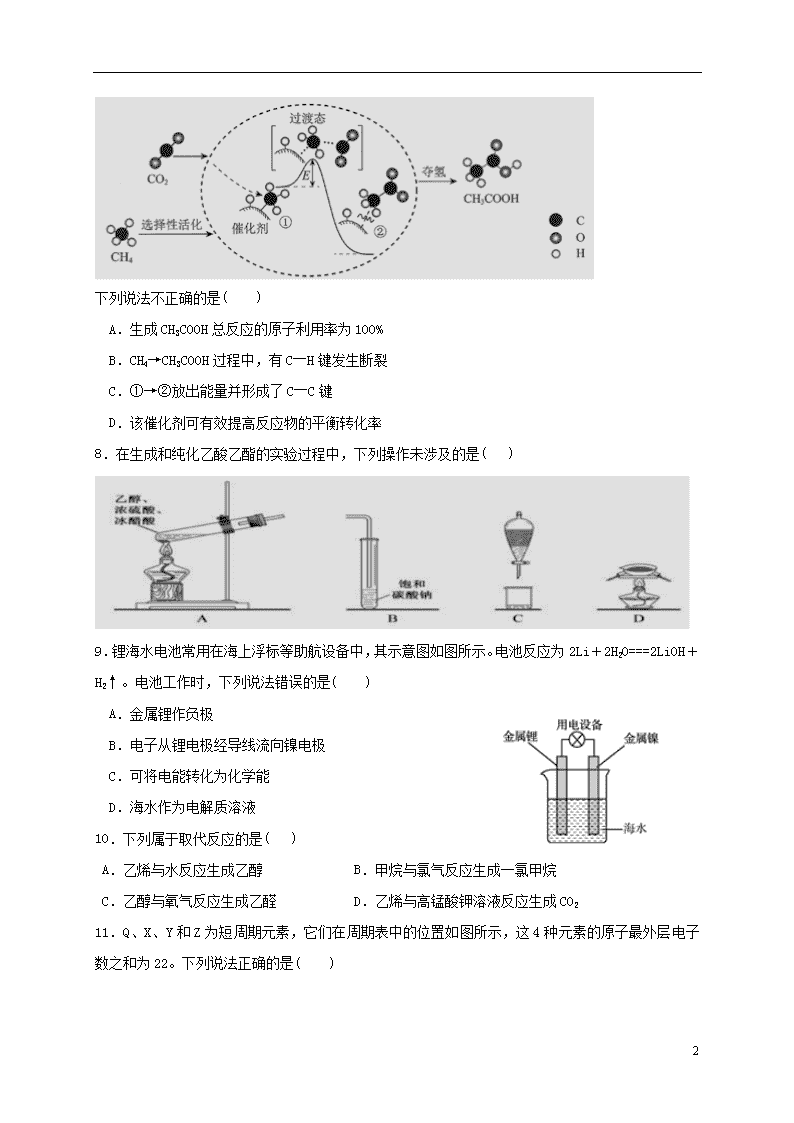
2019年上学期期终考试高一化学试卷 考试时间:90分钟 满分:100分 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I卷(选择题) 一、单选题(每小题只有一个正确选项,3×17=51分) 1.下列各组中属于同系物的是( ) A.12C与14C B. 金刚石与石墨 C.CH4 与C2H6 D.H2O与D2O 2.下列为人体提供能量的营养物质中,属于高分子化合物的是( ) A.蔗糖 B.油脂 C.葡萄糖 D.蛋白质 3.下列有关化学用语表示正确的是( ) A. 中子数为8的氧原子: B.Mg2+的结构示意图: C. 硫化钠的电子式: D.甲酸甲酯的结构简式:C2H4O2 4.第三届联合国环境大会的主题为“迈向零污染地球”。下列做法不应提倡的是( ) A.推广电动汽车,践行绿色交通 B.回收电子垃圾,集中填埋处理 C.水果保鲜,可用浸泡过高锰酸钾溶液的硅土 D.净化工业尾气,减少雾霾生成 5.下列与有机物的结构、性质的有关叙述中正确的是( ) A.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应 B.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 C.分馏、干馏都是物理变化,裂化、裂解都是化学变化 D.纤维素、聚乙烯、光导纤维都属于高分子化合物 6.在金属活动顺序表中,一般常用电解法冶炼的金属是( ) A.钾、钠、铝等最活泼金属 B.锌,铁等中等活泼性的金属 C.常温下呈液态的金属 D.金、铂等最贵重最不活泼的金属 7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。 7 下列说法不正确的是( ) A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C―H键发生断裂 C.①→②放出能量并形成了C―C键 D.该催化剂可有效提高反应物的平衡转化率 8.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( ) 9.锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( ) A.金属锂作负极 B.电子从锂电极经导线流向镍电极 C.可将电能转化为化学能 D.海水作为电解质溶液 10.下列属于取代反应的是( ) A.乙烯与水反应生成乙醇 B.甲烷与氯气反应生成一氯甲烷 C.乙醇与氧气反应生成乙醛 D.乙烯与高锰酸钾溶液反应生成CO2 11.Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( ) 7 A.Y的原子半径比X的大 B.Q的最高价氧化物的水化物的酸性比Z的强 C.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4 D.X、Y和氢3种元素形成的化合物中都只有共价键 12.下列能说明苯环对侧链的性质有影响的是( ) A.甲苯在30℃时与硝酸发生取代反应生成三硝基甲苯 B.甲苯能使热的酸性KMnO4溶液褪色 C.甲苯在FeBr3催化下能与液溴反应 D.1mol甲苯最多能与3 mol H2发生加成反应 13.下图是2SO3(g) ⇌ 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是( ) A.该化学反应过程中既有能量的吸收又有能量的释放 B.2SO3(g) ⇌ 2SO2(g) + O2(g) △H=-(a-b) kJ/mol C.1mol SO2的能量比1mol SO3的能量高 D.若某容器内有2mol SO3充分反应,吸收(a-b) kJ热量 14.一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是( ) A.x=1 B.反应进行到1min时,反应体系达到化学平衡状态 C.2min后,A的正反应速率一定等于A的逆反应速率 D.2min后,容器中A与B的物质的量之比一定为2∶1 15.一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)2HCl(g) + I2(s)。下列事实不能说明该反应达到平衡状态的是( ) A.断裂1 mol Cl-Cl键同时形成1 mol H-Cl键 B.容器内气体密度不再改变 C.容器内气体压强不再改变 D.容器内气体颜色不再改变 16.短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u能使品红溶液退色,v的俗名叫烧碱。上述物质的转化关系如图所示。下列说法正确的是( ) 7 A.原子半径的大小:W>Z>Y>X B.t与r反应时,r为氧化剂 C.生活中可用u使食物增白 D.Z分别与Y、W组成的化合物中化学健类型可能相同 17.下列说法正确的是( ) A.按系统命名法的名称为3,3-二甲基-2-乙基戊烷 B.在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 C.分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种 D.乙烯和苯均能使溴水因发生化学反应褪色 第Ⅱ卷(非选择题) 二、填空题(共有五个小题,除标明以外,每空2分,共49分) 18.Ⅰ.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。 (1)该反应是_____ ______反应(填“吸热”或“放热”)。 (2)△H=________ (用E1、E2表示)。 Ⅱ..有一种燃料电池,所用燃料为H2和空气,电解质为KOH溶液。回答下列问题: (3) OH﹣移向__ ___极(填“正”或“负”)。 (4) 正极反应式为___ __。 Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: (5)从开始至2min,Z的平均反应速率为_______ ____; (6)向其中充入1 mol He(g) (He不参加反应),化学反应速率_______________;(填 “加快”“减慢”或“不变”,) 19.海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。 7 回答下列问题: (1)操作B是 ______________(填实验基本操作名称)。 (2)操作B需加入下列试剂中的一种,最合适的是_________。 a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液 (3)工业上制取金属镁时是电解熔MgCl2电解反应方程式为_____ ____。 (4)上图中虚线框内流程的主要作用是____________。 20.A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。 请回答下列问题: (1)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(),则这种同分异构体的结构简式是:___________________; D物质中官能团的名称是_______________。 (2)反应B→C的化学方程式为________________ ______。 (3)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有_______________(任写一项)。 21.为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验( 夹持仪器 已略去,装置气密性已检验)。 7 实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)浸有NaOH溶液的棉花的作用 。 (2)装置A 中发生的置换反应的化学方程式为___________________。 (3)装置B的溶液中NaBr完全被氧化,则消耗Cl2 的物质的量为_________ ___。 (4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是_____________________。 22.元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题: (1)写出单质R的一种工业用途_______________________。 (2)M和R的最高价氧化物的水化物中酸性最强的是 (用化学式表示)。 (3)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。 (4)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。 (5)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,已知QX5中含有离子键和极性键,写出化合物的电子式_________ 。(3分) 2018年上学期期终考试高一化学参考答案 一. 选择题(每小题只有一个正确答案,3×17=51分) 1—5 C D B B A 6—10 A D D C B 11—15 C B A C A 16—17 D B 7 二.填空题(共五个大题,除标注外,其余每空2分,共49分) 18. (1) 放热 (2) -(E2-E1)或E1﹣E2 (3) 负 (4) O2+2H2O+4e﹣=4OH﹣ (5) 0.05mol/(L·min) (6)不变 19. (1) 过滤 (2) c (3) MgCl2(熔融)Mg + Cl2↑ (4)富集Br2 20. (1) 羧基 (2) 2CH3CH2OH+O22CH3CHO+2H2O (3) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 加入浓硫酸作催化剂、加热等 21. (1) 吸收逸出的Cl2,防止污染环境 (2)Cl2+2KI=I2+2KCl (3) 0.005mol (4)打开活塞b,将装置C中的少量溶液滴入装置D中,然后关闭活塞b,取下装置D振荡, 静置后CCl4 层变为紫红色 22.(1)制漂白粉,制漂白液,自来水消毒等合理答案 (2)HClO4 (3)2SO2+O2 2SO3 (不打可逆符号不给分) (4) HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ (5) (3分) 7查看更多