- 2021-06-19 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学第一轮复习 专题 钠、镁、铝的性质习题 苏教版
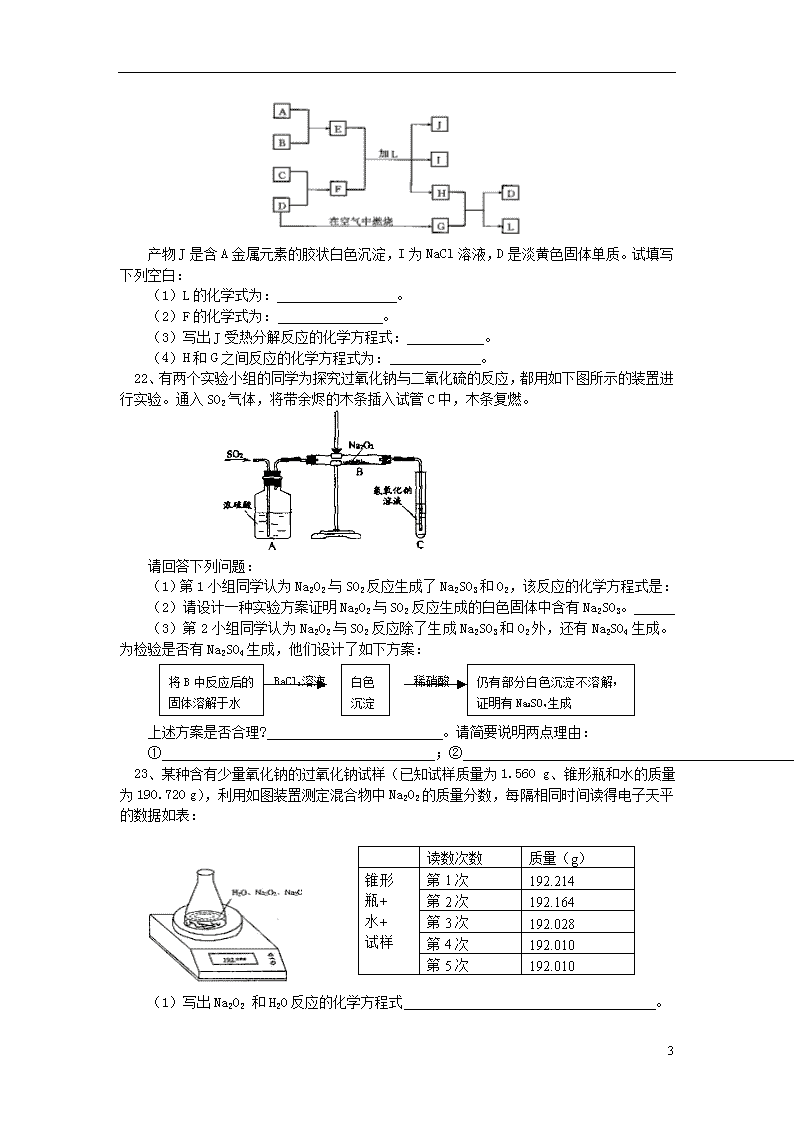
钠、镁、铝的性质 【模拟试题】(答题时间:80分钟) 1、将一块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是: A、钠浮在试管中的液面上 B、钠沉在试管中溶液的底部 C、钠在煤油中燃烧起来 D、钠处于水和煤油的交界处,上下浮动,最后消失 2、金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是: A、BaCl2溶液 B、K2S04溶液 C、FeCl3溶液 D、NH4NO3溶液 3、下列对焰色反应实验操作注意事项说明正确的是: ①K的火焰颜色要透过蓝色的钴玻璃观察; ②先灼烧铂丝到与原来火焰颜色相同时,再蘸被检物质; ③每次实验后要将铂丝用盐酸洗净,并在火焰上灼烧到没有颜色为止; ④没有铂丝可以用光洁无锈的铁丝代替; A、全部正确 B、仅有④不正确 C、仅⑤不正确 D、仅③不正确 4、铷与钠位于同一主族,由钠推知关于铷的性质或用途中不正确的是: A、单质与水反应发生爆炸 B、单质的熔点比钾高 C、氢氧化物的碱性比氢氧化钾要强些 D、单质为银白色 5、将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是: A、Na2CO3 B、Na2O和Na2O2 C、Na2O2 D、Na2O2和Na2CO3 6、下列反应中,Na2O2只表现强氧化性的是: A、2Na2O2+2H2O=4NaOH+O2↑ B、Na2O2+MnO2=Na2MnO4 C、2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑ D、5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+8H2O+5O2↑ 7、有甲、乙、丙三种溶液。甲溶液中加入Na2CO3溶液有白色沉淀生成,再加入乙溶液,沉淀溶解并有气体放出,再加入丙溶液,又有白色沉淀生成。则甲、乙、丙三种溶液依次是: A、CaCl2、稀HNO3、BaCl2三种溶液 B、CaCl2、稀Na2SO4、K2SO4三种溶液 C、BaCl2、稀HNO3、Na2SO4三种溶液 D、CaCl2、稀HCl、Ba(NO3)2三种溶液 8、10gCO和H2组成的混合气体在足量氧气中完全燃烧,立即将全部生成物通入足量的Na2O2中,则固体质量增加: A、10g B、11.8g C、13.2g D、无法计算 9、有KOH和KHCO3混合物26.2g,在250℃下煅烧,冷却后称量,质量减少4.65g,则原混合物中KOH和KHCO3物质的量的大小关系是: A、KOH>KHCO3 B、KOH<KHCO3 C、KOH=KHCO3 D、任意比混合 10、氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出H2。下列叙述正确的是: A、氢化钠是离子化合物,NaH中氢离子H-半径比H+的半径大 B、NaH不论放入水中还是盐酸中都有气体产生 C、NaH中H-可被还原成H2 D、NaH在水中显酸性 11、某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积变小;最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是: 5 A、一定没有N2,CO和HCl中至少有一种 B、一定有N2、HCl和CO C、一定在N2、CO和HCl中至少有一种 D、一定有N2和HCl,一定没有CO 12、用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况): A、O2和H2的混合气体 B、1.12 L H2 C、大于1.12 L H2 D、小于1.12 L气体 13、把铝粉和Fe3O4粉末配成铝热剂并分成两份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是: A、3:4 B、4:3 C、3:8 D、8:3 14、向含有a mol A1C13的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是: ①a mol;②b mol;③mol;④mol;⑤0mol;⑥(4a-b)mol A、①②④⑤⑥ B、①③④⑤⑥ C、①②③⑤⑥ D、①③⑤ 15、向含有0.1mol明矾的溶液中逐滴加入含有0.2molBa(OH)2的溶液中,下面判断正确的应是: A、先出现沉淀而后全部溶解 B、当Al3+和SO42-全部沉淀所得沉淀量最大 C、最后只有BaSO4沉淀 D、最后生成0.1mol Al(OH)3和0.2molBaSO4 16、某混合溶液中含MgCl2的浓度为2mol/L,含AlCl3的浓度为3mol/L,将此溶液200mL中的Mg2+转化为Mg(OH)2沉淀分离出来,至少需要1.6mol/L的NaOH溶液的体积是: A、3.2L B、2L C、1.5L D、1.8L 17、某无色溶液加入铝可以生成氢气, 则在该溶液中不可能大量存在的离子组是: A、K+、Cu2+、NO3-、Cl- B、Na+、K+、SO42-、Cl- C、NH4+、K+、HCO3-、Cl- D、Na+、Ba2+、Br-、Cl- 18、某氯化钙样品中混有氯化铁、氯化镁、氯化钠和碳酸钠中的一种或两种杂质。取11.1g样品溶解,得无色溶液,再加入足量的硝酸银溶液,得到29.7g沉淀。样品所含杂质的正确结论是: A、一定无碳酸钠,可能有氯化铁 B、可能有碳酸钠和氯化钠 C、一定有氯化镁,可能有氯化钠 D、一定有氯化钠 19、某无色透明溶液与铝反应放出H2,该溶液中可能含有大量的:H+、K+、Mg2+、Cl-、OH-、NO3-、CO32-等离子,试推断: 第一种情况:一定有 离子,可能有 离子。 第二种情况:一定有 离子,可能有 离子。 20、在50mL b mol/L AlCl3溶液中加入50mL a mol/L NaOH溶液。 (1)当a≤3b时,生成Al(OH)3沉淀的物质的量为 ; (2)当a、b满足 条件时,无沉淀生成。 (3)当a、b满足 条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为 克。 21、如图所示,每一方框中的字母代表一种反应物或生成物: 5 产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白: (1)L的化学式为: 。 (2)F的化学式为: 。 (3)写出J受热分解反应的化学方程式: 。 (4)H和G之间反应的化学方程式为: 。 22、有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。 请回答下列问题: (1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是: (2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。 (3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案: 上述方案是否合理? 。请简要说明两点理由: ① ;② 。 23、某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为 190.720 g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表: (1)写出Na2O2 和H2O反应的化学方程式 。 5 (2)计算过氧化钠质量分数时,必需的数据是 。不必作第6次读数的原因是 。 (3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下: ①操作Ⅱ的名称是 。 ②需直接测定的物理量是 。 ③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 。(固定、夹持仪器除外) ④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。 24、现有等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。 (1)混合物中NaHCO3与KHCO3的质量比为 (2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 (3)如果盐酸过量,生成CO2的体积为 (4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。 (5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积范围是 25、将一定质量的Mg,Al合金全部溶解在500mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。 (1)求Mg,Al的质量各是多少? (2)求盐酸的物质的量浓度为多少? 【试题答案】 1、D 2、C 3、A 4、B 5、A 6、B 7、C 8、A 9、B 10、AB 11、C 12、C 13、A 14、B 15、C 16、B 17、AC 18、C 19、第一种情况:H+、Cl-;K+、Mg2+;第二种情况:OH-、K+;Cl-、NO3-、CO32-。 20、(1)0.0167a mol (2)a≥4b (3)3b<a<4b 15. 6b-3.9a 21、(1) H2O (2)Na2S (3)2 Al(OH)3 Al2O3 + 3 H2O (4)2H2S + SO2 = 3S + 2H2O 22、(1)2Na2O2+2SO2=2Na2SO3+O2 (2)取白色固体,加稀H2SO4,产生能使品红溶液褪色的气体。 5 (3)不合理 ① 稀硝酸能将亚硫酸钡氧化为硫酸钡 ② 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。 23、(1)2Na2O2 +2H2O = 4NaOH +O2↑;(2)第4(或5)次试样质量、锥形瓶加水的质量。第4、5次读数相同,此时时锥形瓶内质量已达恒重。(3)①蒸发;②NaCl的质量;③烧杯、玻璃棒;④偏大。 24、(1)84:100 (2)5a/46 (3)22.4a/92或5.6a/23 (4)盐酸的物质的量浓度 (5)(22.4/100) a~(22.4/84)a 25、(1)Mg 3.6 Al 2.7 (2)1.4mol/L 5查看更多