- 2021-06-19 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河南省郑州市106中学2019-2020学年高二9月月考(理)试题(解析版)
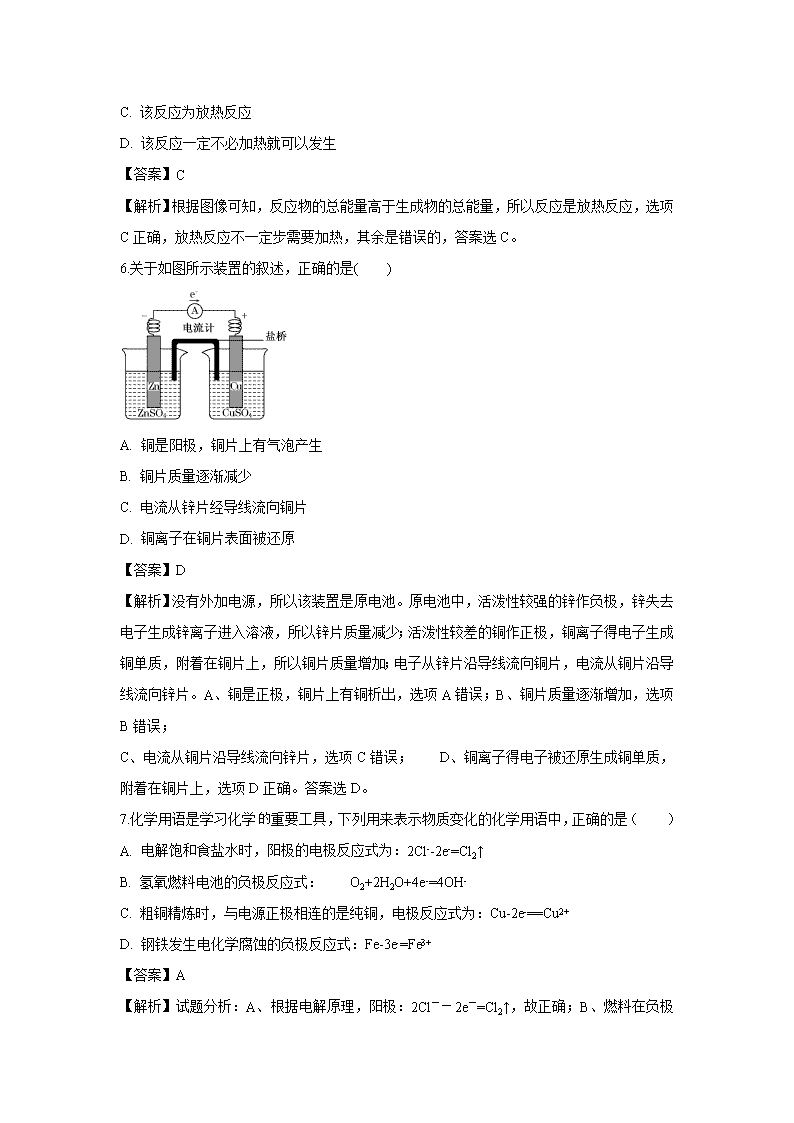
河南省郑州市106中学2019-2020学年高二9月月考(理)试题 一、单项选择题(本题包括13小题,每题4分,共52分) 1. 在生产和生活中,人们早已广泛利用化学反应释放的能量。下列说法正确的是( ) A. 物质发生化学变化并不一定都伴随着能量变化 B. 有能量变化的都是化学变化 C. 用实验方法和理论方法研究反应热的化学称为热化学 D. 任何反应中的能量变化都表现为热量变化 【答案】C 【解析】试题分析:A、任何化学反应都伴随能量变化,故错误;B、有能量变化不一定是化学变化,如灯泡发光,故错误;C、有反应热的化学,是热化学,故正确;D、能量变化主要以热量释放,有时也以电能和光能形式释放,故错误。 2.通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知 化学健 H-H Cl-Cl H-Cl 键能 436 kJ/mol 243 kJ/mol 431 kJ/mol 则下列热化学方程式不正确的是( ) A. 1/2 H2(g)+1/2Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1 B. H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1 C. 2HCl(g)=H2(g)+Cl2(g) ΔH=+183 kJ·mol-1 D. 1/2 H2(g)+1/2Cl2(g)=HCl(g) ΔH=+91.5 kJ·mol-1 【答案】D 【解析】试题分析:化学反应的实质是旧化学键断裂,和新化学键生成,断键吸收热量,形成化学键放出热量,根据化学反应,H2(g)+Cl2(g)=2HCl(g) ΔH=436+243-2×431=-183 kJ·mol-1,对于热化学方程式来说,系数减倍,焓变减倍,则1/2 H2(g)+1/2Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1,A、B项正确,D项错误;若反应逆向进行,焓变数值相等,符号相反,则2HCl(g)=H2(g)+Cl2(g) ΔH=+183 kJ·mol-1,C项正确;答案选D。 3.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( ) A. 此腐蚀过程有化学腐蚀也有电化学腐蚀 B. 发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH- C. 在化学腐蚀过程中有氢气产生 D. 发生电化学腐蚀时的负极反应为Fe-2e-=Fe2+ 【答案】B 【解析】 【详解】A. 此腐蚀过程有化学腐蚀也有电化学腐蚀,以电化学腐蚀为主,A正确; B. 在弱酸性环境中铁发生的析氢腐蚀,故正极为2H++2e-=H2↑,B错误; C. 铁与氢离子发生置换反应生成氢气,在化学腐蚀过程中有氢气产生,C正确; D. 发生电化学腐蚀时铁是负极,负极反应为Fe-2e-=Fe2+,D正确; 答案选B。 4.已知:2Zn(s)+O2(g)=2ZnO(s)△H= —701.0kJ·mol-1 ,2Hg(l)+O2(g)=2HgO(s)△H= —181.6kJ·mol-1,则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( ) A. -259.7 kJ·mol-1 B. +259.7 kJ·mol-1 C. +519.4kJ·mol-1 D. -519.4kJ·mol-1 【答案】A 【解析】 【详解】①2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ•mol-1,②2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ•mol-1,依据盖斯定律,将①-②得到:2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l) △H=-519.4kJ/mol,则反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)△H=-259.7kJ/mol,故选A。 5. 如图为某反应的焓变示意图,下列有关该反应的说法中正确的是( ) A. ΔH>0 B. X能量一定高于M C. 该反应为放热反应 D. 该反应一定不必加热就可以发生 【答案】C 【解析】根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,选项C正确,放热反应不一定步需要加热,其余是错误的,答案选C。 6.关于如图所示装置的叙述,正确的是( ) A. 铜是阳极,铜片上有气泡产生 B. 铜片质量逐渐减少 C. 电流从锌片经导线流向铜片 D. 铜离子在铜片表面被还原 【答案】D 【解析】没有外加电源,所以该装置是原电池。原电池中,活泼性较强的锌作负极,锌失去电子生成锌离子进入溶液,所以锌片质量减少;活泼性较差的铜作正极,铜离子得电子生成铜单质,附着在铜片上,所以铜片质量增加;电子从锌片沿导线流向铜片,电流从铜片沿导线流向锌片。A、铜是正极,铜片上有铜析出,选项A错误;B、铜片质量逐渐增加,选项B错误; C、电流从铜片沿导线流向锌片,选项C错误; D、铜离子得电子被还原生成铜单质,附着在铜片上,选项D正确。答案选D。 7.化学用语是学习化学重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ B. 氢氧燃料电池的负极反应式: O2+2H2O+4e-=4OH- C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-==Cu2+ D. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+ 【答案】A 【解析】试题分析:A、根据电解原理,阳极:2Cl--2e-=Cl2 ↑,故正确;B、燃料在负极上参加反应,氧气在正极上参加反应,故错误;C、精炼铜,粗铜作阳极,纯铜作阴极,故错误;D、电化学腐蚀中Fe-2e-=Fe2+,故错误。 8.把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨做电极进行电解,阳极生成的物质是( ) A. H2 B. Ag C. Cl2 D. O2 【答案】D 【解析】试题分析:物质的量相等,发生NaCl+AgNO3=AgCl↓+NaNO3,反应后溶质为Na2SO4和NaNO3,根据电解原理,电解水,阳极上发生:4OH--4e-=O2↑+2H2O,故选项D正确。 9. 下列说法正确的是( ) A. 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 B. 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 C. 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 D. 无论哪种类型的腐蚀,其实质都是金属被还原 【答案】C 【解析】试题分析:A、钢铁中因含杂质,容易形成原电池,发生电化学腐蚀,并不是所有合金都不耐腐蚀,如不锈钢,故错误;B、让金属作正极,可以避免腐蚀,故错误;C、钢铁电化学腐蚀分为吸氧腐蚀和析氢腐蚀,故正确;D、金属化合价升高,被氧化,故错误。 10. 下列说法或表示方法正确的是( ) A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 B. 由“C(石墨)==="C(金刚石)" ΔH=1.9 kJ·mol”可知,金刚石比石墨稳定 C. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol D. 在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol ,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ 【答案】D 【解析】试题分析:A.硫蒸汽的能量高于硫固体的能量,因此若将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,A错误;B.由“C(石墨)===C(金刚石) ΔH=+1.9 kJ·mol”可知金刚石总能量高于石墨,能量越低越稳定,石墨比金刚石稳定,B错误;C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2 (g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ/mol,C错误;D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ/mol ,若将含1 mol H2SO4与含2 mol NaOH的溶液混合生成2mol水,放出的热量等于2mol×57.3 kJ/mol =114.6 kJ,D正确,答案选D。 11.烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( ) A. A为原电池 B. B为电解池 C. 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol D. 一段时间后,B烧杯中溶液的浓度增大 【答案】D 【解析】 【分析】由图可知,A池中Fe、C与稀硫酸构成原电池,铁为原电池负极,铁失电子发生氧化反应,C为原电池正极,氢离子在正极上得电子发生还原反应,B池为电解池,与铁极相连的一极为阴极,铜离子在阴极上得电子发生还原反应,与C极相连的一极为正极,氯离子在阳极上失电子发生氧化反应。 【详解】A项、由图可知,A池中Fe、C与稀硫酸构成原电池,故A正确; B项、由图可知,A池为原电池,A池、B池相连,B有外接电源,所以B为电解池,故B正确; C项、A中C上有氢气生成,其电极反应式为:2H++2e-=H2↑,当A烧杯中产生0.1mol气体时,转移0.2mol电子,B中阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑,当转移0.2mol电子时,生成氯气为0.1mol,所以A和B中生成气体的物质的量相同,故C正确; D项、B池为惰性电极电解电解氯化铜溶液,实际上是电解氯化铜,所以一段时间后,B烧杯中溶液的浓度会减小,故D错误; 故选D。 12.燃料电池是燃料(如CO、H2、CH4)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( ) A. 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 B. 负极的电极反应式为CH4+10OH--8e-=CO32—+7H2O C. 随着反应的进行,电解质溶液的pH保持不变 D. 甲烷燃料电池的能量利用率比甲烷燃烧的大 【答案】C 【解析】试题分析:A、燃料电池,燃料在负极上失电子,发生氧化反应,氧气在正极得电子,发生还原反应,故说法正确;B、电解质为KOH溶液,因此电极反应式为CH4+10OH--8e-=CO32-+7H2O,故说法正确;C、KOH被消耗,pH降低,故说法错误;D、燃料电池的能量利用高于燃烧,故说法正确。 13.某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2下列推断中正确的是( ) ② 放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中 A. ①②③ B. ②③④ C. ①②④ D. ①③④ 【答案】B 【解析】试题分析:①放电时,属于原电池,化合价升高为负极,化合价升高为正极,铁的化合价升高,为负极,Ni2O3为正极,故错误;②充电时为电解池,电极反应为电池的负极的逆过程,负极反应式为:Fe+2OH--2e-=Fe(OH)2,则阴极反应:Fe(OH)2+2e-=Fe+2OH-,故正确;③充电时,电池的正极接电源的正极,电池的负极接电源的负极,即Ni(OH)2接电源的阳极,故正确;④根据②,推出必须浸在某种碱性电解质溶液,故正确;故选项B正确。 二、非选择题(每空3分,共48分) 14.(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。 (2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。 (3)如图是一个电解过程示意图。 ①锌片上发生的电极反应式是:____________ ②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。 【答案】(1). 173.4 (2). O2+4e-+2H2O=4OH- (3). N2H4+4OH--4e-=4H2O+N2↑ (4). Cu2++2e-=Cu (5). 112 【解析】 【分析】(1)依据盖斯定律得CH4还原NO2至N2热化学方程式,再依据甲烷的体积和热化学方程式计算可得; (2)肼一空气燃料电池中,碱性条件下,燃料肼在负极放电,氧气在正极放电; (3)①锌与电源的负极相连,作阴极; ②依据得失电子数目守恒计算可得。 【详解】(1)将已知热化学方程式依次编号为①②,由盖斯定律可知①×+②×可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),则△H=(-574 kJ·mol-1)×+(-1160 kJ·mol-1)×=-867kJ·mol-1,标准状况下4.48LCH4的物质的量为=0.2mol,由所得热化学方程式可知放出的热量为0.2mol×867kJ·mol-1=173.4kJ,故答案为:173.4; (2)肼一空气燃料电池中,碱性条件下,燃料肼在燃料电池负极上失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,氧气在燃料电池正极上得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;N2H4+4OH- -4e-=4H2O+N2↑; (3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu; ②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是×2=4mol,由电子得失守恒可知燃料电池消耗氧气的物质的量是1mol,标准状况下的体积是22.4L,则需要空气的体积是=112L,故答案为:112。 15.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。 (1)下列哪个装置可防止铁棒被腐蚀___________。 (2)实际生产可在铁件表面镀铜防止铁被腐蚀.装置示意图如图.请回答: ①A电极对应的金属是________(写元素名称),B电极的电极反应式是_________。 ②镀层破损后,镀铜铁和镀锌铁中更容易被腐蚀的是___________。 A 镀铜铁 B 镀锌铁。 【答案】(1). BD (2). 铜 (3). Cu2++2e-=Cu (4). A 【解析】 【分析】(1)由牺牲阳极的阴极保护法可知,铁作电池的正极,正极铁被保护;由外加直流电源的阴极保护法可知,铁作电解池的阴极,阴极铁被保护; (2)①在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,作阴极的是待镀金属铁; ②镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极。 【详解】(1)A装置中,金属铁作原电池的负极,腐蚀速率加快,更易被腐蚀;B装置中,比铁活泼的锌作原电池的负极,正极铁被保护;C装置中,金属铁在水中发生吸氧腐蚀,会被腐蚀;装置D中,铁与电源负极相连,阴极铁被保护,BD可防止铁棒被腐蚀,故答案为:BD; (2)①在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,作阴极的是待镀金属铁,该极上金属铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:铜;Cu2++2e-=Cu; ②镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁正极,在原电池中,负极金属更易被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,故答案为:A。 16. 请按要求回答下列问题。 (1)根据图1回答①②: ①若断开K2,闭合K1。 A电极可观察到的现象________________________________________________; B极的电极反应式为__________________________________________________。 ②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。 (2)根据图2回答③④: ③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。 ④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。 【答案】(1)①锌不断溶解Cu2++2e-=Cu ②锌极镀上一层红色的铜Cu-2e-=Cu2+ (2)①4OH--4e-=2H2O+O2↑ 2Cu2++2H2O2Cu+O2↑+4H+ ②0.175a 【解析】(1)①断开K2,闭合K1,则构成原电池。Zn为负极,失去电子变为Zn2+进入溶液;Cu为正极,其电极反应式为Cu2++2e-=Cu。②断开K1,闭合K2,则构成电解池,A极为阴极,有红色铜在Zn极表面析出;B极为阳极,Cu失去电子变成Cu2+进入溶液。 (2)①图2中石墨为阳极,其电极反应式为4OH--4e-=2H2O+O2↑,总电解反应式为 2Cu2++2H2O2Cu+O2↑+4H+。 ②根据转移电子守恒得, ×2=×4 V=0.175a L。查看更多