- 2021-06-19 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省鸡泽县第一中学2019-2020学年高二上学期期末复习化学试卷
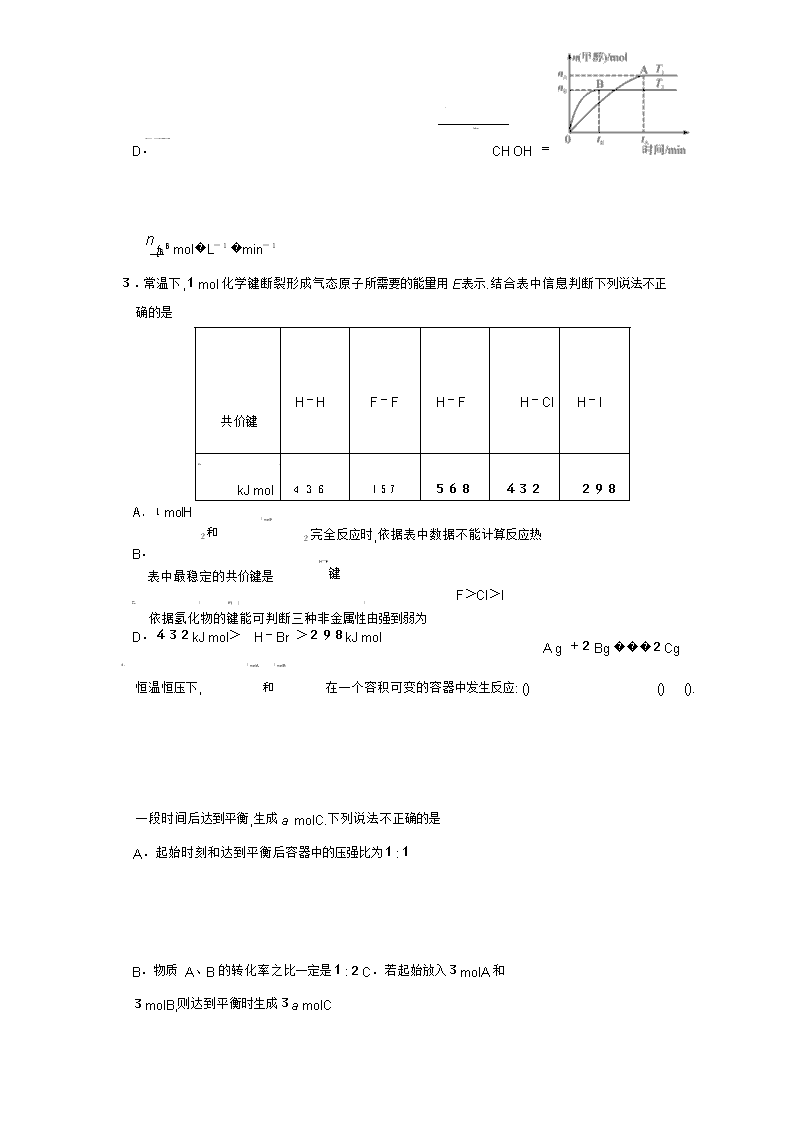
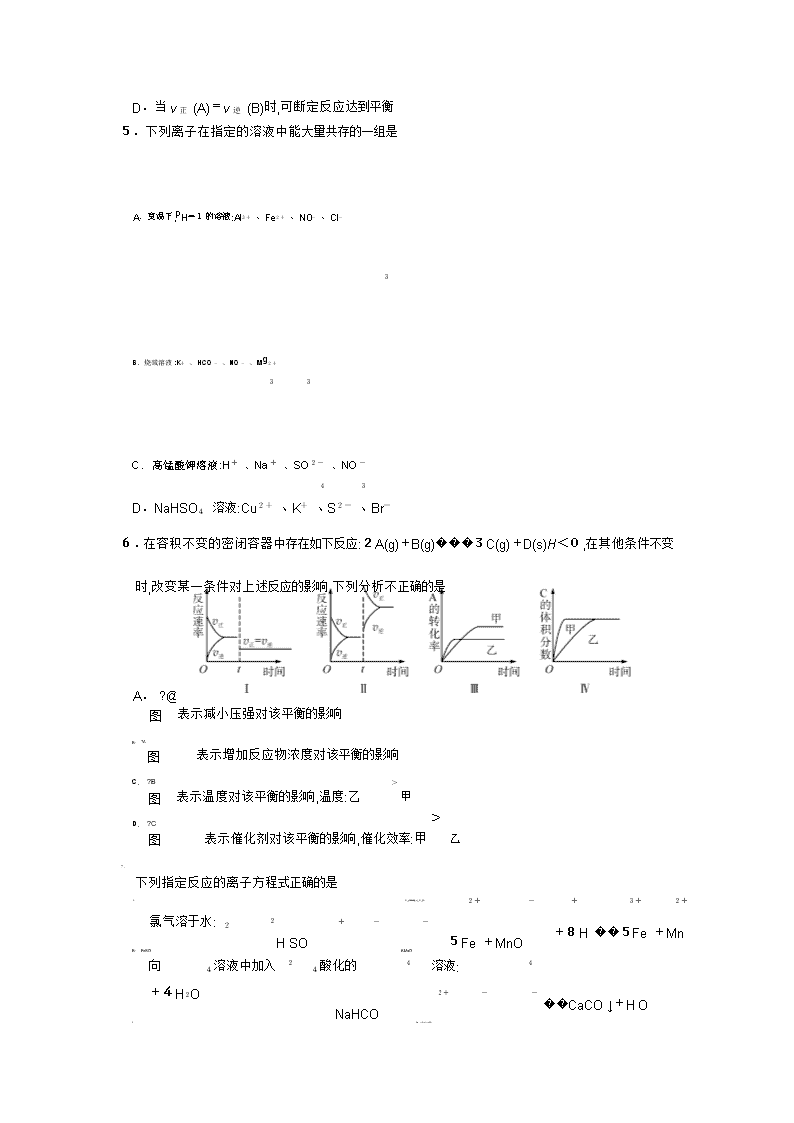
化学试题 考生注意: 1.本卷分第?@卷(选择题)和第?A卷(非选择题)两部分.满分100分,考试时间90分钟.2.答卷前,考生务必将密封线内的项目填写清楚. 3.请将第?@卷的答案填在第?A卷前面的答题表中.第?A卷用黑色墨水签字笔答题. 题号 第 Ⅰ 卷 第 Ⅱ 卷 总 分 合分人 复分人 17 18 19 20 21 得分 H1 C12 N14 O16 可能用到的相对原子质量: 第Ⅰ卷(选择题 共48分) 一、选择题(本题共16题,每小题3分,共48分.每小题只有一个选项符合题意) 下列变化过程中,生成物总能量高于反应物总能量的化学反应是 1. 氧化钙溶于水 A. 铝粉与氧化铁粉末在高温下反应 B. ( 2 2 晶体与 4 晶体反应 )� NH Cl C.Ba OH 8H O D.NH4NO3 熔化为液态 在容积为 的恒容密闭容器中加入 2 和 发生反应 2 2 3 2. 2L , 2, 1molCO 3molH CO +3H ���CH OH+ 2 . 在其他条件不变的情况下 温度对反应的影响结果如图所示 注 均大于 ). 下 , ( :T1、T2 300℃ H O 列说法正确的是 2转化率为x,则容器内的压强与起始 T1下,若反应达到平衡后 A. x) CO 压强之比为( 2- ∶2 该反应在 时的平衡常数比 时的小 n( 2) B. T1 T2 处于 点的反应体系从 T1 变到 达到平衡时 CO 减小 C. A T2, n 3 ) ( CH OH ) T2下,反应达到平衡时生成甲醇的平均速率为v( 3 D. CH OH = ntBB mol�L-1�min-1 3.常温下,1mol化学键断裂形成气态原子所需要的能量用E 表示.结合表中信息判断下列说法不正确的是 共价键 H-H F-F H-F H-Cl H-I E/( / ) 436 157 568 432 298 A.1molH kJ mol 2和 1molF B. 2完全反应时,依据表中数据不能计算反应热 H-F 键 表中最稳定的共价键是 F>Cl>I C. / E( ) / 依据氢化物的键能可判断三种非金属性由强到弱为 D.432kJ mol> H-Br >298kJ mol A g +2Bg ���2Cg 4. 1molA 和 1molB 恒温恒压下, 在一个容积可变的容器中发生反应: () () (). 一段时间后达到平衡,生成a molC.下列说法不正确的是A.起始时刻和达到平衡后容器中的压强比为1∶1 B.物质 A、B的转化率之比一定是1∶2C.若起始放入3molA和3molB,则达到平衡时生成3a molC D.当v正 (A)=v逆 (B)时,可断定反应达到平衡 5.下列离子在指定的溶液中能大量共存的一组是 A.室温下,pH=1的溶液:Al3+ 、Fe2+ 、NO- 、Cl- 3 B.烧碱溶液:K+ 、HCO- 、NO- 、Mg2+ 3 3 C.高锰酸钾溶液:H+ 、Na+ 、SO2- 、NO- 4 3 D.NaHSO4 溶液:Cu2+ 、K+ 、S2- 、Br- 6.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)���3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述反应的影响.下列分析不正确的是 A. ?@ 表示减小压强对该平衡的影响 图 B. ?A 表示增加反应物浓度对该平衡的影响 图 C. ?B 表示温度对该平衡的影响,温度:乙 > 甲 图 > D. ?C 表示催化剂对该平衡的影响,催化效率:甲 乙 图 7. 下列指定反应的离子方程式正确的是 2+ - + 3+ 2+ A. Cl+H O���2H +Cl +ClO 氯气溶于水: 2 2 H SO + - - 5Fe +MnO +8H ��5Fe +Mn B. FeSO KMnO 向 4溶液中加入 2 4酸化的 4 溶液: 4 +4H2O NaHCO 2+ - - ��CaCO ↓+H O C. Ca +OH +HCO 向少量澄清石灰水中加入足量的 3溶液: 3 3 2 D. NaCl 电解 2Cl +2H O��H ↑+Cl↑+2OH 用铜做电极电解 溶液: - 2 2 2 - 8. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度 下使其达到分解平衡: 2 4 3() 2(),H a / (a ). 然后 NH COONH ���2NH g +CO g = kJ mol >0 在恒定温度下缩小容器体积,重新达到平衡.下列分析正确的是 A.两次平衡时,后一次平衡时c(CO2)的浓度大B.若v (NH3)=2v(CO2),则该反应达到平衡状态 C.若开始时向容器中加入2molNH3和1molCO2,则达到平衡时放出akJ热量 D.重新达到平衡,密闭容器中氨气的体积分数不变 9.1molH2和1molI2置于恒温恒容密闭容器中发生反应:H2(g)+I2(g)���2HI(g) H = -9�4kJ/mol,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是 A B C D 10.下列说法不正确的是A.pH<7的溶液不一定呈酸性 B.氨水和盐酸反应后的溶液,若c(Cl- )=c(NH+ ),则溶液呈中性 4 C.在相同温度下,pH 相等的盐酸、CH3COOH 溶液,c(Cl- )=c(CH3COO- ) D.在相同温度下,物质的量浓度相等的氨水、NaOH 溶液,c(OH- )相等 11.化学与社会、生活密切相关.对下列现象或事实的解释正确的是 选项 现象或事实 解释 A FeCl3溶液可用于铜质印刷电路板制作 FeCl3能从含有 Cu2+ 的溶液中置换出铜 B 漂白粉在空气中久置变质 漂白粉中的 CaCl2 与空气中的 CO2 反应生 成 CaCO3 施肥时,草木灰(有效成分为 K CO K CO NH Cl 因水解生成氨气,会降低 C 2 3)不能与 2 3 、 4 NH4Cl混合使用 肥效 D 用热的烧碱溶液洗去油污 Na2CO3 可直接和油污反应 12.已知:pKa=-lgKa.25℃时,几种弱酸的pKa值如下表所示.下列说法正确的是 弱酸的化学式 CH3COOH HCOOH H2SO3 pKa 4�74 3�74 pKa1=1�90 pKa2 =7�20 A.25℃时,pH=8的甲酸钠溶液中,c(HCOOH)=9�9×10-7 mol�L-1 B.向 Na2SO3溶液中加入过量乙酸,反应生成SO2 C.相同温度下,等浓度的 HCOONa溶液比 Na2SO3溶液的pH 大 D.25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1 13.臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)���N2O5(g)+O2(g).若此反应在恒容密闭容器中进行,相关图像如下列选项,其中对应分析、结论正确的是 A B C D c NO2 / mol·L-1 2/ v 0.8 v a b v v 2NO2 g +O3 g 0.4 v N2O5 g +O2 g O 2 t/s / O t1 t/s NO 0~2s O b >a 恒温,t1 时再充入 3 平衡后升温, 2 含量 内,v( 3) v正 : 点 > 点 O =0.2mol L s b 点:v逆 降低 � -1� -1 v正 14.在25mL0�1mol�L-1某一元碱中,逐滴加入0�1mol�L-1 醋酸,滴定曲线如图所示.则下列说法不正确的是 A.该碱溶液可以溶解 Al(OH) 3 B.a点对应的体积值大于25mL C.C 点时,c(CH3COO- )>c(Na+ )>c(H+ )>c(OH- ) D.D 点时,c(CH3COO- )+c(OH- )=c(H+ )+c(CH3COOH) 15.常温下,将 NaOH 溶液分别加到 HA、HB两种弱酸溶液中,两溶液中pH 与粒子浓度比值的 对数关系如图所示,已知pK=-lgKa.下列有关叙述错误的是 A.HA、HB两种酸中,HB的酸性弱于 HA B.b点时,c(B- )=c(HB)>c(Na+ )>c(H+ )>c(OH- ) C.同浓度同体积的 NaA和 NaB溶液中,阴离子总数相等 D.向 HB溶液中加入 NaOH 溶液所得的混合溶液中cc((BHB-))=10(pH-pK) 16.某电池的简易装置如图所示,a、b、y、x电极材料均为惰性电极,分别从 A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是 A.a电极反应式为C2H5OH+12OH- -12e- =2CO2↑+ 9H2O B.AlCl3溶液中的总反应为2Cl- +2H2O=Cl2 ↑+H2 ↑ +2OH- C.反应开始后,观察到x电极附近出现白色沉淀 D.左侧电池每通入32gO2,右侧电解池共生成2mol气体 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 第Ⅱ卷 (非选择题 共52分) 二、(本大题有5小题,共52分) ( 分)利用所学化学反应原理,解决以下问题: 17.12 2 2 可做净水剂 其原理是 用 () ( 4)� , ( 1 KAlSO 12H O 离子方程式表示). (填化学式). ()碳酸氢钠溶液蒸干并灼烧得到的固体物质是 2 ()向 3溶液中滴加 3溶液,有沉淀和气体生成的离子方程式 . 3 FeCl NaHCO (4)将AgCl分别放入??5mLH2O ??10mL0�2mol�L-1 MgCl2溶液 ??20mL0�5mol�L-1 NaCl溶液 ??40mL0�1mol�L-1 HCl溶液中溶解至饱和,各溶液中Ag+ 的浓度由大到小的 顺序是 (用序号填空). ()常温下 / 稀溶液等体积混合:若c( + ) a / 3 稀溶液和b 5 3 molLCH COOH molLKOH K < c( - ),则a b(填“ ”“ ”或“ ”). CH COO > < = ()室温下, / 相同体积的下列四种溶液: 3 2 3 中,所 6 1molL ??KCl ??FeCl ??HF ??NaCO 含阳离子数由少到多的顺序是 (用序号填空). ( 分), 二氯丙烷( 2 3)是重要的化工原料,工业上可用丙烯加成法制得,主 18.8 12G CH ClCHClCH 要副产物为 氯丙烯( 2 2 ),反应原理为: 2 3G CH �CHCH Cl 3() H1 � -1 3() 2() 2 ?@.CH �CHCH g +Cl g ���CH ClCHClCH g =-134kJ mol -1 2 3() 2() 2 2 () () H2 � ?A.CH �CHCH g +Cl g ���CH �CHCHCl g +HClg =-102kJ mol 已知相关化学键的键能数据如下表所示: 化学键 C�C C—C C—Cl Cl—Cl E/( � -1) 611 x 328 243 kJ mol 回答下列问题: . ()由反应 ?@ 计算出表中x = 1 (2)一定温度下,密闭容器中发生反应?@和反应?A,达到平衡后增大压强,CH2ClCHClCH3的产率 (填“增大”“减小”或“不变”). (3)T1 K时,向10L恒容密闭容器中充入1molCH2�CHCH2Cl和2molHCl,只发生反应CH2�CHCH2Cl(g)+HCl(g)���CH2ClCHClCH3(g) H3.5min时反应达到平衡,测得0~5 min内,用 CH2ClCHClCH3 表示的反应速率v(CH2ClCHClCH3)= 0�016mol�L-1 �min-1.保持其他条件不变,6 min 时再向该容器中充入0.6mol【单元 CH �CHCH Cl0�2molHCl 0�1molCH ClCHClCH HCl 2 2 、 和 2 3,则起始反应速率v正 ( ) (填“>”“<”或“=”)v逆 (HCl). .设起始的 4 n( 2 3) CH �CHCH Cl ?A ()一定压强下,向密闭容器中充入一定量的 2 3 和 2 发生反应 CH �CHCH w 平衡时 2 的体积分数 ? 与温度 T w 的关系如图甲所示 . n = , ( ) ( )、 Cl ( 2) Cl w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示. φ Cl2 /% w1=1 w2 O T/K K A B O T1 T/K ?? 图甲中,w2 (填“ ”“ ”或“ ”). > < = 1 ?? 图乙中,表示正反应平衡常数的曲线为 A B (填“ ”或“ ”). ?? K Cl = . T1 下,平衡时?( 2) 19.9 ?BA 族元素 B Ga 的单质及其化合物在生产、生活中应用广泛. ( 分)第 、 1 HBF ()氟硼酸( 4)是一种强酸,可以用于金属表面氧化物、硅酸盐膜的清洁,常温下, 0�01mol L HBF pH H BO � -1 4 溶液的 为 .硼酸( 3 3)是一种白色片状晶体,微 溶于水,对人体的受伤组织有着温 硼酸是一元弱酸,室温时 和的防腐消毒作用. 0�1mol L pH 5 H BO = ,向饱和硼 � -1硼酸的 为 ,则硼酸的电离常数 Ka( 3 3) 0�1mol L NaCO (填“能”或“不能”)观察到气泡逸 酸溶液中滴加 � -1的 2 3 溶液, 出.[已知:Ka( 2 3) -7,Ka( 3- ) -11] 2 H CO =4�4×10 HCO =4�7×10 ()金属镓是一种广泛用于电子工业和通讯领域的重要金属. ??将一块镓铝合金完全溶于烧碱溶液中得到溶液 X.已知: ( ) ( ) AlOH 3 Ga OH 3 a 2?10 1?10 酸式电离常数 K -11 -7 碱式电离常数 Kb 1�3?10-33 1�4?10-34 往溶液 X中缓缓通入CO2,最先析出的氢氧化物是 . ??工业上以电解精炼法提炼镓的原理示意图如右,粗镓中含Zn、Cu杂质.以 NaOH 溶液为电解质溶液,在电流作用下使粗镓溶解进入电解质溶液,在阴极析出高纯镓.已知离子氧化性顺序为 2+ 3+ 2+ .粗镓为 (填“”或“”)极, 2- Zn <Ga <Cu a b GaO 在阴极放电的电极反应式是 . 20.10 ( 分)铁及其化合物在生产、生活中有广泛的应用. 1 MnFeO ()复合氧化物铁酸锰( 2 4)可用于热化学循环分解制氢气,原理如下: ??MnFeO s ��MnFeO s + 2O g 2 4() 2 (4-x)() x/ 2() H1 g ??MnFeO s + H O g ��MnFeO s + H 2 2 (4-x)() x 2 () 2 4() x 2() H2 () 2() 2() H3 ??2H O g ��2H g +O g . 则:H3与 H1、H2 的关系为 H3= (2)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂.高铁酸钾在酸性至弱碱性条件下不 稳定. ( 3) , ?? 工业上用 KClO 与 FeNO 溶液反应制得 KFeO 反应的离子方程式为 3 2 4 . 2 4 , ( 3) 制备 KFeO 时 KClO 饱和溶液与 Fe NO 3 饱和溶液混 合的操作为 . ??已知 K2FeO4在水解过程中铁元素形成的微粒分布分数与pH 的关系如图所示. 向pH=6的溶液中加入 KOH 溶液,发生反应的离子方程式为 3 . . KFeO ()电解法可制得 2 4,装置如图所示.阳极的电极反应式为 21.13 NO NO NO NO ( 分) x(主要指 和 2)是大气主要污染物之一.有效去除大气中的 x 是环境 保护的重要课题. 2() () H � -1 ()已知: 2() 1 N g +O g ��2NO g =+180�5kJ mol () 2() 2() H � -1 Cs +O g ��CO g =-393�5kJ mol () 2() () H � -1 2Cs +O g ��2CO g =-221kJ mol )�c2( )],请写出此反 若某反应的平衡常数表达式为K c( 2)�c2( 2)/[c2( = N CO NO CO 应的热化学方程式 . 2 NO HNO HNO ()用稀硝酸吸收 x ,得到 3和 2的混合溶液,电解该混合溶液可获得较浓的硝 酸.写出电解时阳极的电极反应式: . 3 NO L NH NO 25℃ 时,将a molNH NO 溶液,溶液显 () 2用氨水吸收能生成 4 3, 4 3溶于水配成b 酸性的原因是 (用离子方程式表示),常温下向该溶液通入 L 氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将 (填“正 标准状况下V 向”“不”“逆向”)移动,通入标准状况下氨气的体积为 L(设通入氨气后溶液的体 积不变,用含a的代数式表示,已知常温下 NH 2�0×10 H O 3� 2 的电离平衡常数为 -5) 4 NO 是在一定条件下,用 NH NO 污染,其反应原理为 4NH + ()催化氧化法去除 3 消除 3 催化剂 NH ∶ NO 6NO�����5N +6H O 加热 2 2 不同温度条件下,n( 3) n( )的物质的量之比分别为 4∶13∶11∶3 时,得到 NO 脱除率曲线如图所示: 、 、 ??由图可知,无论以何种比例反应,在温度超过900℃时 NO 脱除率都会骤然下降的原因可能是 6×10 mgm A B ?? a NO 从 点到 点经 . 的起始浓度为 -4 3 曲线 中 / , /( � ). 过 , NO 0�8s 该时间段内 的脱除速率为 mg m s 3 . ?? c NH NO 曲线 对应 3与 的物质的量之比是查看更多