2018-2019学年河南省信阳高级中学高二上学期期末考试化学试题 word版
信阳高中2020届高二上学期期末考试化学试题
时间:90分钟 分数:100分
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 Mg 24 S 32 Fe 56
一、选择题(每小题只有一个选项符合题意, 19小题,每小题3分,共57分)
1.平昌冬奥会“北京8 分钟”主创团队用石墨烯制作了-20℃能发热4 h 的智能服饰; 用铝合金管材和碳纤维制作了高2.35m、重量仅为10kg 的熊猫木偶,向世界展现了新时代的中国形象。下列说法中,不正确的是
A.石墨烯是能导热的金属材料 B.铝合金是密度较低的金属材料
C.碳纤维是耐低温的无机非金属材料 D.新型材料种类多、用途广
2.环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷()是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体 B.1mol该化合物完全燃烧时消耗10molO2
C.所有碳原子均处同一平面 D.一氯代物共有 3 种(不含立体异构)
3.下列说法正确的是
A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,说明HNO3 分解生成了NO2
B.高温下FeSO4发生如下反应:2FeSO4Fe2O3+SO2↑+SO3↑,将生成的气体通 入BaCl2溶液中,得到的沉淀物是BaSO3和BaSO4
C.在铁和铜的混合物中,加入一定量的稀硝酸,反应后剩余金属m1g;再向其中加入 一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1可能等于m2
D.实验中需2.00mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取 的Na2CO3质量分别为1000mL , 212.0g。
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c( H+)= 1xl0-13 mol/L的溶液中: K+、Na+、SiO32-、SO42-
B.能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3-
C.甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32-
D.1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl--
5 . “空气吹出法”海水提溴的工艺流程如下:下列说法中,正确的是
A. 进人吹出塔前,Br- 被还原成了Br2
B.从吹出塔进人吸收塔的物质只有Br2
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
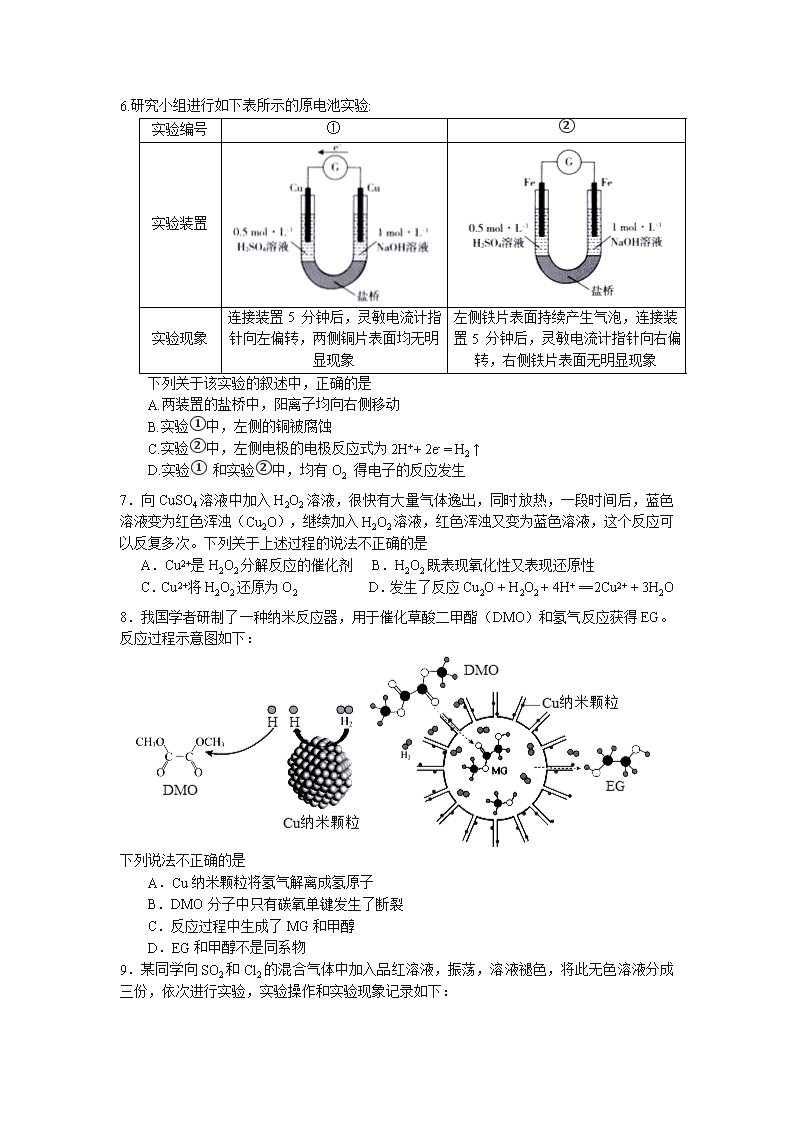
6.研究小组进行如下表所示的原电池实验:
实验编号
①
②
实验装置
实验现象
连接装置5 分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象
左侧铁片表面持续产生气泡,连接装置5 分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象
下列关于该实验的叙述中,正确的是
A.两装置的盐桥中,阳离子均向右侧移动
B.实验①中,左侧的铜被腐蚀
C.实验②中,左侧电极的电极反应式为2H++ 2e- = H2 ↑
D.实验① 和实验②中,均有O2 得电子的反应发生
7.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A.Cu2+是H2O2分解反应的催化剂 B.H2O2既表现氧化性又表现还原性
C.Cu2+将H2O2还原为O2 D.发生了反应Cu2O + H2O2 + 4H+ == 2Cu2+ + 3H2O
8.我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如下:
下列说法不正确的是
A.Cu纳米颗粒将氢气解离成氢原子
B.DMO分子中只有碳氧单键发生了断裂
C.反应过程中生成了MG和甲醇
D.EG和甲醇不是同系物
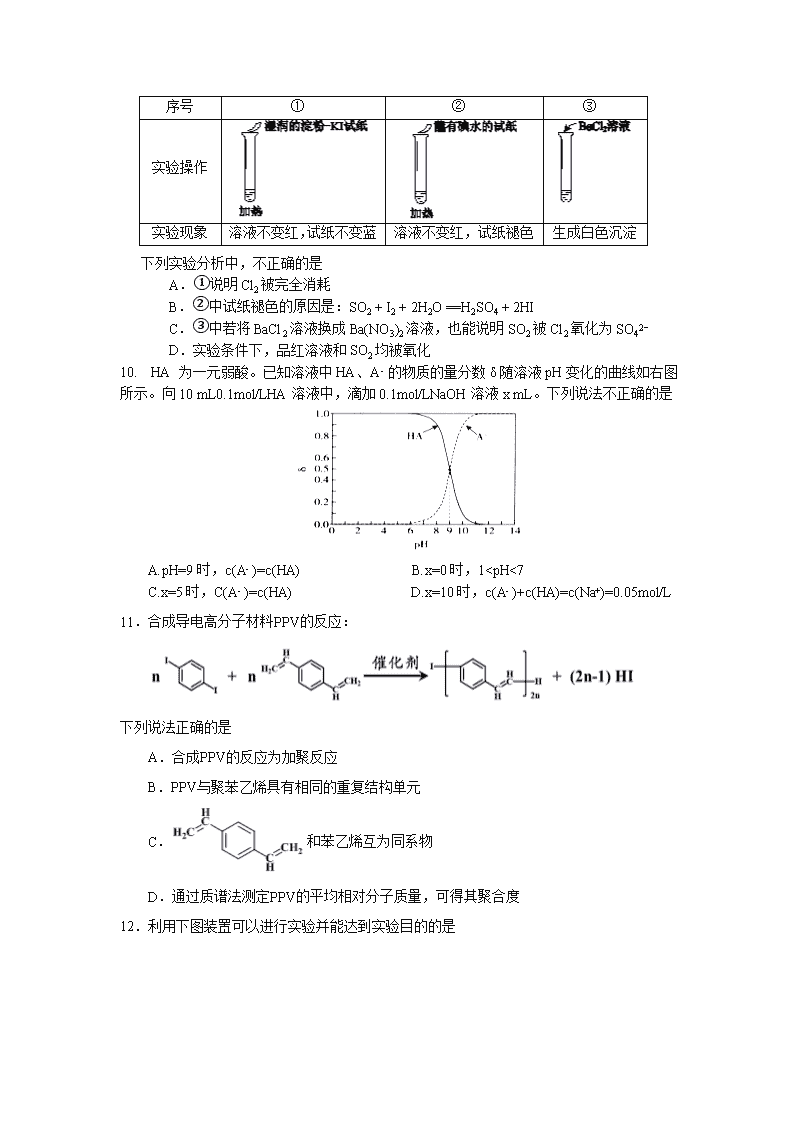
9.某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号
①
②
③
实验操作
实验现象
溶液不变红,试纸不变蓝
溶液不变红,试纸褪色
生成白色沉淀
下列实验分析中,不正确的是
A.①说明Cl2被完全消耗
B.②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−
D.实验条件下,品红溶液和SO2均被氧化
10. HA 为一元弱酸。已知溶液中HA、A- 的物质的量分数δ随溶液pH变化的曲线如右图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法不正确的是
A.pH=9时,c(A- )=c(HA) B.x=0时,1
c(H2AsO3-)=c(AsO33-)
C.pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+)
D.pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1
15. 下列关于有机化合物的叙述不正确的是
A.等物质的量的A、B两种烃分别完全燃烧后,生成的CO2与消耗的O2的物质的量均 相同,则A和B一定互为同系物
A. 沸点比较:乙醇>甲醇 >乙烷
C.如下所示反应为取代反应
D.CH3COOH分子中O-H键容易断裂,使得乙酸具有酸性
16. 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
A. A为电源正极
B. 阴极区电极反应可能有:
Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
B. 阳极区溶液中发生的氧化还原反应为:
Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况) 时,装置中有0.1 mol Cr2O72-被还原
17.溶液X中含有右表离子中的某5种,且其浓度均为0. 1mol/L(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析反应前后 阴离子种类没有变化。下列叙述不正确的是
A.X溶液中不可能含有HC03-或CO32-
B.生成无色气体的离子方程式为:
3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
18. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
A. 汉黄芩素的分子式为C16H10O5
B. 核磁共振氢谱显示该分子含有7种不同化学环境的等效氢
C. 该物质可以发生取代、加成、氧化、聚合、还原反应
D. 与H2发生加成反应,最多消耗7mol氢气
19.有机化合物A的分子式是C13H20O8(相对分子质量为304), 1molA 在酸性条件下与4molH2O反应得到4molCH3COOH和1molB。下列说法错误的是
A. A和B的相对分子质量之差为 168
B. B一定不能发生加成反应
C. 有机物B与CH3CH2OH互为同系物
D. 分子式为C5H10O2且与CH3COOH 属于同类物质的有机物只有4种
二:主观题(4小题,共43分)
20.(11 分)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为 N2O和另一种产物,该反应的化学方程式为 。
(2)已知反应 2N2O(g)=2N2(g) + O2(g)的ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1molN2O(g)分子中化学键断裂时需要吸收的能量为 kJ。
(3)在一定温度下的恒容容器中,反应 2N2O(g) 2N2(g) + O2(g)的部分实验数据如下:
反应时间/min
0
10
20
30
40
50
60
70
80
90
100
c(N2O) /mol·L -1
0.100
0.090
0.080
0.070
0.060
0.050
0.040
0.030
0.020
0.010
0.000
①在 0~20min 时段,反应速率 v(N2O)为 mol·L -1·min -1。
②不同温度(T)下,N2O 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O 消耗一半时所需的相应时间),则 T1 T2(填“>” 、“= ”或“<” )。 温度为 T1、起始压强为 p0,反应至 t1 min 时,体系压强 p = (用 p0 表示)。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g) 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时 N2O分解速率方程 v =kc ( N2O)·[ c(I2)]0.5(k为速率常数)
下列表述正确的是 (填标号)。
A.由上述二、三步反应可知该反应起催化作用的是I(g)
B.第一步对反应速率起决定作用
C.第二步活化能比第三步大
D.I2 浓度与N2O 分解速率无关
21.(10分)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_______________________________________。
(3)该工艺体现了“绿色自由”构想的“绿色”理念的方面有___________________。(任答一条即可)
(4)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是 (填 “反应I”、“反应II”、“反应III”)。
②b点v(正) v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是 。
④c点时该反应的平衡常数K= 。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________。
22.(11分)利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是 。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2
O滤渣,用平衡移动的原理解释得到滤渣的原因 。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(5)步骤④的离子方程式是 。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为 (用a表示)。
23.(11分)氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3 .
回答下列问题:
(1)氰化钠中碳的化合价为 ;用硫代硫酸钠处理1molNaCN时,转移电子的物质的量为 。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的化学方程式是 。
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】制备Na2S2O3 ,其装置如下:
① b装置的作用是 。
②实验结束后,在e处连接盛 (填化学式)溶液的注射器,再关闭K2打开K1,以防止拆除装置时装置中的有害气体污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓;CN-优先与Ag+反应;废水中氰化钠的最高排放标准为0.50mg/L;测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量的实验为:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
③滴定时1.000×10-4mol/L的标准AgNO3溶液应用 (填仪器名称)盛装;滴定终点时的现象是 。
④处理后的废水是否达到排放标准 (填“是”或“否”);其依据是 (用实验数据说明)。
高二上学期期末考试化学参考答案
选择题(共57分)
1—5 A B D D C 6—10 D C B C C 11—15 D D D C A 16—19 D D C C
非选择题(共43分。除特别注明,其余每空均2分)
20.(11 分)
(1)
(2)1112.5
(3)①1.0×10 -3 ② > (1 分); 1.25p0
(4)AC
21.(10分)(1)KHCO3(或碳酸氢钾)(1分)
(2)CO2(g)+ 3H2(g)H2O(g)+CH3OH(g)△H=== -53.7kJ/mol
(3)减少大气中CO2并产生清洁能源甲醇(或K2CO3可循环使用;或能量可以循环利用,低碳经济)(1分)
(4)①反应III(1分) ② >(1分)
③该反应为放热反应,温度升高,平衡逆向移动;(1分)④K=16/3(或K=5.3)
(5)CO2+2H++2e-===CO +H2O(1分)
22.(11分)
(1)过滤(1分)
(2)TiOSO4+(x+1)H2OTiO2 • xH2O↓+H2SO4或TiO2++(x+1)H2OTiO2 • xH2O↓+2H+铁屑与H2SO4反应,C(H+)降低,使平衡正向移动,TiOSO4转化为TiO2•xH2O滤渣
(3)1: 4(1分)
(4)FeCO3+2CH3CH(OH)COOH== Fe2++2CH3CH(OH)COO-+H2O+CO2↑
(5)Fe2++2HCO3-==FeCO3↓+H2O+CO2↑
(6)防止Fe2+被氧化(1分)
(7)13.9/a
23.(11分)
(1)+2 (1分); 4mol(1分)
(2)NaCN+H2O2+H2O=NaHCO3+NH3↑
(3)①安全瓶(1分) ②NaOH (1分)
③酸式滴定管 (1分) ;滴入最后一滴硝酸银溶液,出现淡黄色浑浊且30s内不消失(1分) ④否(1分);此时氰化钠含量为0.7350mg/L超过排放的标准