- 2021-06-18 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮增分策略 28题专练(一)和Cl2制备有关的实验探究
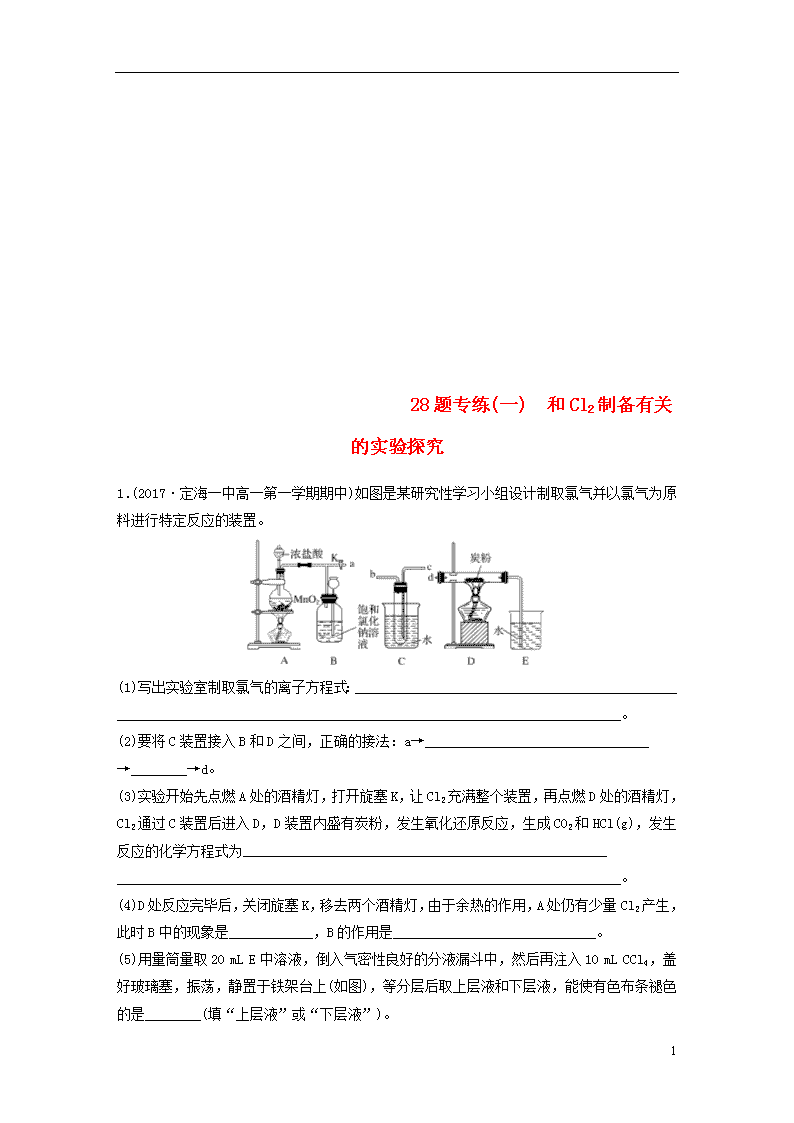
28题专练(一) 和Cl2制备有关的实验探究 1.(2017·定海一中高一第一学期期中)如图是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置。 (1)写出实验室制取氯气的离子方程式:______________________________________________ ________________________________________________________________________。 (2)要将C装置接入B和D之间,正确的接法:a→________________________________ →________→d。 (3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____________________________________________________ ________________________________________________________________________。 (4)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是____________,B的作用是_____________________________。 (5)用量筒量取20 mL E中溶液,倒入气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,能使有色布条褪色的是________(填“上层液”或“下层液”)。 4 答案 (1)MnO2 + 4H++2Cl-Mn2++Cl2↑+2H2O (2)c b (3)2Cl2+C+2H2O(g)4HCl+CO2 (4)瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2对环境造成污染 (5)上层液 解析 (1)实验室制取氯气的离子方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。(2)由装置图判断,气体由A、B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置。(3)根据题意知C为提供水蒸气的装置,反应物为Cl2、C、H2O(g),生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)4HCl+CO2。(4)关闭旋塞K,移去两个酒精灯,因为余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升;氯气有毒,不能直接排放到空气中,B中可以贮存少量氯气,并能防止空气污染。(5)氯气与水反应生成盐酸和次氯酸,次氯酸具有强氧化性,能使有色布条褪色,次氯酸在水层,所以能使有色布条褪色的是上层液。 2.(2018·嘉兴市高三二模)高温下焦炭、石英砂的混合物与氯气反应可生成SiCl4。以下是实验室制备SiCl4的装置示意图(注:SiCl4遇水易水解)。 请回答: (1)用MnO2和浓盐酸制取氯气,为了得到纯净干燥的氯气,可将制得的氯气依次通过盛有______、浓硫酸的洗气瓶。 (2)装置C的作用是__________________________________________________。 (3)设计一个实验方案,用化学方法检验装置D中生成的SO__________________________ ______________________________________________。 答案 (1)饱和食盐水 (2)避免水蒸气进入B,防止SiCl4水解 (3)取少量D中溶液于试管中,先加入足量稀盐酸,再加入BaCl2,若有白色沉淀产生,说明含有SO 解析 (1)实验室用MnO2和浓盐酸制取氯气,制得的氯气中含有HCl气体和水蒸气,饱和的食盐水可以吸收HCl气体,不会吸收氯气,因 4 此为了得到纯净干燥的氯气,可将制得的氯气先通过饱和的食盐水,再通过浓硫酸。(2)SiCl4遇水易水解,利用装置C吸收水蒸气,避免水蒸气进入B中,防止SiCl4水解。 3.(2017·“七彩阳光”新高考研究联盟高一期中)某校一化学兴趣小组为研究氯气的一些性质,设计如下装置进行系列实验(夹持及加热仪器已略)。 (1)若装置 A 中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置 A 中反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。 (2)装置 B 中长颈漏斗的作用是__________________________________________。 (3)装置 C 为研究 Cl2 是否具有漂白性,现有: ①干燥的有色布条 ②湿润的有色布条 ③碱石灰 ④浓硫酸 ⑤无水氯化钙 其中Ⅰ处为________,Ⅲ处为①,则Ⅱ处为________(填上述物质中的序号)。 (4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为橙色,再打开D装置的活塞,使 D 中溶液滴入 E 装置,振荡锥形瓶后静置一会儿,可以观察到下层液体呈紫红色。同学们经过认真讨论后认为该实验方案仍有不足,理由是_____________________________________________。 (5)装置 F 的作用是吸收尾气,在烧杯中发生反应的化学方程式为____________________。 答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)平衡装置中压强,防止玻璃仪器破裂 (3)② ⑤ (4)氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2 (5)Cl2+2NaOH===NaCl+NaClO+H2O 解析 (1)MnO2和浓盐酸反应生成氯化锰、氯气、水。(2)结合实验装置、气体压强变化分析回答。(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成的次氯酸具有漂白性。(5)装置F中用足量的NaOH溶液吸收剩余氯气,反应的化学方程式是Cl2+2NaOH===NaCl+NaClO+H2O。 4.Ⅰ.实验室常用以下几种方法制取氯气。 4 (1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式______________________。 (2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式__________________________。 Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。 (3)装置④中的X试剂为_______________________________________________。 (4)装置③中发生反应的化学方程式为______________________________________________, 该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。 答案 (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O (2)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O (3)NaOH溶液 (4)2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 将装置③放于冷水浴中进行实验 4查看更多