- 2021-06-17 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2012高考化学实验专题5:溶液PH
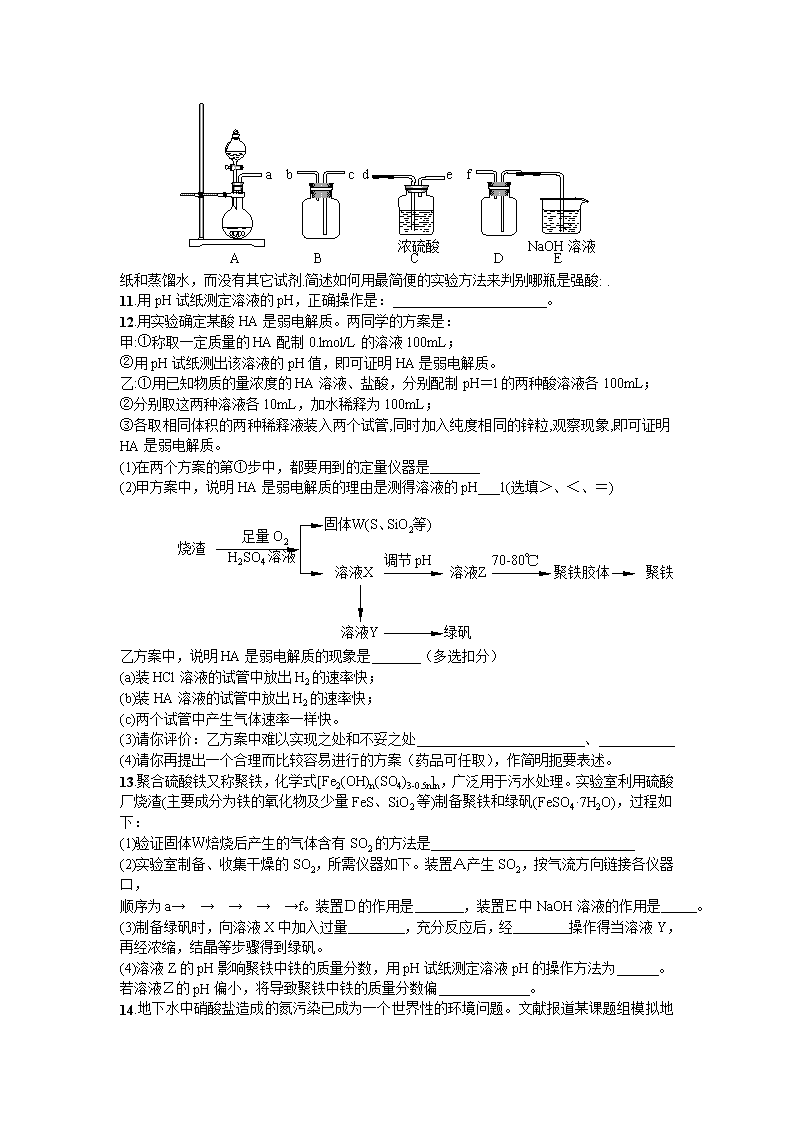
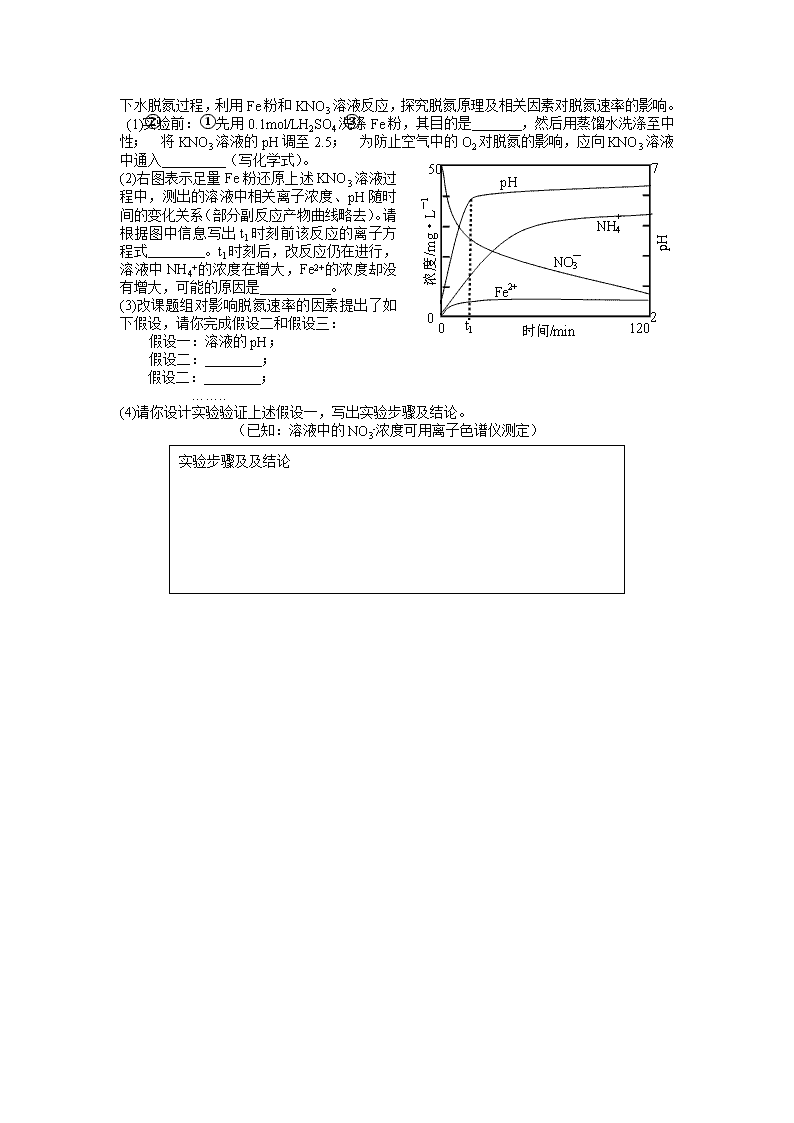
2013高考化学实验专题5:溶液PH 1.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是 A.Na+ B.SO42- C.Ba2+ D.NH4+ 2.用pH试纸测定某无色溶液的pH值时,规范的操作是: A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 B.将溶液倒在pH试纸上,跟标准比色卡比较 C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 3.用pH试纸测定溶液pH的正确操作是: A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照 4.以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4;②甲基红4.4~6.2;③酚酞8.2~10,现用0.1000mol·L-1NaOH溶液滴定浓度相近的甲酸时,上述指示剂 A.都可以用 B.只能用③ C.可以用①或② D.可以用②或③ 5.实验室现有3种酸碱指示剂,其pH变色范围如下 甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用0.1000mol/L NaOH 溶液滴定未知浓度的CH3COOH 溶液,反应恰好完全时,下列叙述中正确的是 A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂 6.工业上制备纯净的氯化锌时,将含杂质的氧化锌溶于过量的盐酸,为了除去杂质需调节溶液的pH值到4,应加入试剂是 A.氢氧化钠 B.氨水 C.氧化锌 D.氯化锌 7.取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为 A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L 8.下列叙述正确的是 A.95℃纯水的pH<7,说明加热可导致水呈酸性 B.pH=3的醋酸溶液,稀释至10倍后pH=4 C.0.2mol/L的盐酸,与等体积水混合后pH=1 D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 9.有关实验的叙述,正确的是 A.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液 B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 D.读取滴定管内液体的体积,俯视读数导致读数偏小 10. 有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判别哪瓶是强酸: . 11.用pH试纸测定溶液的pH,正确操作是: 。 12.用实验确定某酸HA是弱电解质。两同学的方案是: 甲:①称取一定质量的HA配制0.lmol/L的溶液100mL; ②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。 乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL; ②分别取这两种溶液各10mL,加水稀释为100mL; ③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。 (1)在两个方案的第①步中,都要用到的定量仪器是 (2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是 (多选扣分) (a)装HCl溶液的试管中放出H2的速率快; (b)装HA溶液的试管中放出H2的速率快; (c)两个试管中产生气体速率一样快。 (3)请你评价:乙方案中难以实现之处和不妥之处 、 (4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。 13.聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下: 绿矾 调节pH 70-80℃ 足量O2 H2SO4溶液 固体W(S、SiO2等) 溶液X 烧渣 溶液Y 溶液Z 聚铁胶体 聚铁 (1)验证固体W焙烧后产生的气体含有SO2的方法是 (2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向链接各仪器口, e D 浓硫酸 d C a b c f A B E NaOH溶液 顺序为a→ → → → →f。装置D的作用是 ,装置E中NaOH溶液的作用是 。 (3)制备绿矾时,向溶液X中加入过量 ,充分反应后,经 操作得当溶液Y,再经浓缩,结晶等步骤得到绿矾。 (4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为 。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏 。 14.地下水中硝酸盐造成的氮污染已成为一个世界性的环境 问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。 (1)实验前:①先用0.1mol/LH2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。 (2)右图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 。t1时刻后,改反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。 (3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三: 假设一:溶液的pH; 假设二: ; 假设二: ; …….. (4)请你设计实验验证上述假设一,写出实验步骤及结论。 (已知:溶液中的NO3-浓度可用离子色谱仪测定) 实验步骤及及结论 参考答案 1.B 2 C 3 A 4 B 5 D 6 C 7 C 8 C 9 D 10.各取等体积酸液用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的那瓶是强酸. 11把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸 的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。 12(1)100mL容量瓶(注:未标明规格的扣1分) (2)> b (3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同 (4)配制NaA溶液,测其pH值>7即证明HA是弱电解质 13. (1)将气体通入品红溶液,溶液褪色,加热所得的褪色溶液,红色又恢复。或通入酸性高锰酸钾溶液,溶液褪色,加入盐酸酸化的氯化钡,与白色沉淀生成。(合理即得分) (2) a→d→e→c→b→f;防止倒吸;吸收多余的二氧化硫。(3)铁屑 过滤 (4)将一小片pH试纸放在点滴板上,用玻璃棒蘸取待测液点在试纸上,并与标准比色卡对照。 低(小)。查看更多