- 2021-06-17 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】安徽省定远县育才学校2020届高三6月模拟
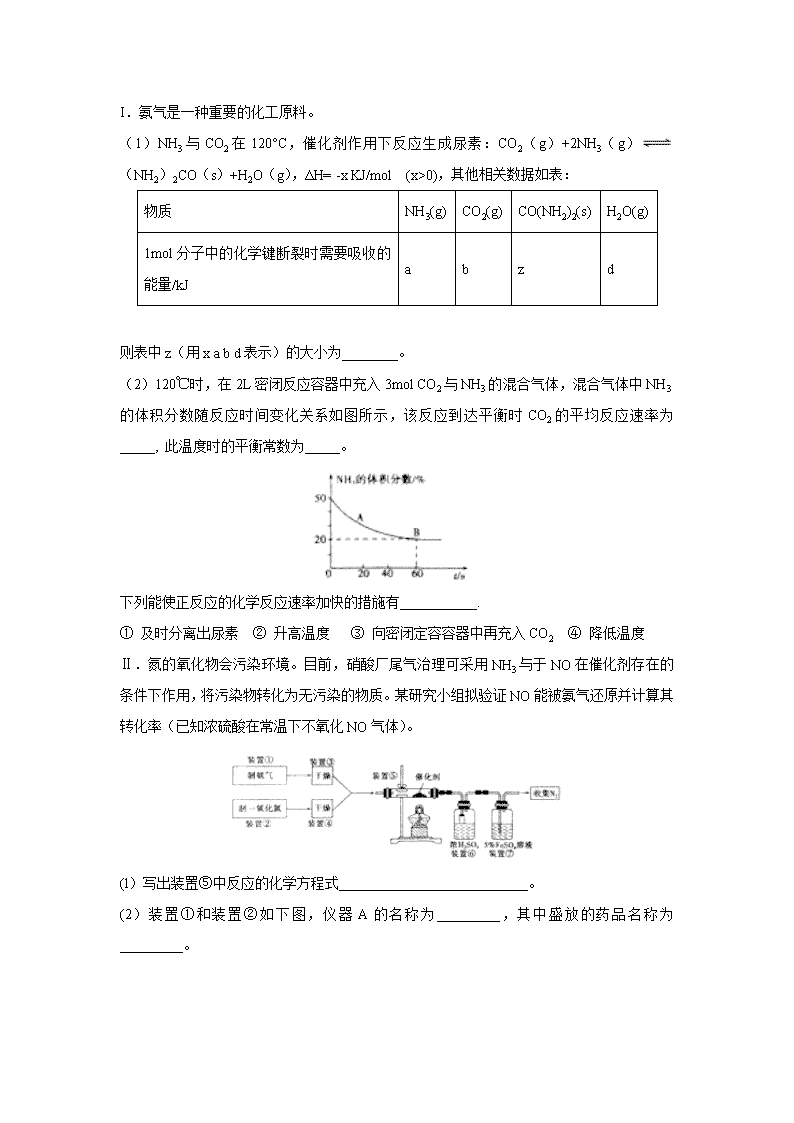
安徽省定远县育才学校2020届高三6月模拟 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 一、选择题:本大题共7小题,每小题6分,共42分。每小题给出的4个选项中只有一项是符合题意要求的。 7.2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是( ) A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” B. 用聚氯乙烯代替木材生产快餐盒,以减少木材的使用 C. 碳纳米管表面积大,可用作新型储氢材料 D. 铜导线和铝导线缠绕连接处暴露在雨水中比在干燥环境中更快断裂的主要原因是发生了电化学腐蚀 8.下列说法中,正确的是( ) A. 将2 g H2与足量的N2混合,充分反应后转移的电子数为2NA B. 1molNa218O2与足量水反应,最终水溶液中18O原子为2NA个 C. 常温下,46gNO2和N2O4组成的混合气体中所含有的分子数为NA D. 100mL 12mol/L的浓HNO3与过量Cu反应,转移的电子数大于0.6NA 9.短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,X在短周期主族元素中金属性最强,W与Y属于同一主族。下列叙述正确的是( ) A. 原子半径:r(Z)>r(X)>r(W) B. W的简单气态氢化物的热稳定性比Y的弱 C. 由W与X形成的一种化合物可作供氧剂 D. Y的最高价氧化物对应的水化物的酸性比Z的强 10.对甲基苯乙烯()是有机合成的重要原料。下列对其结构与性质的推断错误的是( ) A. 分子式为 B. 能发生加聚反应和氧化反应 C. 具有相同官能团的芳香烃同分异构体有5种不考虑立体异构 D. 分子中所有原子可能处于同一平面 11.向盛有少量NaCl溶液的试管中滴入少量AgNO3 溶液,再加入氨水,下列关于实验现象的叙述不正确的是( ) A.先生成白色沉淀,加入足量氨水后沉淀消失 B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl﹣ C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 12.为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下: 下列说法不正确的是( ) A. Na2CO3溶液中存在水解平衡:CO32-+H2OHCO3-+OH- B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜 C. Ⅳ溶液中可能存在大量Al3+ D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- 13.硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( ) A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 B.电极a采用MnO2 , MnO2既作电极材料又有催化作用 C.电池放电时Na+从b极区移向a极区 D.电池的负极反应为BH4﹣+2H2O﹣8e﹣═BO2﹣+8H+ 二、非选择题 26.(15分) 氮的化合物既是一种资源,也会给环境造成危害。 I.氨气是一种重要的化工原料。 (1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表: 物质 NH3(g) CO2(g) CO(NH2)2(s) H2O(g) 1mol分子中的化学键断裂时需要吸收的能量/kJ a b z d 则表中z(用x a b d表示)的大小为________。 (2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。 下列能使正反应的化学反应速率加快的措施有___________. ① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度 Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。 (l)写出装置⑤中反应的化学方程式___________________________。 (2)装置①和装置②如下图,仪器A的名称为_________,其中盛放的药品名称为_________。 装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是____________________________。 (3)装置⑥中,小段玻璃管的作用是____________________________;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_______________________________。 27. (14分) Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。 (1)Ca(NO2)2的制备方法很多。 ①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_________。 ②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____________________________________________,经过滤得到含Ca(NO2)2的溶液为液态产品。 (2)测定某液态产品中NO3-含量的步骤如下: 已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O, 步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。 若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)_______________________________________。 28. (14分) 甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)HCHO(g)+H2(g) △H1 实验测得随温度升高,平衡常数如下表所示。 温度(K) 500 700 T1 T2 T3 平衡常数 7.13×10-4 3.30×10-1 2.00 9.00 10.00 (1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。 (2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。 A.混合气体的密度不变 B.CH3OH、HCHO的物质的量浓度之比为1:1 C.H2的体积分数不再改变 D.单位时间内甲醛的生成量与氢气的消耗量相等 (3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。 (4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。 ① A点:v正______v逆(填“>”、“ =”、“ <”),理由是______________________________; ② B点比A点转化率高的原因是_________________________________。 (5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应: CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) △H2 H2(g)+12O2(g)H2O(g) △H3 则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。 35.[化学-选修3:物质结构与性质](15分) (1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。 ①基态Ti3+的未成对电子数有__________个。 ②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。 ③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示: I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1 I4/kJ·mol-1 I5/kJ·mol-1 738 1451 7733 10540 13630 M是_______(填元素符号),判断理由为_______________________________。 (2)铜晶体中铜原子的堆积方式如下左图所示,铜晶体中原子的堆积模型属于____________。 (3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如上右图所示(黑点代表铜原子)。 ①该晶体的化学式为______________。 ②该化合物难溶于水但易溶于氨水,其原因是________________________________,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。 ③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。 36. [化学-选修5:有机化学基础](15分) 丁苯肽是一种治疗脑血管疾病的药物,其结构简式如图所示。 它的一种合成路线如下: 已知: ① ②Y能发生银镜反应 回答下列问题: (1)丁苯肽所含官能团的名称是_____________。R的名称是____________。 (2)R→X的反应类型是______________。 (3) Y的结构简式为________________。 (4)写出H→丁苯肽的化学方程式:____________________________________。 (5)T和G所含官能团种类相同,T同时具备下列条件的结构有________种。其中,在核磁共振氢谱上有4组峰且峰面积之比为1:2:2:2的结构简式为________________。 ①芳香族化合物;②遇氯化铁溶液发生显色反应:③T的相对分子质量比G小56。 (6)参照上述信息,以为原料合成 ,设计合成路线:____________________________________________。 (无机试剂和2个C以内的有机试剂任选)。 【参考答案】 7 8 9 10 11 12 13 B D C D B C A 7.B 【解析】A.高纯度的二氧化硅广泛用于制作光导纤维,二氧化硅能够与氢氧化钠等强碱反应生成硅酸盐和水,所以光导纤维能够被碱腐蚀而造成断路,故A正确; B.聚氯乙烯塑料因为含有氯,有毒,不可以代替木材,生产快餐盒,故B错误; C.碳纳米管表面积大,易吸附氢气,所以可以用作新型储氢材料,故C正确; D.铜铝两种金属的化学性质不同,在接触处容易电化学腐蚀,故D正确。答案选B。 8.D 【解析】A.将2 g H2与足量的N2混合,该反应为可逆反应,不能进行彻底,充分反应后转移的电子数小于2NA,故A错误; B. 1molNa218O2与足量水生成氢氧化钠和氧气,过氧化钠中的氧原子转化为氢氧化钠和氧气中的氧原子,最终水溶液中18O原子为NA个,故B错误; C.NO2、N2O4的摩尔质量不同,无法计算混合气体的组成,故C错误; D.由于浓HNO3与铜反应生成NO2,而稀HNO3与铜反应生成NO,Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,100 mL 12 mol•L-1的浓HNO3完全被还原为NO2转移0.6mol电子,完全被还原为NO转移0.9mol电子,转移的电子数大于0.6NA,故D正确;答案选D。 9.C 【解析】短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,则W为氧元素,X在短周期主族元素中金属性最强,则X为钠元素,W与Y属于同一主族,则Y为硫元素,Z为短周期元素中原子序数比Y大,则Z为氯元素,据此分析。 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,则W为氧元素,X在短周期主族元素中金属性最强,则X为钠元素,W与Y属于同一主族,则Y为硫元素,Z为短周期元素中原子序数比Y大,则Z为氯元素。 A.同主族从上而下原子半径依次增大,同周期从左而右原子半径依次减小,故原子半径:r(X)>r(Z)> r(W),选项A错误; B. 非金属性越强简单气态氢化物的稳定性越强,则W的简单气态氢化物H2O的热稳定性比Y的简单气态氢化物H2S强,选项B错误; C. 由W与X形成的一种化合物Na2O2可作供氧剂,选项C正确; D. 非金属性越强最高价氧化物的水化物的酸性越强,则H2SO4的酸性比HClO4的弱,选项D错误;答案选C。 10.D 【解析】对甲基苯乙烯()含有甲基、苯环和碳碳双键,具有苯、乙烯的结构特点和性质。 A项、对甲基苯乙烯()含有9个碳和10个氢,分子式为C9H10,故A正确; B项、含有碳碳双键,可发生加聚反应和氧化反应,故B正确; C项、含有两个支链时,有邻间对三种结构,含有一个支链时:支链为-CH=CH-CH3、-CH2CH=CH2、-C(CH3)=CH2,除了本身,一共有5种同分异构体,故C正确; D项、含有苯环和碳碳双键,都为平面形结构,处于同一平面,分中含有-CH3,甲基为四面体结构,所以分子中所有原子不可能处于同一平面,故D错误。故选D。 11.B 【解析】5.AgNO3中滴入NaCl,生成白色的AgCl,难溶于水,硝酸银中滴入氨水生成AgOH,但此两种难溶于水的物质均可溶于氨水生成可溶性的配合物[Ag(NH3)2]Cl,故此现象是先沉淀,后沉淀溶解,此现象同与直接往硝酸银中滴氨水,故ACD正确,B错误;故选:B. 12.C 【解析】A. 溶液中碳酸根会水解,结合水电出来的氢离子,生成碳酸氢根,选项A正确; B.实验Ⅰ和Ⅱ没有气泡,根据所学Al可以和热水反应,但是此实验中没有气泡,说明有氧化膜的保护,实验Ⅲ中却有气泡,说明氧化膜被破坏,选项B正确; C.Ⅳ溶液中出现白色沉淀,白色沉淀应该为氢氧化铝,则不可能存在大量Al3+,选项C不正确; D.Na2CO3溶液呈碱性,铝片在碱性溶液中与OH-反应,生成偏铝酸根,2Al+2OH-+2H2O=2AlO2-+3H2↑,AlO2-和HCO3-反应生成氢氧化铝沉淀,选项D正确;答案选C。 13.A 【解析】A.负极发生氧化反应生成BO2﹣ , 电极反应式为BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O,每转移2mol电子,理论上需要消耗0.25mol即9.5gNaBH4 , 故A正确; B.电极b采用MnO2 , 为正极,H2O2发生还原反应,得到电子被还原生成OH﹣ , MnO2既作电极材料又有催化作用,故B错误; C.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故C错误; D.负极发生氧化反应生成BO2﹣ , 电极反应式为BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O,故D错误; 故选A. 26. I. (1)x-d+b+2a (2分) (2)0.0047mol/(L·s) (2分) 17.07 (2分) ②③ (1分) Ⅱ.(l)4NH3+6NO5N2+6H2O (2分) (2)分液漏斗(1分) 浓氨水(1分) 产生CO2,排出装置中的空气,防止NO被氧化(2分) (3)防倒吸(1分) 溶液变浑浊(1分) 27. (1)2∶1 (2分) 4NO2 + 2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O (3分) (2)与K2Cr2O7反应的n(Fe2+)=6n(K2Cr2O7)=6×0.0200mol·L-1×20.00mL×10-3L·mL-1= 2.400×10-3mol,与NO3-反应的n(Fe2+)=0.1000 mol·L-1×25.00mL×10-3L·mL-1-2.400×10-3mol=1.000×10-4mol,NO3-的含量为 (9分) 28. (1) (2分) (2)ACD (2分) (3)> (2分) (4)> (2分)该反应为气体分子数增加的反应,若平衡后增大压强甲醇转化率应下降,故A点未达到平衡 采用膜反应器可及时分离出产物中的氢气,有利于反应正向进行,提高甲醇的转化率 (4分) (5)>(2分) 35. (1) 1 正四面体(2分) sp3 (1分) Mg(1分) 第3电离能比第2电离能大很多,说明最外层有2个电子 (2分) (2)面心立方密堆积 (2分) (3) CuCl (1分) Cu-可与氨形成易溶于水的配位化合物(或配离子)(2分) [Cu(NH3)4]2+ (2分)×1010(2分) 36. (1)酯基 (1分) 甲苯 (1分) (2)取代反应 (2分) (3) (1分) (4) (2分) (5)13 (4分)(6)(4分)查看更多