- 2021-06-07 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高一化学上学期期中试题(含解析)(新版)人教版
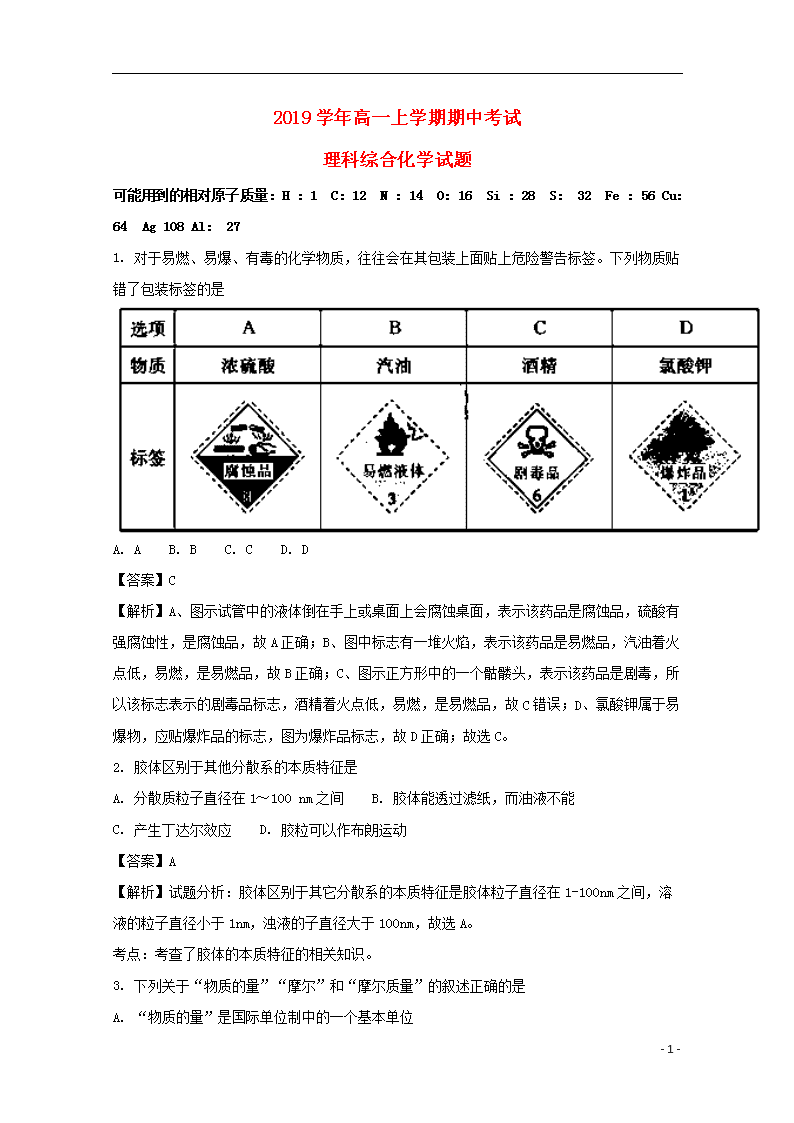
2019学年高一上学期期中考试 理科综合化学试题 可能用到的相对原子质量:H :1 C:12 N :14 O:16 Si :28 S: 32 Fe :56 Cu:64 Ag 108 Al: 27 1. 对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下列物质贴错了包装标签的是 A. A B. B C. C D. D 【答案】C 【解析】A、图示试管中的液体倒在手上或桌面上会腐蚀桌面,表示该药品是腐蚀品,硫酸有强腐蚀性,是腐蚀品,故A正确;B、图中标志有一堆火焰,表示该药品是易燃品,汽油着火点低,易燃,是易燃品,故B正确;C、图示正方形中的一个骷髅头,表示该药品是剧毒,所以该标志表示的剧毒品标志,酒精着火点低,易燃,是易燃品,故C错误;D、氯酸钾属于易爆物,应贴爆炸品的标志,图为爆炸品标志,故D正确;故选C。 2. 胶体区别于其他分散系的本质特征是 A. 分散质粒子直径在1~100 nm之间 B. 胶体能透过滤纸,而油液不能 C. 产生丁达尔效应 D. 胶粒可以作布朗运动 【答案】A 【解析】试题分析:胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,故选A。 考点:考查了胶体的本质特征的相关知识。 3. 下列关于“物质的量”“摩尔”和“摩尔质量”的叙述正确的是 A. “物质的量”是国际单位制中的一个基本单位 - 8 - B. 1 mol任何物质均约含有6.02×1023个分子 C. 物质的摩尔质量等于其相对分子质量或相对原子质量 D. 0.012 kg 12C中所含的碳原子数为NA(NA代表阿伏加德罗常数的数值) 【答案】D 【解析】试题分析:A. “物质的量”是国际单位制中的一个基本单物理量,单位是摩尔,故A错误;B.氯化钠中不存在分子,故B错误;C.物质的摩尔质量的数值等于其相对分子质量或相对原子质量,故C错误;D.0.012 kg12C中所含的碳原子数为NA(NA代表阿伏加德罗常数的数值),故D正确;故选D。 考点:考查了物质的量的概念的相关知识。 4. 下列逻辑关系图中正确的是 A. A B. B C. C D. D 【答案】D 【解析】试题分析:A、气溶胶包含在胶体中,故A错误;B、吸热放热反应不一定是氧化还原反应,故B错误;C、钾盐和钠盐可以是碳酸盐,碳酸盐也可以是钠盐钾盐,故C错误;D、混合物、单质、电解质、非电解质是四个不同概念,图中关系正确,故D正确;故选D。 【考点定位】考查物质分类的方法和依据 5. 下列实验操作中不是从安全因素考虑的是 A. 稀释浓硫酸时,将浓硫酸沿玻璃棒缓慢注入盛水的烧杯中 B. 未使用完的白磷要收集起来,并重新放入水中 - 8 - C. 滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 D. 用氢气还原氧化铜时,要先通一段时间氢气,再加热氧化铜 【答案】C 【解析】试题分析:A.稀释浓硫酸时,将浓硫酸沿玻璃棒缓慢注入盛水的烧杯中,防止酸液溅出伤人,正确;B.未使用完的白磷要收集起来,并重新放入水中,防止本来自燃,引起火灾,正确;C.滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁,防止污染药品,与实验安全无关,错误;D.用氢气还原氧化铜时,要先通一段时间氢气,再加热氧化铜,防止氢气受热与氧气发生爆炸,正确;故选C。 【考点定位】考查化学实验安全 【名师点晴】本题考查了化学实验安全的相关知识。要知道常见的化学实验安全知识,如:①点燃可燃性气体如H2、CH4、CO前一定要检验它们的纯度,这样做可防止不纯气体点燃发生爆炸;②做CO还原CuO实验时,在加热之前应先通入CO,这样做可赶跑空气,防止装置内CO与空气混合受热时爆炸,同时还要进行尾气处理,防止CO污染空气;③白磷等易燃物应保存在水中,用后不能随意丢弃,因为白磷着火点较低,易发生缓慢氧化而自燃.这样做可避免发生火灾;④稀释浓硫酸时,一定要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒入浓硫酸中,这样可防止水浮在酸液上方,沸腾后溅出造成事故等等。 6. 用NA表示阿伏加德罗常数的值,下列说法正确的是 A. 1 L 1 mol • L—1硫酸溶液中所含的氧原子数为4NA B. 标准状况下,11.2 L CC14中所含的原子数为2.5NA C. 2.7 g A1与足量氧气充分反应,转移的电子数为0.3NA D. 常温常压下,14 g由N2与CO组成的混合气体中所含的原子数为2NA 【答案】C 【解析】试题分析:A.1 L 1 mol • L—1硫酸溶液中还含有大量水,水中也含有氧原子,所含的氧原子数多于4NA,故A错误;B.标准状况下,CC14不是气体,不能计算11.2 L CC14中所含的原子数,故B错误;C.2.7 g A1的物质的量为0.1mol,与足量氧气充分反应后显+3价,转移的电子数为0.3NA,故C正确;D.常温常压下,14 g由N2与CO组成的混合气体的物质的量为=0.5mol,中所含的原子数为NA,故D错误;故选C。 【考点定位】考查阿伏加德罗常数和阿伏加德罗定律 - 8 - 【名师点晴】本题主要是通过物质的量的有关计算,综合考查学生的基本计算能力和分析问题的能力。顺利解答该类题目的关键是:一方面要仔细审题,注意关键字词,熟悉常见的“陷阱”;另一方面是要把各种量转化为物质的量,以此为中心进行计算。特别要注意气体摩尔体积、阿伏加德罗定律的适用范围和使用条件。关于气体摩尔体积的使用注意:①气体的摩尔体积适用的对象为气体,而标况下水、CCl4、HF等为液体,SO3为固体;②必须明确温度和压强,只指明体积无法求算物质的量;③22.4L/mol是标准状态下或一定温度、一定压强下的气体摩尔体积。 7. 下列各图所示装置的气密性检查中,一定漏气的是 A. A B. B C. C D. D 【答案】A 【解析】试题分析:A.用弹簧夹夹住右边导管,上下移动,若装置不漏气,两边液面应形成一定的高度差,而图示两端液面相平,说明装置漏气,符合题意,故A正确;B.用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好不漏气,不符合题意,故B错误;C.用弹簧夹夹住右边导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中气体压强增大,在玻璃管中形成一段水柱,说明装置气密性良好不漏气,不符合题意,故C错误;D.用手握住试管,试管内气体受热膨胀,在烧杯内有气泡产生,说明装置气密性良好不漏气,不符合题意,故D错误;故选A。 【考点定位】考查气体发生装置的气密性检查 【名师点晴】本题考查装置气密性的检查,装置气密性检验原理都是依据密闭装置中气体存在压强差,形成水柱或气泡的现象进行判断是解答本题的关键。常见方法有:①利用压强差形成水柱;②利用气体的热胀冷缩形成压强差,形成气泡。该题易错点是D选项的判别。 8. 一、选用正确的实验操作,将下列各组物质进行分离或提纯。 A.分液B.过滤C.萃取D.蒸馏 E.蒸发结晶 F.高温分解 (1)分离CC14和H2O:________________(填字母,下同)。 (2)除去石灰水中的CaCO3:________________。 (3)除去CaO固体中少量的CaCO3固体: ________________。 - 8 - (4)从碘水中提取碘:____________。 (5)分离乙醇(沸点为78 °C)和甲苯(沸点为110.6°C)的液体混合物:__________。 二、蒸馏是实验室制备蒸馏水的常用方法 图一 图二 (1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的一个错误是____________________。 (2)仪器A的名称是______________,仪器B的名称是______________。 (3)实验时A中除加入少量自来水外,还需加入几粒__________,其作用是防止液体暴沸。 (4)从锥形瓶取少量收集到的液体于试管中,然后滴入____________和____________(填试剂的化学式),检验是否存在氯离子。 (5)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是______________;烧杯中最好盛有的物质是____________。 【答案】 (1). A (2). B (3). F (4). C(答C、A或C、A、D均给分) (5). D (6). 冷凝水进、出口颠倒 (7). 蒸馏烧瓶 (8). 冷凝管 (9). 碎瓷片 (10). HNO3 (11). AgNO3 (12). 冷凝水蒸气 (13). 冰水 【解析】一、(1)分离CC14和H2O:选择分液法分离,故选A;(2)除去石灰水中的CaCO3:CaCO3不溶于水,选择过滤法分离,故选B。(3)除去CaO固体中少量的CaCO3固体: CaCO3固体高温分解生成CaO,选择高温分解法除杂,故选F。(4)从碘水中提取碘:碘不易溶于水,易溶于有机溶剂,选择萃取分液法分离,故C。(5)分离乙醇(沸点为78 °C)和甲苯(沸点为110.6°C)的液体混合物:乙醇(沸点为78℃)和甲苯(沸点为110.6℃)互溶,但沸点不同,选择蒸馏法分离,故D。 - 8 - 二、(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的一个错误是冷凝水进、出口颠倒;(2)仪器A的名称是蒸馏烧瓶;仪器B的名称是冷凝管;(3)实验时A中除加入少量自来水外,还需加入几粒碎瓷片,其作用是防止液体暴沸。(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是冷凝水蒸气,烧杯中最好盛有的物质是冷水或冰水。 9. 为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置。(a、b为活塞,且每个装置中的溶液均过量。已知Na2SO3+H2SO4 =Na2SO4+H2O+SO2↑) (1)仪器丙的名称是____________。 (2)甲容器中盛____________;乙容器中盛___________。(填字母) A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液 (3)实验时关闭b,打开a,一段时间后甲中的溶质是__________。 (4)当分离完一种气体后,关闭_________(填“a”或“b”,下同),打开_________,这样得到的气体是____________。 【答案】 (1). 分液漏斗 (2). C (3). A (4). NaOH 和 Na2SO3 (5). a (6). b (7). SO2 ...... (1)由图可知,仪器丙的名称是分液漏斗,故答案为:分液漏斗; (2)甲的作用为吸收二氧化硫,使其与氢气分离,则甲容器中盛碱液为NaOH;乙容器可干燥氢气、二氧化硫,具有吸收性,则乙中盛浓硫酸,故答案为:C;A; (3)实验时关闭b,打开a,发生二氧化硫与NaOH的反应生成亚硫酸钠,且NaOH过量,一段时间后甲中的溶质是NaOH、Na2SO3,故答案为:NaOH、Na2SO3; - 8 - (4)当分离完一种气体后,关闭a,打开b,发生盐酸与亚硫酸钠的反应生成二氧化硫气体,再通过乙中浓硫酸干燥得到干燥的二氧化硫气体,即这样得到的气体是SO2,故答案为:a;b;SO2。 考点:考查了性质实验方案的设计的相关知识。 10. 某同学帮助水质检测站配制490 mL 0.5 mol • L-1NaOH溶液以备使用。 (1)该同学应选择_____mL的容量瓶。 (2)应用托盘天平准确称量_______g NaOH固体。 (3)配制过程如图乙所示,则图甲操作应在图乙中的______ (填字母)之间。 A.①与② B.②与③ C.③与④ (4)若在配制过程中出现下列情况,会使所配制NaOH溶液的浓度偏低的是______(填字母)。 A.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 B.定容时俯视 C.配制溶液所用的容量瓶洗净后没有烘干 D.NaOH固体在烧杯中溶解后,立即将溶液转移到容量瓶内,并接着进行后续操作 E.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至刻度线 【答案】 (1). 500 (2). 10.0 (3). C (4). AE 【解析】试题分析:(1)选取容量瓶的规格应该等于或稍大于配制溶液的体积,实验室没有480mL容量瓶,所以应该选500mL容量瓶,故答案为:500; (2)配制500mL0.5mol•L-1NaOH溶液需要氢氧化钠的质量为0.5L×0.5mol/L×40g/mol=10.0g,故答案为:10.0; (3)如图所示的操作为移液洗涤后向容量瓶内加水,应在转移与定容之间,即应在③到④之间,故选C; - 8 - (4)A.转移完溶液后未洗涤玻璃棒和烧杯,会导致溶质的损失,浓度会偏低,正确;B.定容时俯视液面,则导致溶液体积偏小,则浓度会偏大,错误;C.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,错误;D.NaOH固体在烧杯中溶解后,立即将溶液转移到容量瓶内,则导致溶液体积偏小,则浓度会偏大,错误;E.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至刻度线,导致溶液体积偏大,则浓度会偏小,正确;故选AE。 考点:考查了配制一定物质的量浓度的溶液的相关知识。 11. 物质的量是高中化学计算的核心: (1)相同物质的量的NH3和H2S的质量比___,分子个数比为___,同温同压下的体积比__,所含氢原子的个数比为____. (2)现有m g某气体,它的一个分子由四原子构成,它的摩尔质量为M g/mol.设阿伏伽德罗常数为NA,则: ①该气体的物质的量为____mol. ②该气体中所含的原子总数为____个. ③该气体在标准状况下的体积为___L. 【答案】 (1). 1:2 (2). 1:1 (3). 1:1 (4). 3:2 (5). (6). (7). L 【解析】(1)据m=nM可知,物质的量相同的H2S和NH3,质量之比等于其摩尔质量之比,即17:34=1:2;根据N=nNA可知,分子数目之比等于其物质的量之比,即为1:1;物质的量相等时,温度、压强相等条件下,体积之比等于物质的量之比,机为1:1;含有H原子数目之比等于分子中含有的H原子数目之比,即为3:2。(2)①根据n=,该气体的物质的量=m/Mmol;②根据N=nNA,该气体所含原子总数4×NA=个;③根据V=nVm,该气体在标准状况下的体积为22.4L·mol-1×mol=L。 - 8 -查看更多