- 2021-06-04 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 每日一题之快乐暑假 第05天 粗盐的提纯(含解析)新人教版
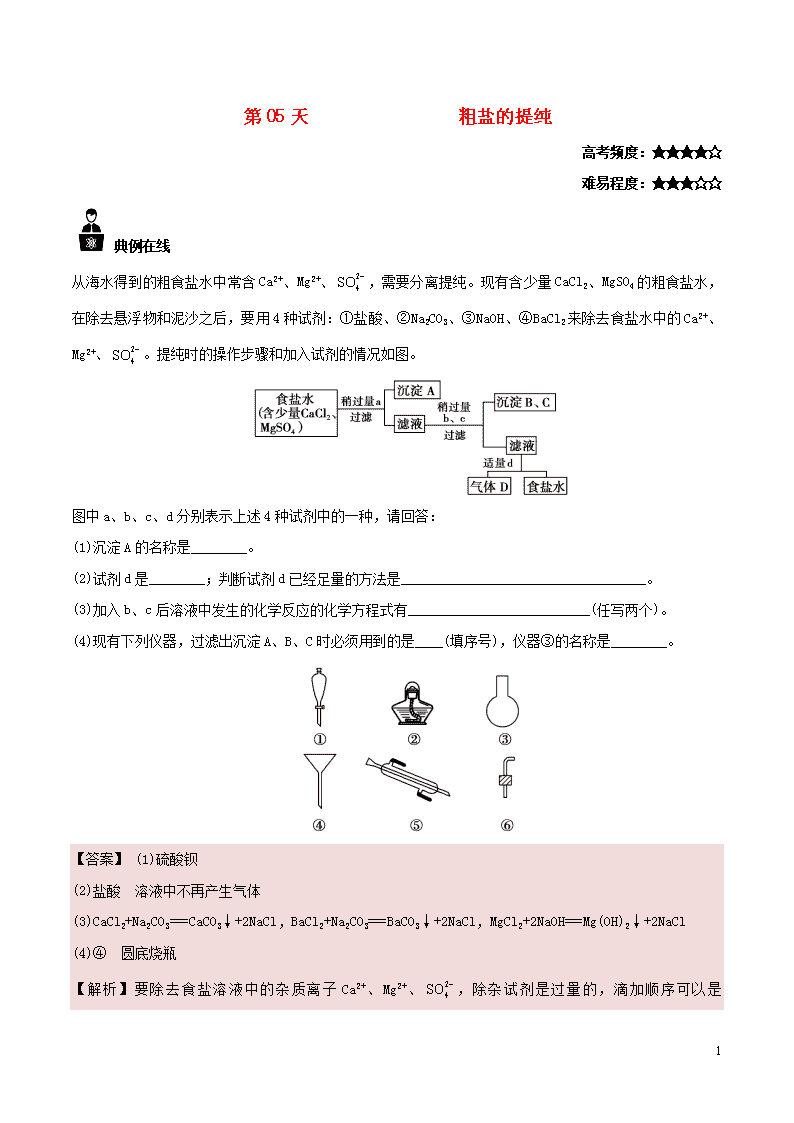
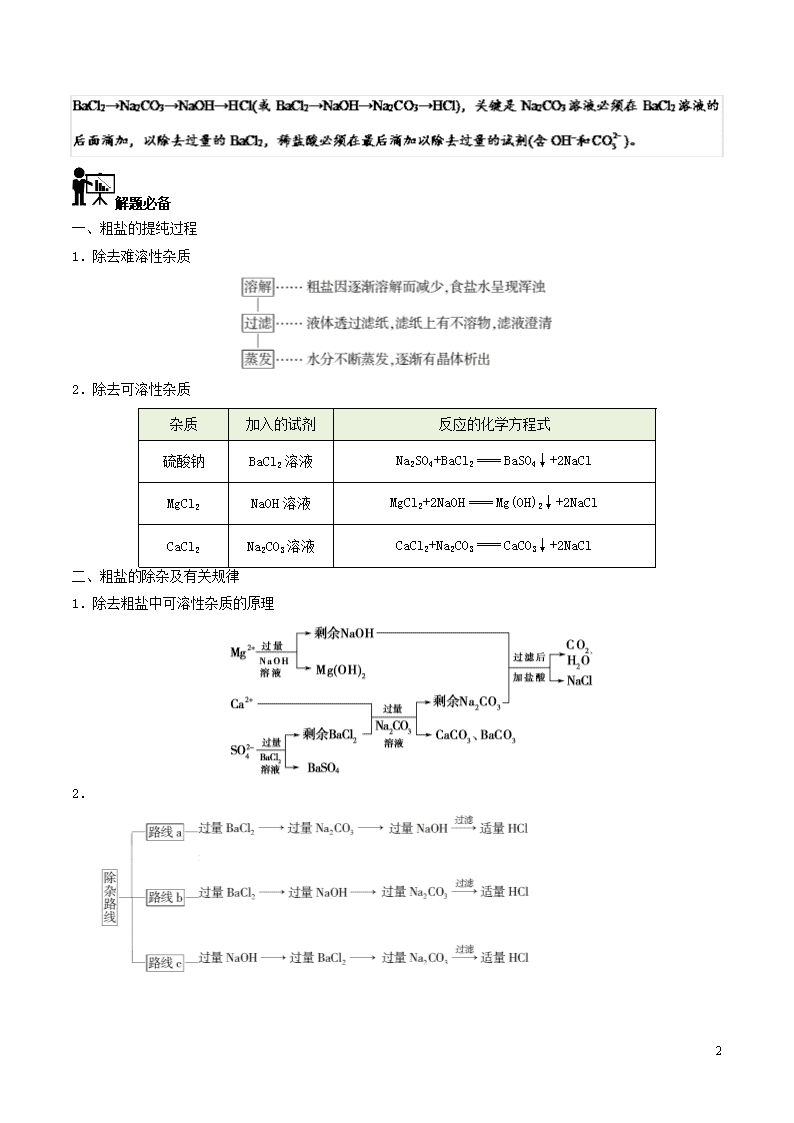
第05天 粗盐的提纯 高考频度:★★★★☆ 难易程度:★★★☆☆ 典例在线 从海水得到的粗食盐水中常含Ca2+、Mg2+、,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、。提纯时的操作步骤和加入试剂的情况如图。 图中a、b、c、d分别表示上述4种试剂中的一种,请回答: (1)沉淀A的名称是________。 (2)试剂d是________;判断试剂d已经足量的方法是___________________________________。 (3)加入b、c后溶液中发生的化学反应的化学方程式有__________________________(任写两个)。 (4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是________。 【答案】 (1)硫酸钡 (2)盐酸 溶液中不再产生气体 (3)CaCl2+Na2CO3===CaCO3↓+2NaCl,BaCl2+Na2CO3===BaCO3↓+2NaCl,MgCl2+2NaOH===Mg(OH)2↓+2NaCl (4)④ 圆底烧瓶 【解析】要除去食盐溶液中的杂质离子Ca2+、Mg2+、,除杂试剂是过量的,滴加顺序可以是 5 解题必备 一、粗盐的提纯过程 1.除去难溶性杂质 2.除去可溶性杂质 杂质 加入的试剂 反应的化学方程式 硫酸钠 BaCl2溶液 Na2SO4+BaCl2BaSO4↓+2NaCl MgCl2 NaOH溶液 MgCl2+2NaOHMg(OH)2↓+2NaCl CaCl2 Na2CO3溶液 CaCl2+Na2CO3CaCO3↓+2NaCl 二、粗盐的除杂及有关规律 1.除去粗盐中可溶性杂质的原理 2. 5 3.物质分离和提纯的“三个必须”和“四个原则” (1)三个必须 (2)四个原则 学霸推荐 1.实验室进行粗盐提纯,无需进行的操作是 A.分液 B.溶解 C.过滤 D.蒸发 2.“粗盐的提纯”实验中,蒸发时正确的操作是 A.把浑浊的液体倒入蒸发皿中加热 B.开始析出晶体后用玻璃棒搅拌 C.待水分完全蒸干后停止加热 D.蒸发皿中出现大量固体时即停止加热 3.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水: ①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液; ③加入稍过量的BaCl2 溶液; ④滴入稀盐酸至无气泡产生; ⑤过滤。 正确的操作顺序是 A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④ 4.为除去粗盐中的Ca2+、Mg2+、 5 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量) (1)第①步中,操作A是________,第⑤步中,操作B是________。 (2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)______________。 (3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________。 (4)判断BaCl2已过量的方法是____________________________________。 5.实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3NH3↑+CO2↑+H2O) 如果此方案正确,那么: (1)操作①可选择________仪器。 (2)操作②为什么不用硝酸钡溶液,其理由是___________________________。 (3)进行操作②后,如何判断已除尽,方法是_____________________。 (4)操作③的目的是_______________________________________________,为什么不先过滤后加碳酸钠溶液?理由是_________________________。 (5)操作④的目的是______________________________________________。 参考答案 1.【答案】A 【解析】粗盐中含有泥沙、硫酸镁、氯化钙等杂质,需先将粗盐溶解,再加入氢氧化钠、氯化钡、碳酸钠等生成氢氧化镁、硫酸钡、碳酸钙、碳酸钡等沉淀,过滤除去沉淀,在滤液中加入盐酸,用蒸发的方法除去盐酸和水,无需用到分液操作,故答案选A。 2.【答案】D 3.【答案】A 5 【解析】粗盐的提纯中,为了保证杂质离子完全除去,每一次所加试剂都应过量,加入NaOH溶液的目的是除去镁离子,加BaCl2溶液的目的是除去硫酸根离子,加Na2CO3溶液的目的是除去钙离子和过量的钡离子,由此可知,Na2CO3溶液的加入一定在BaCl2溶液之后,即①一定在③之后,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,即④在⑤之后,故操作顺序可以是②③①⑤④或③②①⑤④或③①②⑤④,故选A。 4.【答案】(1)溶解 过滤 (2)CaCl2+Na2CO3CaCO3↓+2NaCl、BaCl2+Na2CO3BaCO3↓+2NaCl (3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度 (4)取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量 5.【答案】(1)坩埚 (2)溶液中引入新的杂质离子 (3)取上层清液加入BaCl2溶液,若无白色沉淀说明已除尽 (4)除去过量的Ba2+ 先加Na2CO3然后过滤,可以减少一次过滤操作 (5)除去溶解在溶液中的CO2和HCl 【解析】(1)操作①为加热使NH4HCO3受热分解,因此可选择的仪器是坩埚。 (2)若用Ba(NO3)2会使溶液中引入新的杂质离子,在以后操作中无法除去。 (3)判断已除尽的方法:取上层清液加入BaCl2溶液,若无沉淀说明已除尽。 (4)操作③“加入Na2CO3溶液”,目的是除去过量的Ba2+。先加Na2CO3后过滤,可以减少一次过滤操作。 (5)除去溶解在溶液中的CO2和HCl。 学霸之路 5查看更多