- 2021-06-02 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020九年级化学下册 单元测试(一)常见的酸和碱同步测试 (新版)鲁教版
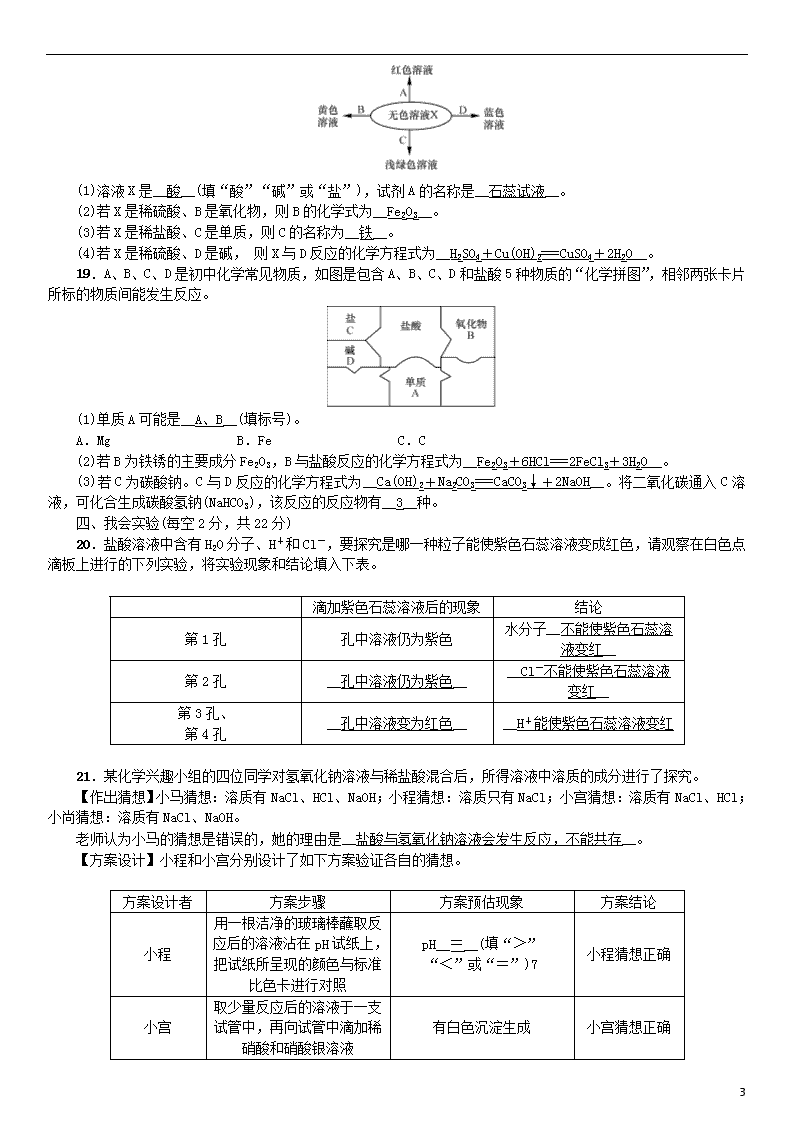
单元测试(一) 常见的酸和碱 (时间:60分钟 总分:100分) 可能用到的相对原子质量:H—1 O —16 Na—23 Cl—35.5 一、我会选择(每小题只有一个选项符合题意,每小题3分,共42分) 1.除铁锈的试剂是(B) A.氯化钠溶液 B.稀盐酸 C.氢氧化钠溶液 D.水 2.下列物质属于盐的是(C) A.Fe B.CuO C.Na2CO3 D.H2SO4 3.下列有关熟石灰的说法错误的是(C) A.熟石灰又称为消石灰 B.熟石灰由生石灰与水反应而制得 C.熟石灰的水溶液在空气中久置后溶液质量会增加 D.石灰水即熟石灰的水溶液,能使紫色石蕊试液变蓝 4.关于酸和碱的描述正确的是(A) A.浓硫酸具有吸水性,在实验室中常用它作干燥剂 B.生石灰与熟石灰都属于碱 C.酸就是有酸味的物质 D.碱就是有腐蚀性的物质 5.下列说法正确的是(D) A.完成“探究碱的性质”实验之后,可以将废液直接倒入下水道 B.在滴有石蕊溶液的水中通入二氧化碳气体后溶液变红,说明二氧化碳气体能使石蕊溶液变红色 C.铁桶能用来盛放氢氧化钠溶液,也能用来盛放稀盐酸 D.熟石灰涂在墙上使墙体表面变硬,原因是熟石灰与二氧化碳反应生成了坚硬的碳酸钙 6.人体内几种体液的正常pH范围如下: 体液 血浆 胃液 胆汁 胰液 pH 7.35~7.45 0.9~1.5 7.1~7.3 7.5~8.0 下列说法错误的是(B) A.血浆显碱性 B.胃液和胆汁显酸性 C.胰液比血浆的碱性强 D.胃酸过多的人应少饮碳酸饮料 7.人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉的吸收率的是(C) A.氯化钾 B.烧碱 C.熟石灰 D.硫酸亚铁(水溶液显酸性) 8.下列反应属于中和反应的是(C) A.Ca(OH)2+CO2===CaCO3↓+H2O B.MgO+2HCl===MgCl2+H2O C.H2SO4+2KOH===K2SO4+2H2O D.HCl+AgNO3===AgCl↓+HNO3 9.某种牵牛花清晨呈粉红色,下午变为蓝紫色,原因是清晨该牵牛花细胞内CO2含量较高,细胞液呈酸性;下午细胞内CO2 4 含量较低,细胞液呈中性或弱碱性。由此推测,该牵牛花中含有能变色的物质,这种物质的性质类似于(B) A.碘溶液 B.石蕊试液 C.酚酞试液 D.硫酸铜溶液 10.下列实验操作或记录正确的是(C) A.稀释浓硫酸时,将水沿烧杯壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌 B.测溶液pH值时,将待测液倾倒在pH试纸上,将pH试纸的颜色与标准比色卡比较即可 C.用托盘天平称取5.4 g氯化钠 D.打开装有浓盐酸的试剂瓶,可看到白烟 11.稀硫酸与下列物质反应,反应后溶液中的H+没有减少的是(A) A.BaCl2 B.NaOH C.CuO D.Fe 12.只用一种物质就能将稀硫酸、水、澄清石灰水三种无色液体鉴别出来,可供选用的物质是:①pH试纸、②酚酞试液、③稀盐酸、④碳酸钠溶液、⑤石蕊试液,其中能用来鉴别的是(A) A.①④⑤ B.①②⑤ C.①②③ D.③④⑤ 13.逻辑推理是一种重要的化学思维方法。以下推理合理的是(C) A.离子是带电荷的微粒,所以带电荷的微粒一定是离子 B.酸中一定含有氢元素,所以含有氢元素的物质一定是酸 C.某物质在氧气中燃烧后生成二氧化碳和水,所以该物质中一定含有碳、氢元素 D.碱溶液都能使无色酚酞溶液变红,所以能使无色酚酞溶液变红的一定是碱溶液 14.下列各组物质的鉴别方法中,能达到预期目的的是(D) A.烧碱与熟石灰——加酚酞试剂 B.稀硫酸与稀盐酸——加碳酸钠 C.氮气与氧气——加澄清石灰水 D.生石灰与熟石灰——加水 二、我会填空(每空1分,共16分) 15.请选择与下列叙述相对应物质的序号填空: ①活性炭 ②稀硫酸 ③pH试纸 ④熟石灰 ⑤浓硝酸 ⑥氯化钠 ⑦烧碱 (1)可用于测定溶液酸碱度的是__③__; (2)具有吸附性的是__①__; (3)生理盐水中的溶质是__⑥__; (4)可用来改良酸性土壤的是__④__; (5)可用来制炸药的是__⑤__; (6)可用来造纸、印染、炼油的是__⑦__。 16.根据所学知识,回答下列问题。 (1)如图A、B所示,电子秤上的量筒中分别盛有蒸馏水和浓硫酸,放置一段时间。 ①A中示数变小,从微粒的角度解释其原因是__水分子在不断运动__。 ②B中示数__变大__(填“变大”“不变”或“变小”),其原因是__浓硫酸具有吸水性,能吸收空气中的水蒸气__。 (2)如图C所示,用玻璃棒蘸硫酸在白纸上写字,放置一会儿发现用__浓__(填“浓”或“稀”)硫酸在白纸上写的字变黑。结论:同种酸由于__溶液浓度(或溶质的质量分数)__不同,它们的性质不完全相同。 17.分析下列反应,回答有关问题。 ①2NaOH+CO2===Na2CO3+H2O ②Ca(OH)2+CO2===CaCO3↓+H2O (1)NaOH、Ca(OH)2都属于__碱__(填“酸”“碱”或“盐”),由上述反应可知,它们与二氧化碳反应的规律是都生成__盐__和水; (2)根据上述规律,KOH与CO2反应的化学方程式为2KOH+CO2===__K2CO3+H2O__; (3)用CO2鉴别NaOH和Ca(OH)2两种溶液时,能观察到明显现象的是__Ca(OH)2__溶液; (4)向敞口久置在空气中的氢氧化钠固体中滴入一定量的稀盐酸,观察到的现象为____有气泡冒出__。 三、我会回答(除化学方程式每空2分外,其余每空1分,共12分) 18.如图所示化学反应的溶液颜色变化体现了“魔法世界、魅力化学”。请回答: 4 (1)溶液X是__酸__(填“酸”“碱”或“盐”),试剂A的名称是__石蕊试液__。 (2)若X是稀硫酸、B是氧化物,则B的化学式为__Fe2O3__。 (3)若X是稀盐酸、C是单质,则C的名称为__铁__。 (4)若X是稀硫酸、D是碱, 则X与D反应的化学方程式为__H2SO4+Cu(OH)2===CuSO4+2H2O__。 19.A、B、C、D是初中化学常见物质,如图是包含A、B、C、D和盐酸5种物质的“化学拼图”,相邻两张卡片所标的物质间能发生反应。 (1)单质A可能是__A、B__(填标号)。 A.Mg B.Fe C.C (2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为__Fe2O3+6HCl===2FeCl3+3H2O__。 (3)若C为碳酸钠。C与D反应的化学方程式为__Ca(OH)2+Na2CO3===CaCO3↓+2NaOH__。将二氧化碳通入C溶液,可化合生成碳酸氢钠(NaHCO3),该反应的反应物有__3__种。 四、我会实验(每空2分,共22分) 20.盐酸溶液中含有H2O分子、H+和Cl-,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。 滴加紫色石蕊溶液后的现象 结论 第1孔 孔中溶液仍为紫色 水分子__不能使紫色石蕊溶液变红__ 第2孔 __孔中溶液仍为紫色__ __Cl-不能使紫色石蕊溶液变红__ 第3孔、 第4孔 __孔中溶液变为红色__ __H+能使紫色石蕊溶液变红 21.某化学兴趣小组的四位同学对氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分进行了探究。 【作出猜想】小马猜想:溶质有NaCl、HCl、NaOH;小程猜想:溶质只有NaCl;小宫猜想:溶质有NaCl、HCl;小尚猜想:溶质有NaCl、NaOH。 老师认为小马的猜想是错误的,她的理由是__盐酸与氢氧化钠溶液会发生反应,不能共存__。 【方案设计】小程和小宫分别设计了如下方案验证各自的猜想。 方案设计者 方案步骤 方案预估现象 方案结论 小程 用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸所呈现的颜色与标准比色卡进行对照 pH__=__(填“>” “<”或“=”)7 小程猜想正确 小宫 取少量反应后的溶液于一支试管中,再向试管中滴加稀硝酸和硝酸银溶液 有白色沉淀生成 小宫猜想正确 4 【方案评价】两位同学中__小程__的方案正确。 【方案反思】请分析错误方案的原因:__反应生成的氯化钠也能和硝酸银反应生成白色沉淀氯化银,因此并不能判断有无HCl__(都正确,不作答)。 【拓展研究】请你再设计一个实验方案验证小尚的猜想正确,填写下列实验报告。 方案步骤 方案预估现象 方案结论 __取少量反应后的溶液于一支试管中,再向试管中滴加无色酚酞试液(或取少量反应后的溶液于一支试管中,再向试管中滴加硫酸铜溶液或其他可溶性铜盐溶液)__ __溶液变红色(或有蓝色沉淀生成)__ 小尚猜想正确 五、我会计算(共8分) 22.将40 g稀盐酸逐滴加入到20 g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答: 图一 图二 (1)图二从A到B过程中,溶液的pH逐渐__减小__(填“增大”或“减小”)。 (2)图二表示酸碱恰好完全反应的点是__B__。 (3)计算稀盐酸中溶质的质量分数。 解:设稀盐酸中溶质的质量分数为x。 NaOH + HCl===NaCl+H2O 40 36.5 20 g×4% 20 g×x = x=3.65% 答:稀盐酸中溶质的质量分数是3.65%。 4查看更多