- 2021-06-01 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学 第一章 从实验学化学复习导学案(无答案)新人教版必修1
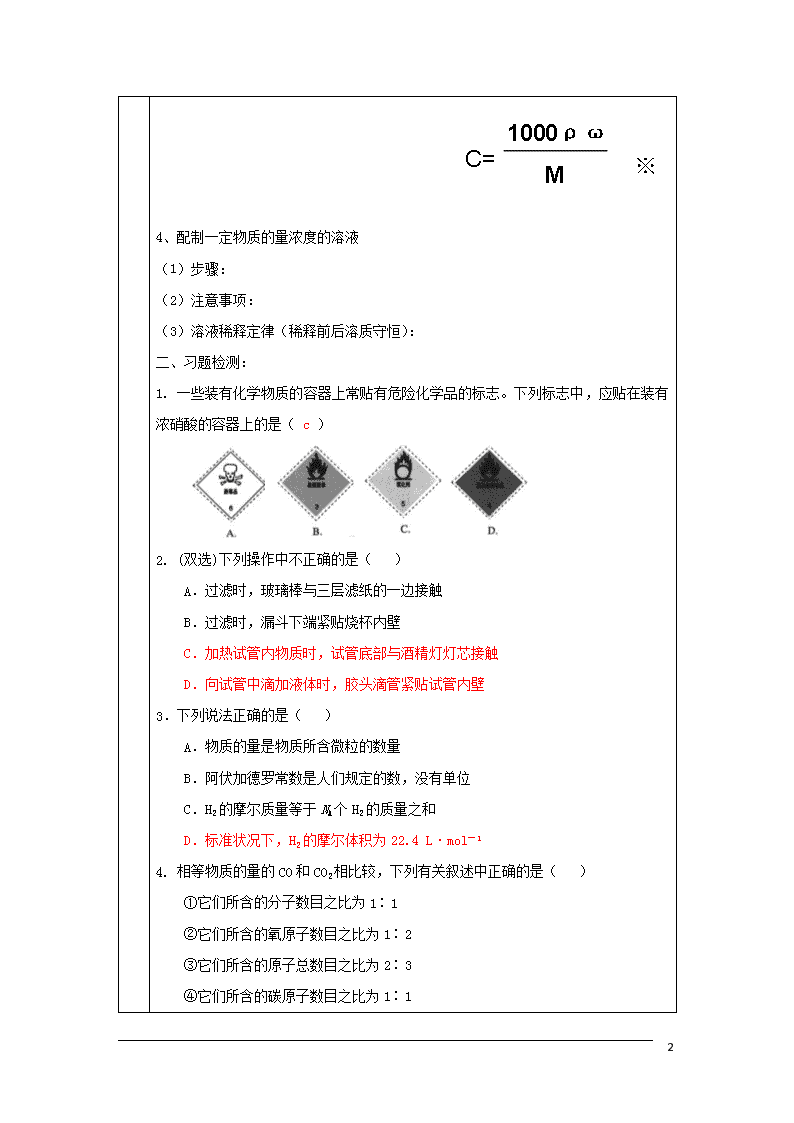
第一章 从实验学化学 学习目标 1、掌握混合物分离提纯的常用方法和操作。 2、掌握SO42-、CO32-等离子的检验。 3、通过一定物质的量浓度溶液配制掌握有关物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念 重点 物质的量、摩尔质量、气体摩尔体积、物质的量浓度等相关计算 难点 物质的量、摩尔质量、气体摩尔体积、物质的量浓度等相关计算 学法指导 深刻理解物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念; 熟练掌握公式及相关变形 自学引导︵学生课前必须完成︶ 一、知识回顾:(请同学们认真复习课本第一章,你一定能完成下列问题) 1、混合物的分离和提纯 (1)过滤操作应注意做到:“一 、二 、三 ” (2)蒸馏原理: (3)萃取的原理: (4)萃取剂的选择: 2、离子的检验 (1)SO42- (2)Cl- 3、完成下面关系图 5 4、配制一定物质的量浓度的溶液 (1)步骤: (2)注意事项: (3)溶液稀释定律(稀释前后溶质守恒): 二、习题检测: 1. 一些装有化学物质的容器上常贴有危险化学品的标志。下列标志中,应贴在装有浓硝酸的容器上的是( c ) 2. (双选)下列操作中不正确的是( ) A.过滤时,玻璃棒与三层滤纸的一边接触 B.过滤时,漏斗下端紧贴烧杯内壁 C.加热试管内物质时,试管底部与酒精灯灯芯接触 D.向试管中滴加液体时,胶头滴管紧贴试管内壁 3.下列说法正确的是( ) A.物质的量是物质所含微粒的数量 B.阿伏加德罗常数是人们规定的数,没有单位 C.H2的摩尔质量等于NA个H2的质量之和 D.标准状况下,H2的摩尔体积为22.4 L·mol-1 4. 相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( ) ①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的碳原子数目之比为1∶ 5 1 A.①和④ B.②和③ C.③和④ D.①②③④ 5.(双选)下列各组物质中,所含分子数相同的是( ) A.10 g H2和10 g O2 B.5.6 L N2(标准状况)和11 g CO2 C.9 g H2O和0.5 mol Br2 D.224 mL H2(标准状况)和0.1 mol N2 6.将30 mL 0.5 mol·L―1的NaCl溶液加水稀释到500 mL,稀释后溶液中NaCl的物质的量浓度为( ) A.0.3 mol·L―1 B.0.03 mol·L―1 C.0.05 mol·L―1 D.0.04 mol·L―1 7.下列各组溶液,不用其他试剂就可以将它们区别开的是( ) A.HCl、KOH、K2SO4、K2CO3 B.NaNO3、BaCl2、Na2CO3、NaOH C.BaCl2、CaCl2、Na2SO4、KNO3 D.KOH、K2CO3、MgSO4、H2SO4 8.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( ) A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且比水更容易使碘溶解 C.不溶于水,且必须比水密度大 D.不溶于水,且必须比水密度小 9.(双选)除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( ) A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤 B.KNO3溶液(AgNO3),加NaCl溶液,过滤 C.NaCl溶液(I2),加酒精,分液 D.KNO3溶液(I2),加四氯化碳,分液 10.(双选)根据阿伏加德罗定律,下列叙述中正确的是( ) A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比 5 11.下列叙述正确的是( ) A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L 12.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( ) A.16g B.32g C.64g /mol D.32g /mol 13.科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是( ) A.原子数 B.分子数 C.体积 D.物质的量 14.同温同压下,等质量的下列气体所占有的体积最大的是( ) A.O2 B.CH4 C.CO2 D.SO2 15.用NA表示阿伏德罗常数,下列叙述正确的是( ) A.标准状况下,22.4LH2O含有的分子数为1 NA B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA C.通常状况下,1 NA 个CO2分子占有的体积为22.4L D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA 16.欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是( ) ① 将14.2 g Na2SO4 溶于100ml水中 ② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml ③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml A.①② B.②③ C.①③ D.①②③ 17.0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( ) A.5:2 B. 3:1 C.15:2 D. 1:3 18.甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。 (1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。 5 ①实验所用的玻璃仪器除烧杯和容量瓶外,还有 ; ② 将溶液转移到容量瓶中的正确操作是 ③ 定容的正确操作是 (2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。 你认为此法是否正确?若不正确,指出其中错误之处 三、你还有哪些不会的问题,请提出来让老师和同学帮你解决 5查看更多