湖南省衡阳市第八中学2018-2019学年高二上学期六科联赛(12月)化学
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
衡阳八中2018-2019学年高二上学期六科联赛试题(12月)
化学
请注意:时量90分钟 满分100分
相对原子质量:H 1 C 12 N 14 S 32 Cl 35.5 Ca40 Mn 55 Fe 56 Cu 64 Zn 65 O 16 Li 7 Ni 28
一、选择题(本题包括21小题,每小题2分,共42分)
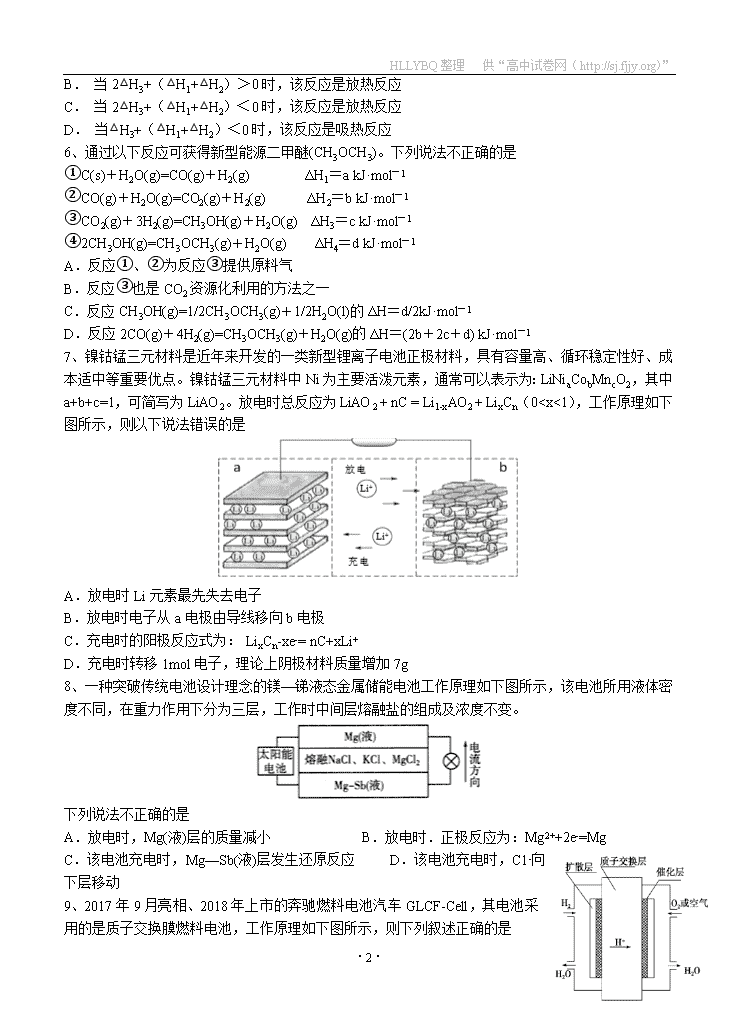
1、下列影响因素中,既能改变化学反应速率,又能改变化学平衡常数的是
A.催化剂 B.浓度 C.温度 D.固体表面积大小
2、在不同情况下测得A(g)+3B(g) 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A.υ(D)=0.01 mol•L-1•s-1 B.υ(C)=0.010 mol•L-1•s-1
C.υ(B)=0.6 mol•L-1•min-1 D.υ(A)=0.2mol•L-1•min-1
3、下列结论错误的是
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性: Cl2>S
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Mg
1.0×10-6 mol/L
D.Zn(OH)2(s) +2HCOOH(aq) Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
11、常温下,下列溶液中的微粒浓度关系不正确的是
A.pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B.等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C.NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:
c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D.0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
12、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是
A.H2A的电离方程式为:H2A=H++HA- HA-A2-+H+
B.室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3
C.等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓
度大小关系为:c(Na+)>c(HA-)>c(A2-)
D.在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
13、柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
A.H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C.Na2HR溶液中HR2-的水解程度大于电离程度
D.pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
14、下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体
HX放出的氢气多且反应速率快
酸的强弱:HX<HY
B
向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4
先生成白色沉淀,后生成黑色沉淀
溶度积(Ksp):
ZnS>CuS
·9·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
C
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN
Fe(SCN)3 +3KCl平衡向逆反应方向移动
D
常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH
pH:NaA>NaB
常温下酸性:HA﹤HB
15、一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1mol N2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(保持温度不变),下列说法正确的是
A. 右边CO与CO2分子数之比为1:3
B. 右侧CO的质量为2.75g
C. 若改变右边CO和CO2的充入量而使隔板处于离右端1/6处,保持温度不变,则前后两次充入容器内的气体压强之比为5:3
D. 右侧气体密度是相同条件下氢气密度的16倍
16、在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g) 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
A.该反应的ΔH<0
B.T1时,该反应的平衡常数为1/16
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D.若T2c(Y-)>c(HY) >c(H+)>c(OH-)
二、非选择题(本题包括4小题,每空2分,共58分)
22、(8分)对于可逆反应:mA(g)+nB(g) pC(g)+qD(g)
(m、n、p、q均为化学计量数),根据图示曲线回答:
(1)正反应是___热反应。
·9·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____热反应,m+n___p+q(填“>”“<”或“=”)。
23、(18分)某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。
(1)装置甲中仪器A的名称是 ,丙中应装的溶液是 ,甲装置中发生反应的离子方程式为 。制取收集纯净氯气的装置接口连接顺序是a→ →g(补充完整)。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是 ;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____。填“是”或“否”)用0.10 mol•L-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示,其读数为_____ mL。
b.平行滴定后获得实验结果。
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3)某同学认为上述方案存在明显的缺陷,请指出 。
24、(18分)研究NO2、NO、SO2 、CO
·9·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应I:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变 B.容器中气体密度保持不变
C.混合气体颜色保持不变 D.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:
2CO(g)+SO2(g) 2CO2(g)+S(g)
实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
①达到平衡状态时,SO2的转化率为 ,该温度下反应的平衡常数K= 。
②其它条件保持不变,再向上述平衡体系中充入SO2(g)、CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0
在催化剂作用下,NO转化率与温度的关系如图所示:
图中A点处NO的转化率 (填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
25、(14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程图如下:
·9·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
(1)将菱锌矿研磨成粉的目的是 。
(2)写出Fe3+水解的离子方程式 。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式
Mg(OH)2
Zn(OH)2
MgCO3
CaCO3
开始沉淀的pH
10.4
6.4
沉淀完全的pH
12.4
8.0
开始溶解的pH
10.5
Ksp
5.6×10-12
6.8×10-6
2.8×10-9
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、氨水
(5)“滤液4”之后的操作依次为 、 、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于__________用代数式表示。
·9·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
衡阳市八中高二六科联赛
化学答案
题号
1
2
3
4
5
6
7
8
9
10
11
答案
C
B
B
C
C
C
A
C
C
C
B
题号
12
13
14
15
16
17
18
19
20
21
答案
C
B
A
D
A
B
B
C
A
C
22、(8分)
(1)吸 (2)> (3)吸 (4)<
23、(18分)
(1)分液漏斗 饱和NaCl溶液
MnO2+4H++2Cl-Mn2++Cl2↑+2H2O debcf
(2)残余液中的MnCl2 也会与AgNO3反应形成沉淀 否 22.60 偏小
(3)没有尾气处理装置
24、(18分)
(1) -227 (2)AC (3)60% 3.375 >
(4)一定不是 BC
(5)a
b起始压强大于a,说明其温度高于a,而该反应是放热反应,温度升高,平衡逆向移动,SO3体积分数减小
25、(14分)
(1)增大反应物接触面积或增大反应速率或使反应更充分
(2)Fe3++3H2O Fe(OH)3+3H+
(3)8.0≤pH<10.4
(4)BD
(5)蒸发浓缩,冷却结晶
(6)125m2/99m1
欢迎访问“高中试卷网”——http://sj.fjjy.org
·9·