- 2021-05-31 发布 |
- 37.5 KB |
- 24页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年广东省中山市第一中学高二上学期第三次统测化学试题 解析版
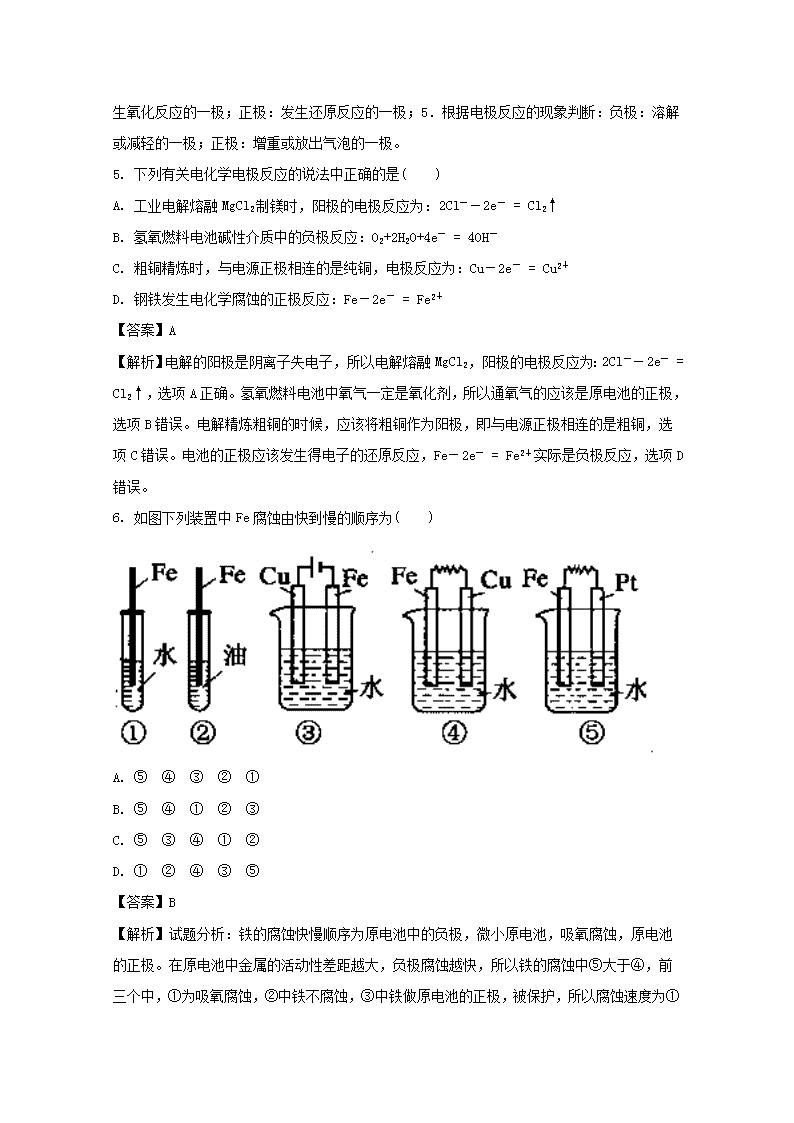
中山市第一中学2017~2018学年第一学期高二年级第三次统测 化学试题 1. 下列事实不能证明HNO2是弱酸的是( ) A. 0.1mol·L-1的HNO2溶液的pH=2 B. 用HNO2溶液做导电性实验时,灯泡很暗 C. 常温下NaNO2溶液的pH>7 D. pH=4的HNO2溶液稀释100倍后,pH<6 【答案】B 【解析】0.1mol·L-1的HNO2溶液的pH=2,说明亚硝酸只电离了一部分,所以证明其实弱酸,选项A能够证明。溶液的导电性由离子浓度决定,所以溶液导电性的强弱无法判断溶质是否弱电解质,选项B不能证明。常温下NaNO2溶液的pH>7,说明NaNO2为强碱弱酸盐,所以说明HNO2为弱酸,选项C能够证明。pH=4的HNO2溶液稀释100倍后,pH<6,说明该溶液存在电离平衡,稀释时电离平衡正向移动了,也就说明HNO2是弱酸,所以选项D能够证明。 点睛:证明一个酸使弱酸的方法主要有:1、配制一定浓度的溶液,测定其pH,发现大于完全电离时的pH;2、找相同浓度的强酸,测定两者的导电性;3、配制某浓度的该酸的钠盐溶液,测其酸碱性;4、配制氢离子达到一定浓度的溶液,稀释一定倍数,再测定氢离子浓度。 2. 下列有关说法正确的是( ) A. AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 B. 向煮沸的1mol·L-1 NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体 C. 等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸 D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除 【答案】D 【解析】试题分析:A、氯化铝是强酸弱碱盐,在氯化铝溶液中,氯化铝水解生成氢氧化铝和氯化氢,因为加热会促进水解正向移动,且氯化氢易挥发,所以水解会进行彻底,蒸干、灼烧至恒重,最终生成氧化铝,错误;B、向煮沸的1mol·L-1NaOH溶液中滴加FeCl3饱和溶液,得到氢氧化铁的沉淀,错误;C、一水合氨是弱碱,部分电离,在溶液中存在电离平衡。等体积pH=12的氨水和pH=12的NaOH溶液中,氨水的物质的量浓度大于氢氧化钠,所以氨水中和HCl的物质的量多,错误;D、碳酸钙比硫酸钙更难溶,硫酸钙存在溶解平衡,当加入饱和碳酸钠溶液后,碳酸根离子与钙离子结合为碳酸钙,发生沉淀转化,使硫酸钙的溶解平衡正向移动,则硫酸钙逐渐转化为碳酸钙,碳酸钙再用酸除去,正确,答案选D。 考点:考查盐的水解平衡、沉淀的溶解平衡、强弱电解质的电离及酸碱混合的判断的知识。 3. 下列叙述正确的是( ) A. pH值相同的醋酸与NH4NO3溶液中水的电离程度相同 B. 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 C. 等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)小 D. FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 【答案】C 【解析】醋酸对于水的电离起到抑制作用,NH4NO3对于水的电离起到促进作用,所以两个溶液中水的电离程度不相同,选项A错误。多元弱酸根的水解一定分步,且越来越困难,所以Na2S中S2-的水解一定强于NaHS溶液中HS-的水解,所以Na2S溶液的碱性更强,pH更大。选项B错误。NH4Cl溶液中的Cl-对于铵根离子的水解无影响,NH4HSO4电离出来的H+对于铵根离子的水解起到抑制作用,所以,等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)小,选项C正确。FeCl3与KSCN反应达到平衡时,加入KCl溶液,实际相当于加水稀释,则无论平衡怎样移动,溶液中溶质的浓度都会减小,颜色变浅。选项D错误。 点睛:对于选项D这类问题,应该注意:溶液中的可逆离子反应,在讨论平衡移动时,应该将方程式转化为离子反应。例如,选项D中的反应应该转化为:Fe3+ + 3SCN- Fe(SCN)3。则加入氯化钾实际不会影响该反应的平衡态,影响反应平衡的是,加入的水产生了稀释效应。 4. ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③电极的质量减轻。据此判断这四种金属活动性由大到小的顺序是( ) A. ①③②④ B. ①③④② C. ③④②① D. ③①②④ 【答案】B 【解析】①②相连时,外电路电流从②流向①,①为负极,金属性①>②;①③相连时,③为正极,①为负极,金属性①>③;②④相连时,②上有气泡逸出,④为负极,金属性④>②;③④相连时,③的质量减少,③为负极,金属性③>④,金属活动性由大到小的顺序是①③④②, 故答案为B。 点睛:原电池正负极的判断方法:1.根据电极材料的活泼性判断:负极:活泼性相对强的一极;正极:活泼性相对弱的一极;2.根据电子流向或电流的流向判断:负极:电子流出或电流流入的一极;正极:电子流入或电流流出的一极;3.根据溶液中离子移动的方向判断:负极:阴离子移向的一极;正极:阳离子移向的一极;4.根据两极的反应类型判断:负极:发生氧化反应的一极;正极:发生还原反应的一极;5.根据电极反应的现象判断:负极:溶解或减轻的一极;正极:增重或放出气泡的一极。 5. 下列有关电化学电极反应的说法中正确的是( ) A. 工业电解熔融MgCl2制镁时,阳极的电极反应为:2Cl--2e- = Cl2↑ B. 氢氧燃料电池碱性介质中的负极反应:O2+2H2O+4e- = 4OH- C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e- = Cu2+ D. 钢铁发生电化学腐蚀的正极反应:Fe-2e- = Fe2+ 【答案】A 【解析】电解的阳极是阴离子失电子,所以电解熔融MgCl2,阳极的电极反应为:2Cl--2e- = Cl2↑,选项A正确。氢氧燃料电池中氧气一定是氧化剂,所以通氧气的应该是原电池的正极,选项B错误。电解精炼粗铜的时候,应该将粗铜作为阳极,即与电源正极相连的是粗铜,选项C错误。电池的正极应该发生得电子的还原反应,Fe-2e- = Fe2+实际是负极反应,选项D错误。 6. 如图下列装置中Fe腐蚀由快到慢的顺序为( ) A. ⑤ ④ ③ ② ① B. ⑤ ④ ① ② ③ C. ⑤ ③ ④ ① ② D. ① ② ④ ③ ⑤ 【答案】B 【解析】试题分析:铁的腐蚀快慢顺序为原电池中的负极,微小原电池,吸氧腐蚀,原电池的正极。在原电池中金属的活动性差距越大,负极腐蚀越快,所以铁的腐蚀中⑤大于④,前三个中,①为吸氧腐蚀,②中铁不腐蚀,③中铁做原电池的正极,被保护,所以腐蚀速度为①大于②大于③,故选B 。 考点:金属腐蚀的快慢比较。 7. 下列有关金属腐蚀与防护的说法正确的是( ) A. 破损的镀铜铁在潮湿的空气中更易被腐蚀 B. 金属腐蚀就是金属原子失去电子被还原的过程 C. 当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用 D. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了外接电源的阴极保护法 【答案】A 【解析】破损的镀铜铁在潮湿的空气会形成铁铜原电池,其中铁为负极被氧化,所以铁会更快被腐蚀,选项A正确。金属腐蚀就是金属原子失去电子被氧化的过程,选项B错误。镀锡铁制品的镀层破损时,形成原电池,因为铁比锡活泼,所以铁为负极,很快被腐蚀,所以破损的锡层未对铁制品起保护作用,选项C错误。在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法,选项D错误。 8. 关于下列装置说法正确的是( ) A. 装置①中,盐桥中的Cl-移向CuSO4溶液 B. 装置②工作一段时间后,a极附近溶液的pH降低 C. 装置③中钢闸门应与外接电源的正极相连获得保护 D. 装置④中电子由Zn经导线流向Fe,Zn极发生氧化反应 【答案】D 【解析】原电池中,阴离子向负极移动。锌比铜活泼,锌为负极,所以盐桥中的Cl-移向ZnSO4溶液,选项A错误。装置②a电极是电解氯化钠溶液的阴极,其反应为2H+ + 2e- = H2↑,水电离的氢离子转化为氢气,剩余了水电离的氢氧根离子,所以溶液的pH升高,选项B错误。保护金属时,应该将金属连接在电源的负极上,以保证金属不会失电子被氧化,选项C错误。装置④中Zn比Fe活泼所以Zn为负极,电子由Zn经导线流向Fe,Zn极发生失电子的氧化反应,选项D正确。 9. 已知通过乙醇制取氢气有如下两条路线: a.CH3CH2OH(g)+H2O(g)═4H2(g)+2CO(g)△H= + 255.6 kJ·mol-1 b.CH3CH2OH(g)+O2(g)═3H2(g)+2CO(g)△H= + 13.8 kJ·mol-1 则下列说法不正确的是( ) A. 降低温度,可提高b路线中乙醇的转化率 B. 从能量消耗的角度来看,b路线制氢更加有利 C. 乙醇可通过淀粉等生物原料发酵制得,属于可再生资源 D. 由a、b知:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ·mol-1 【答案】A 【解析】试题分析:A、降低温度,会降低b路线中平衡逆向移动,乙醇的转化率,错误;B、b反应发生时需要吸收的热量少,所以从能量消耗的角度来看,b路线制氢更加有利,正确;C、乙醇可通过淀粉等生物原料发酵制得,属于可再生资源,正确;D、根据盖斯定律,(b-a)×2得:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,正确。 考点:反应热、盖斯定律 点评: 10. 下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是( ) 提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓ 选项 滴定管中的溶液 锥形瓶中的溶液 指示剂 滴定终点颜色变化 A NaOH溶液 CH3COOH溶液 酚酞 无色→浅红色 B HCl溶液 氨水 甲基橙 黄色→橙色 C 酸性KMnO4溶液 K2SO3溶液 无 无色→浅紫红色 D 碘水 Na2S溶液 淀粉 蓝色→无色 A. A B. B C. C D. D 【答案】D 11. 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下: (1)CuSO4+Na2CO3 主要:Cu2++CO+H2O===Cu(OH)2↓+CO2↑ 次要:Cu2++CO===CuCO3↓ (2)CuSO4+Na2S 主要:Cu2++S2-===CuS↓ 次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑ 下列几种物质的溶解度大小的比较中,正确的是( ) A. CuS查看更多
- 当前文档收益归属上传用户
- 下载本文档