- 2021-05-28 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第1讲 化学能与热能-6焓变与反应热
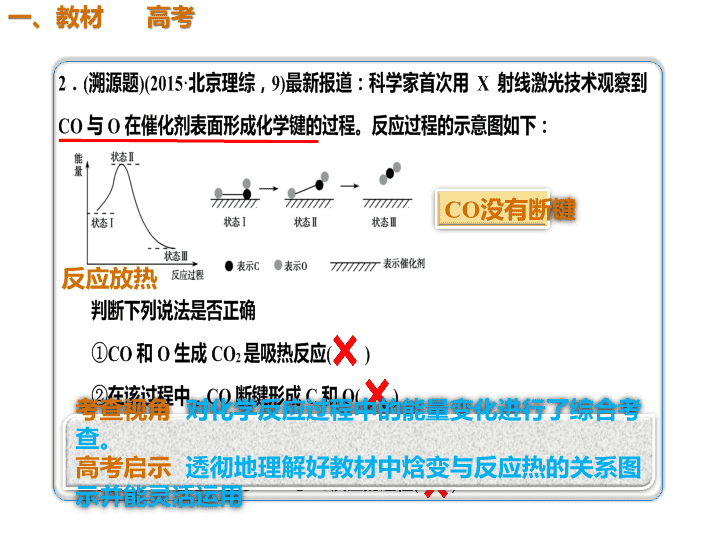
反应放热 3.(2018·邯郸期末)已知 CH4(g)+4F2(g)===CF4(g)+4HF(g) ΔH=a kJ·mol-1。 则a等于( ) A.-1 928 B.+1 928 C.+1 838 D.-1 838 化学键 C — H C — F H — F F — F 键能/(kJ·mol-1) 41 4 48 9 56 5 15 8 A 解析 由表格数据及反应可知,ΔH=414 kJ·mol- 1×4+158 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=a kJ·mol-1,解得a=-1 928,故选A。 试 题 备 选 焓变 = 反应物的总键能 - 生成 物的总监能 2.(2017·河北三市二联)某反应使用催化剂后,其 反应过程中能量变化如图。 下列说法错误的是( ) A.总反应为放热反应 B.使用催化剂后,活化能不变 C.反应①是吸热反应,反应②是放热反应 D.ΔH=ΔH1+ΔH2 B 解析 由题图可知,反应①是吸热反应,反应②是 放热反应,总反应是放热反应,且ΔH=ΔH1+ΔH2, A、C、D项正确;使用催化剂能降低反应所需的活 化能,B项错误。 【试题备选】 1.正确运用反应热ΔH的基本计算公式 ΔH=生成物的总能量-反应物的总能量 ΔH=反应物的总键能之和-生成物的总键能 之和 2.熟悉掌握常见物质中的化学键数目 解答能量变化图像题的“三”关键 (1)注意活化能在图示中的意义。 ①从反应物至最高点的能量数值表示正反应的活 化能; ②从最高点至生成物的能量数值表示逆反应的活 化能。 (2)催化剂只影响正、逆反应的活化能,而不影 响反应的ΔH。 (3)设计反应热的有关计算时,要切实注意图示 中反应物和生成物的物质的量。查看更多