- 2021-05-28 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中物理选修3课件-10热力学第二定律的微观解释
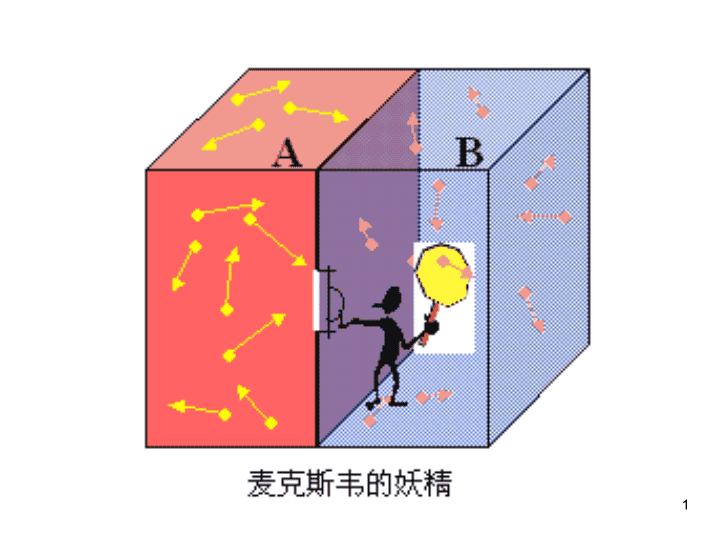
1 § 一个“妖精”,神通广大,能跟踪充满容器的每个 气体分子的运动。把这个容器用一道隔板分为A , B两部分,并在隔板上安装一个阀门,当阀门打开 时单个气体分子可以从容器的一部分经过阀门进入 另一部分去。 假设这个容器开始时完全充满了一定温度的气体, 按照热的动力论,一定的温度对应于分子的一定的 平均温度,因为气体分子的运动具有随机性质,有 的分子的速度将大于平均值,有的则将小于平均值。 妖精在适当的时候打开阀门,让快的分子从B 进入 A,慢的分子从A进入B ,结果不须消耗能量,B 部分的温度就下降,A部分的温度就上升,热量可 以自发地从低温物体流向高温物体。 2 § 一般的解释是:妖精必须得到一些“知 识”,才能把“快”分子和“慢”分子 区分开来。为了获得这些信息,要不要 消耗能量?如果需要,则容器、气体、 隔板、妖精作为封闭系统,为得到所要 信息所需的能量,将不大于因利用这一 信息而消耗的能量,并没有违反热力学 第二定律。 3 麦克斯韦的妖精能破坏热力学第二定律吗? 自发总是从有序到无序演化 § 但是麦克斯韦的妖精可以使其向有序化发 展,酶,就是生命中的麦克斯韦的妖精; 而人类全体作为麦克斯韦的妖精,增加着 社会的有序度。毕竟,“妖精”,用通俗 的话说,是个生物,也是个信息系统, “妖精”就是对宇宙演化的一种抗争。 4 5 热力学第二定律的 微观解释 6 热力学第一定律给出了各种形式的能量在相互转化 过程中必须遵循的规律,但并未限定过程进行的方向。 凡符合热一律的过程---即符合能量守恒的过程是 否都能实现呢? 实验表明,自然界中一切与热现象有关的宏观过程都 是有方向性的。 热传导过程 A B A B 例如:气体的绝热自由膨胀过程。 这些典型例子说明自然界的实际过程是按一定的 方向进行的,相反方向的过程不能自动发生,或者说, 如果可以发生,则必然引起其它后果。 7 热力学第一定律无法对这类问题作出解释,需要 一个独立于热力学第一定律的新的自然规律,即热力 学第二定律来解释。 – 不可能从单一热源吸取热量,使之完全变成 有用的功而不产生其他影响。 功可以完全变热,但要把热完全变为功而不产生其它 影响是不可能的。 以热机为例,热机的循环除了热变功外,还必定有一 定的热量从高温热源传给低温热源,即产生了其它效果。 8 热全部变为功的过程也是有的,如,理想气体等温膨 胀。但这时引起了其它的变化。 开尔文表述否定了热机效率能达百分这百的可能性 高温热源T1 热机 A 吸Q 吸 放吸 Q QQ || 1 =0 第二类永动机(单热机)不 能制成。 第二类 永动机 9 高温热源 T1 低温热源T2 吸Q 放Q 与之相应的经验事实是,当 两个不同温度的物体相互接触时, 热量将自动地由高温物体向低温 物体传递,而不可能自发地由低 温物体传到高温物体。 如果借助制冷机,当然可以把 热量由低温传递到高温,但要以 外界作功为代价,也就是引起了 其它变化。克氏表述指明热传导 过程是有方向的。 2、克劳修斯表述 – 热量不能自动地从低温热源传到高温热源而 不引起其它的变化。 10 1.从开尔文表述入手 假定单热机是可以 造成的,则 高温源 低温源Q 高温热源 T1 低温热源 T2 1Q AQ 2 单热机 2Q 致冷机 高温热源 T1 低温热源 T2 2Q A )( 1Q 3、两种表述是统一的 2.从克劳修斯表述入手 高温热源 T1 低温热源 T2 2Q 热机 2Q A1Q 高温热源 T1 21 QQ A 单热机 假定热量能 自动地从低温源 传到高温源,则 单热机也能造成。 热力学过程是有方向性的。 11 为了进一步研究热力学第二定律的含义和热力学过 程方向性问题,引入可逆过程的概念。 一个系统,由一个状态出发经过某一过程达到另 一状态,如果存在另一个过程,它能使系统和外界完 全复原(即系统回到原来状态,同时消除了原过程对 外界引起的一切影响)则原来的过程称为可逆过程; • 单摆运动:一个单摆,如果不受空气阻力及其它摩 擦力,当它离开某一位置后,经过一个周期又回到原 来的位置而周围一切都无变化。 反之,如果物体不能回复到原来状态或当物体回 复到原来状态却无法消除原过程对外界的影响,则原 来的过程称为不可逆过程。 无摩擦和阻力的单摆运动是一个可逆过程。 12 单纯的无机械能耗散的机械运动过程都是可逆过程。 • 理想气体绝热自由膨胀是不可逆的。 在隔板被抽去的瞬间,气体聚集在左半 部,这是一种非平衡态,此后气体将自 动膨胀充满整个容器。最后达到平衡态。 其反过程由平衡态回到非平衡态的过程 不可能自动发生。 A 在热现象中,可逆过程只有在准静态和无摩擦的 条件下才有可能。无摩擦准静态过程是可逆的。 经验和事实表明,自然界中真实存在的过程都是按一 定方向进行的,都是不可逆的。 • 理想气体热传导过程是不可逆的。热量总是自动地 由高温物体传向低温物体,从而使两物体温度相同, 达到热平衡。从未发现其反过程,使两物体温差增大。 13 可逆传热的条件是:系统和外界温差无限小,即等温 热传导。 • 气体的迅速膨胀过程是不可逆的。 但是当气体膨胀非常缓慢又没有其它摩擦时,它 却是可逆的。 结论: 1)一切自发过程都是不可逆过程。 2)准静态过程(无限缓慢) +无摩擦的过程是可逆过 程。 3)一切实际过程都是不可逆过程。 可逆过程是一种理想的极限,只能接近,绝不能 真正达到。因为,实际过程都是以有限的速度进行, 且在其中包含摩擦,粘滞,电阻等耗散因素,必然是 不可逆的。 14 可逆过程是理想化的过程。 强调:不可逆过程不是不能逆向进行,而是说当过程 逆向进行时,逆过程在外界留下的痕迹不能将原来正 过程的痕迹完全消除。 l 热力学第二定律说明了自然界的实际过程是按一 定的方向进行的,是不可逆的,相反方向的过程不 能自动发生,或者说,如果可以发生,则必然引起 其它后果。 开氏表述实质上在于说明功变热的过程是不可逆的。 热力学第二定律的实质在于指出:一切与热现象有关 的实际宏观过程都是不可逆的。它所揭示的客观规律 向人们指出了实际宏观过程进行的条件和方向。 克氏表述实质上在于说明热传导过程是不可逆的。 15 • 不可逆过程的统计性质(以气体自由膨胀为例) 下面从统计观点探讨过程的不可逆性微观意义,并 由此深入认识第二定律的本质。 热力学第二定律的微观意义:一切自然过程总是沿着 无序性增大的方向进行。 在热力学中,序:区分度。 对于一个热力学系统,如果处于非平衡态,我们 认为它处于有序的状态,如果处于平衡态,我们认为 它处于无序的状态。 首先理解有序和无序的概念。 一个被隔板分为A、B相等两部分的容器,装有4 个涂以不同颜色分子。 • 热力学第二定律的微观意 义 16 分布 (宏观态) 详细分布 (微观态) 1 4 6 4 1 开始时,4个分子都在A部,抽出隔板后分子将向B部 扩散并在整个容器内无规则运动。隔板被抽出后,4 分子在容器中可能的分布情形如下图所示: A B 17 微观态共有24=16种可能的方式,而且4个分子全 部退回到A部的可能性即几率为1/24=1/16。 一般来说,若有N个分子,则共2N种可能方式,而 N个分子全部退回到A部的几率1/2N.对于真实理想气 体系统N 1023/mol,这些分子全部退回到A部的几率 为 。此数值极小,意味着此事件永远不会发生。 从任何实际操作的意义上说,不可能发生此类事件。 231021 对单个分子或少量分子来说,它们扩散到B部的过 程原则上是可逆的。 对大量分子组成的宏观系统来说,它们向B部自由 膨胀的宏观过程实际上是不可逆的。这就是宏观过程 的不可逆性在微观上的统计解释。 18 • 第二定律的统计表述(依然看前例) 4个分子在容器中的分布对应5种 宏观态。 分布 (宏观态) 详细分布 (微观态) 左边一列的各种分布仅指出A、B两边各有几个分子, 代表的是系统可能的宏观态。中间各列是详细的分布, 具体指明了这个或那个分子各处于A或B哪一边,代表 的是系统的任意一个微观态。 一种宏观态对应若干种微观态。 在一定的宏观条件下,各种可能的宏 观态中哪一种是实际所观测到的? 不同的宏观态对应的微观态数不同。 均匀分布对应的微观态数最多。 全部退回A边仅对应一种微观态。 19 统计物理基本假定—等几率原理:对于孤立系,各种 微观态出现的可能性(或几率)是相等的。 各种宏观态不是等几率的。那种宏观态包含的微 观态数多,这种宏观态出现的可能性就大。 定义热力学几率:与同一宏观态相应的微观态数称为 热力学几率。记为 。 在上例中,均匀分布这种宏观态,相应的微观态最多, 热力学几率最大,实际观测到的可能性或几率最大。 所以,实际观测到的总是均匀分布这种宏观态。 即系统最后所达到的平衡态。 对于1023个分子组成的宏观系统来说,均匀分布这 种宏观态的热力学几率与各种可能的宏观态的热力学 几率的总和相比,此比值几乎或实际上为100%。 20 对整个宇宙不适用。 如布朗运动。 平衡态相应于一定宏观条件 下 最大的状态。 热力学第二定律的统计表述:孤 立系统内部所发生的过程总是从 包含微观态数少的宏观态向包含 微观态数多的宏观态过渡,从热 力学几率小的状态向热力学几率 大的状态过渡。 自然过程总是向着使 系统热力学几率增大 的方向进行。 注意:微观状态数最大 的平衡态状态是最混乱、 最无序的状态。 一切自然过程总是沿 着无序性增大的方向 进行。 1)适用于宏观过程对微观过程不适用, 2)孤立系统有限范围。 § 可爱的熵 § 物理学中有个熵定律,也就是著名的热力学第二定律。 “熵”的名称是由德国物理学家道尔夫·克劳修斯于 1868年造出来的,它代表着宇宙中不能再被转化做功的 能量的总和的测定单位,即熵的增加表示宇宙物质的日 益混乱和无序,是无效能量的总和。熵本身既不是好事, 也不是坏事;它意味着腐败和混乱,但它同时也意味着 生命本身的展开──不论是有机的,还是无机的生命。 卡农、乔治·梅特勒的大爆炸学说也认为,宇宙是以有 序的状态开始,不断地向无序状态发展,它与热力学第 二定律是相符的。热力学第一定律说明能量是守恒的、 不灭的,只能从一种形式转变到另一种形式;热力学第 二定律(熵定律)却表明:能量不可逆转地沿着一个方 向转化,即从对人类来说是可利用的变为不可利用的状 态。 21 § 有效能量告罄时,是“热寂”──死寂的热平衡 状态。 有效物质耗尽时,是一片“物质混乱”──整个 宇宙的大混乱和大混沌。 古罗马诗人贺拉斯说:“时间磨灭了世界的价 值!”可谓一语道破了熵定律的真谛。 物理学家们认为,熵定律是物质世界的最终定 律,人类参与的每一项物质活动都受到热力学 第一、第二定律的严密制约;但是,他们 又认为熵定律只涉及物质世界,只控制时空的 横向世界,人类的精神世界并不受熵定律的专 制统治! 所以,生命的现象是宇宙洪流中的一股逆流! 人类精神的无限发展,是不可抗拒的熵增大长 河中的一条逆流之舟! 22 感谢的你的耐心! 23查看更多