- 2021-05-28 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学 元素周期律 (3)
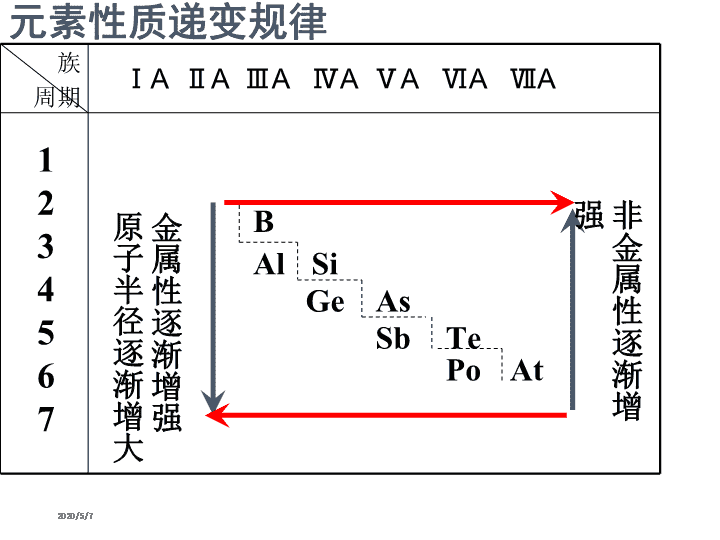
元素周期律 (第二课时) 2020/5/7 2020/5/7 元素性质递变规律 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 族 周期 金 属 性 逐 渐 增 强 原 子 半 径 逐 渐 增 大 1 2 3 4 5 6 7 B Al Si Ge As Sb Te Po At 非 金 属 性 逐 渐 增 强 2020/5/7 下列说法不正确的是( ) A.离子半径:Na+<F- B.原子半径:Na>Be C.硫元素所呈现的正化合价只有+6价 D.只有非金属元素存在负化合价,金属元 素没有负化合价 2020/5/7 第三周期元素金属性/非金属性 递变规律的探究 预测: Na Mg Al 电子层数相同,核电荷数增大,半径减小 失电子能力减弱 金属性减弱 2020/5/7 元素金属性 强弱判断依据学法点拨 单质与水(或酸)反应置换出氢的难易程度。 置换出氢越容易,则金属性越强。 最高价氧化物的水化物——氢氧化物的碱 性强弱。碱性越强,则原金属元素的金 属性越强。 2020/5/7 è每个小组讨论的声音以不影响别的小组为宜 è每个小组成员要听从组长安排,学会合作 è小组成员之间应该相互尊重,积极发言,但同时也要善于倾听别人意 见 è每个小组须指派一名语言表达能力较强的同学对本组设计的实验方案 作全班发言 è讨论时间约3分钟 温馨提示 2020/5/7 •组长明确分工(实验操作、现象纪录、仪器药 品处理等) •尊重实验事实,详细纪录实验所用药品、客观 纪录实验观察到的现象 •勤于思考,敢于提出实验中遇到的问题 •实验时间约7分钟 2020/5/7 Na Mg Al 单质与水 (或酸)反 应难易程 度 与冷水反 应剧烈 与冷水反应缓 慢,与沸水反 应迅速、与酸 反应剧烈,放 出氢气。 在热水中无 明显现象 与酸反应不 如金属镁和 酸反应剧烈 最高价氧 化物对应 水化物碱 性强弱 NaOH 强碱 Mg(OH)2 中强碱 Al(OH)3 两性氢氧 化物 金属性:Na>Mg>Al 2020/5/7 第三周期元素金属性的递变规律: Na Mg Al 金属性逐渐减弱 知识总结 方法总结 2020/5/7 2020/5/7 2020/5/7 2020/5/7 元素的性质随着元素原子序数的 递增而呈周期性变化,这个规律 叫元素周期律。 2020/5/7 元素性质递变规律 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 族 周期 金 属 性 逐 渐 增 强 单 质 还 原 性 增 强 原 子 半 径 逐 渐 增 大 1 2 3 4 5 6 7 B Al Si Ge As Sb Te Po At 非金属性逐渐增强 原子半径逐渐减小 单质氧化性增强 金属性逐渐增强 非 金 属 性 逐 渐 增 强 2020/5/7 1. 元素性质呈周期性变化的决定因素是 ( ) A.元素原子半径大小呈周期性变化 B.元素相对原子质量依次递增 C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化 2020/5/7 2.(08山东卷)下列说法正确的( ) A.SiH4比CH4稳定 B.O2―半径比F―的小 C.Na和Cs属于第ⅠA族元素,Cs失电子能 力比Na的强 D.P和As属于第ⅤA族元素,H3PO4酸性比 H3AsO4的弱查看更多