- 2021-05-27 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省厦门实验中学2021届高三化学10月月考试卷(Word版附答案)
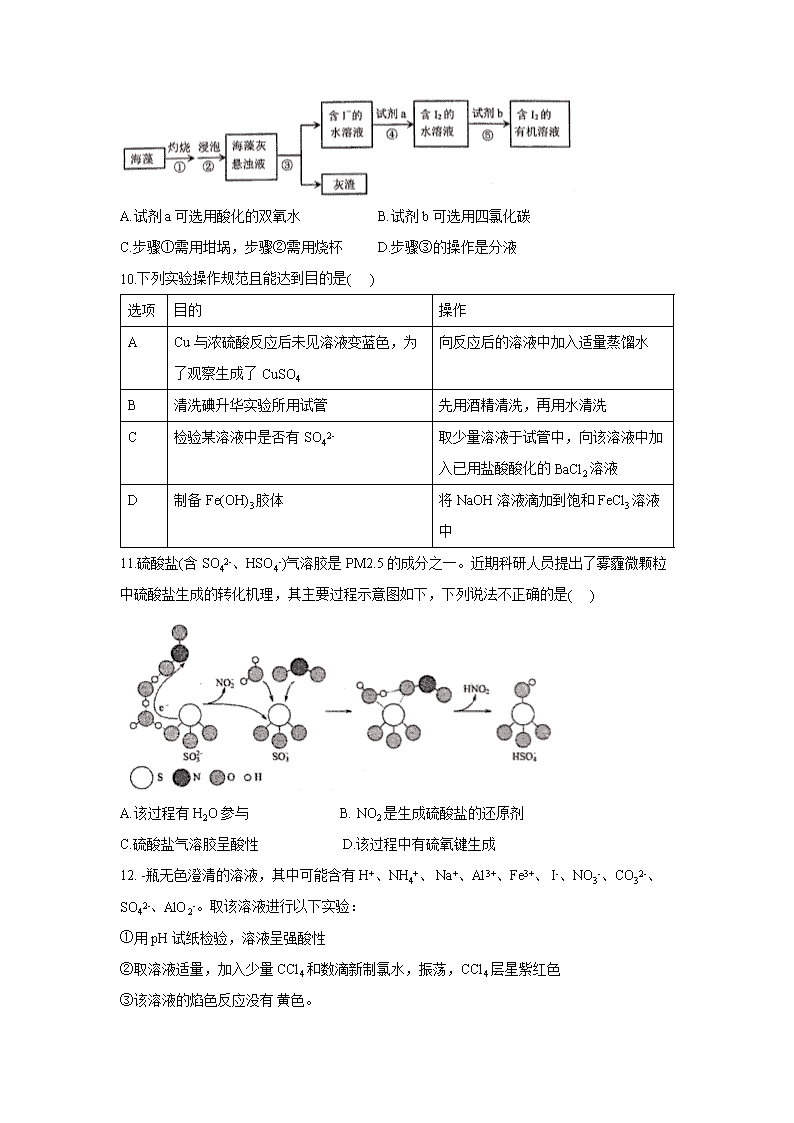
福建省厦门实验中学2020-2021学年高三上十月份月考 化学试题 本试卷共8页,100 分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Na 23 Cl 35.5 一、本部分共14题,每题3分,共42分,在每题的4个选项中,选出最符合题目要求的一项。 1.化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( ) A.《本草经集注》 中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也",该方法应用了焰色反应 B..我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅 C.浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品 D.误食重金属盐引起的人体中毒,可喝大量的食盐水解毒 2.下列物质的应用中,利用了氧化还原反应的是( ) A.用石灰乳脱除烟气中的SO2 B.用84消毒液(有效成分NaCIO)杀灭细菌 C.用明矾[KAl(SO4)2·12H2O]处理污水 D. 用盐酸去除铁锈(Fe2O3·xH2O) 3.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是( ) A.保存《千里江山图》需控制温度和湿度 B.孔雀石、蓝铜矿颇料不易被空气氧化 C.孔雀石、蓝铜矿颜料耐酸耐碱 D. Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3 4.根据表中信息,判断下列叙述中正确的是( ) 序号 氧化剂 还原剂 其他反应物 氧化产物 还原产物 ① Cl2 FeBr2 / Fe3+、Br2 ② KClO3 浓盐酸 / Cl2 ③ KMnO4 H2O2 H2SO4 O2 Mn2+ A.反应①中,当只有少量Cl2时,发生反应Cl2+2Br-= 2C1-+Br2 B.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2 C.②中反应的还原产物是Cl2,电子转移数目是5e- D.③中反应的离子方程式为2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O 5.室温下,下列各组离子在指定溶液中能大量共存的是( ) A.能使甲基橙变红的溶液:Na+、 Ca2+、Br-、 HCO3- B. =1×10-12的溶液:K+、 Na+、CO32-、AlO2- C.0.1 mol/LKFe(SO4)2溶液:Mg2+、Al3+、 SCN-、NO3- D.0.1 mol/LCa5NH4(NO3)11溶液:H+、 Fe2+、Cl-、SO42- 6.在给定条件下,下列选项所示的物质间转化均能实现的是( ) A. Na Na2ONa2CO3 B. Fe Fe2O3 Fe(OH)3 C. NaCl (aq)NaHCO3(s) Na2CO3 (s) D. Al2O3 Al3+ AlO2- 7.下列说法正确的是( ) A.同温同压下,H2 和Cl2的密度相同 B.物质的量相同的Na2O和Na2O2所含的离子数目相同 C.质量相同的H2O和NH3所含的原子数相同 D.室温下,物质的量浓度相同的NaHCO3和Na2CO3溶液的pH相同 8.下列离子方程式能用来解释相应实验现象的是( ) A.铁粉溶于足量稀硝酸3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O B.偏铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀H2O+AlO2-+HCO3-= Al(OH)3↓ + CO32- C.饱和氧化铁溶液滴入沸水,溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+ D.硫代硫酸钠与稀硫酸的反应:S2O32-+6H++2SO42-=4SO2↑+3H2O 9.实验室中,从海藻里提取碘的部分流程如下图。下列说法中,不正确的是( ) A.试剂a可选用酸化的双氧水 B.试剂b可选用四氯化碳 C.步骤①需用坩埚,步骤②需用烧杯 D.步骤③的操作是分液 10.下列实验操作规范且能达到目的是( ) 选项 目的 操作 A Cu与浓硫酸反应后未见溶液变蓝色,为了观察生成了CuSO4 向反应后的溶液中加入适量蒸馏水 B 清洗碘升华实验所用试管 先用酒精清洗,再用水清洗 C 检验某溶液中是否有SO42- 取少量溶液于试管中,向该溶液中加入已用盐酸酸化的BaCl2溶液 D 制备Fe(OH)3胶体 将NaOH溶液滴加到饱和FeCl3溶液中 11.硫酸盐(含SO42-、HSO4-)气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下,下列说法不正确的是( ) A.该过程有H2O参与 B. NO2是生成硫酸盐的还原剂 C.硫酸盐气溶胶呈酸性 D.该过程中有硫氧键生成 12. -瓶无色澄清的溶液,其中可能含有H+、NH4+、 Na+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验: ①用pH试纸检验,溶液呈强酸性 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层星紫红色 ③该溶液的焰色反应没有 黄色。 根据以上实验结果,下列推断正确的是( ) A.向该溶液中加入BaCl2不定能观察到白色沉淀 B.可以确定没有 Na+、Fe2+、 CO32-、AlO2-,不能确定是否有NO3- C.该溶液可能是NH4NO3与HI的混合 D. 一定没有Al3+、CO32-和NO3- 13.下列“实验结论”与“实验操作及现象“不相符的一组是( ) 选项 实验操作及现象 实验结论 A 向KI-淀粉溶液中滴加氯水,溶液变成蓝色 氧化性: Cl2>I2 B 将钠放入热坩埚中加热燃烧,生成淡黄色固体 反应有Na2O2生成 C 将湿润的有色纸条放入盛有干燥氣气的集气瓶中,盖上玻璃片,一段时间后纸条褪色 氯气具有漂白性 D 向某溶液中加入几滴AgNO3溶液,有白色沉淀生成,再加入少量稀硝酸,沉淀不溶解 溶液中可能含有Cl- 14.高铁酸钾(K2FeO4)作 为多功能水处理剂具有广泛的用途,下面是利用次氣酸盐在碱性条件下氧化硝酸铁制备K2FeO4的生产工艺流程图: 下列判断正确的是( ) A.反应①中氯气只起氧化剂的作用 B.溶液I的溶质只有KClO C.反应③中氧化剂与还原剂的物质的量之比为1 :1 D.溶液I的溶质成分中含有K2FeO4 二、本部分共4题,共58分。 15. (20分) I.从化合价的角度认识氯的化合物 (1)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备CIO2的反应原理如下: 2NaClO+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl ①该反应中,氧化剂是______,氧化产 物是______,氧化剂和还原剂的物质的量之比为 ______ ,依据氧化还原反应规律判断,氧化性强弱为NaClO3_____Cl2 (填>、<或=)。 ②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-) ,需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是____ (填字母序号) 。 a. FeSO4 b. O3 c. KMnO4 d.SO2 (2)亚氨酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下: 请将流程中发生的两个反应的离子方程式补充完整: ①口ClO3-+口SO2= 口SO42-+口______ ②口ClO2+H2O+口_____ =口C1O2-+口O2↑+口_______。 II.某化学兴趣小组同学为验证氯气的性质并制备少量干燥的氯化铁,设计并进行如下实验。回答下列问题: (1)写出A中制取氯气的化学方程式_________________。 (2)B装置的作用是_________________。 (3)实验时C中可观察到的现象是_____________________。 (4) D瓶盛放的试剂是_______________。 (5) E中发生反应的化学方程式是_________________。 (6) F瓶溶液的作用是___________,写出发出反应的离子方程式__________________。 16. (12分)亚硝酰氯(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.59℃,沸点-5.59℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。 (1)将5 g经300℃下干燥了3h并研细的KCI粉末装50 mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002 mol NO2。反应12~ 36 min即可完成,NO2 红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为______,氯化钾需要“干燥"的原因是_____________。 (2)实验室可由氯气与-氧化氮在 常温常压下合成亚硝酰氯,装置如图所示: ①仪器a的名称为______________。 ②B装置的作用是_________________。 ③实验开始时,先打开K1,关闭K2、 K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C.中________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。 (3)测定产品纯度:取(2)中 w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应) ①盛装AgNO3标准溶液的滴定管是_____(填“酸式”或“碱式")棕色滴定管;判断达到滴定终点的方法是____________。 ②该产品纯度为___________(用代数式表示)。 17. (13 分)氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为: 已知:I.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。 II.有关氢氧化物开始沉淀和完全沉淀的pH如下表: 氢氧化物 Fe(OH)3 Fe(OH)2 开始沉淀的pH 1.5 6.5 沉淀完全的pH 3.7 9.7 (1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是_______。 碳酸锶与盐酸反应的化学方程式为____________。 (2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为________,能否用新制氯水代替双氧水___________(填“能”或“否”)。 (3)在步骤②-③的过程中,将溶液的pH值由1调节至___ ;宜用的试剂为_____。 A.氨水 B.氢氧化锶粉末 C.碳酸钠晶体 D.氧化锶粉末 (4)操作③中所得滤渣的主要成分是_______(填化学式)。 (5)工业上用50~60°C热风吹干六水氯化锶,选择该温度的原因是_____________。 (6)步骤⑥中,洗涤氯化锶晶体最好选用______________。 A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液 18. (13分) 焦亚硫酸钠(Na2S2O5)是一种食品添加剂,实验室用如图装置制备Na2S2O5,实验步骤如下: (1)原料气(SO2)的制备 ①装置A中盛装药品之前需要进行的操作是__________ ;装置B的作用之一是观察SO2 的生成速率,其中的试剂最好选用___________(填字母)。 a蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液 ②D中盛放溶液的溶质的化学名称是_____________。 (2)焦亚硫酸钠(Na2S2O5)的制备 ①Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是______________,步骤III中测定溶液的pH的方法是___________; pH>4.1时,则产品中会有副产物,其化学式是_____。 ②结晶脱水生成产品的化学方程式为______________。 (3)产品含量的测定: 测定广品中焦亚硫酸钠的貭量分数,已知S2O52-+2I2+3H2O=2SO42-+4I-+6HH+; 2S2O32-+I2=S4O62-+2I-。请补充实验步骤(可提供的试剂有焦亚硫酸钠祥品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。 ①精确称量0.2000 g焦正硫酸钠祥品放入碘量瓶(帶磨ロ塞的锥形瓶)中; ②准确移取V mL的辻量的c1 mol/L的标准碘溶液(过量)并记录数据,在暗处放置5 min,然后加入5mL冰醋酸及适量蒸馏水; ③加入淀粉溶液,用c2 mol/标准Na2S2O3溶液滴定至溶液____,读数; ④重复步骤①~③;根据相关记录数据计算出平均值;标准Na2S2O3溶液为V2 mL。 ⑤产品中焦亚硫酸钠的貭量分数为__________(用含有c1、c2、V1、V2的式子表示)。 福建省厦门实验中学2020-2021学年高三上十月份月考 化学试题参考答案 第一部分 选择题(共42分) 本部分共14题,毎题3分,共42分,在毎题列出的4个选项中,选出最符合题目要求的一项。 一、1-5:ABCCB 6-10:ABBDB 11-14:BACD 第二部分 非选择题(共58分) 二、(共58分) 15. (20分) I.(10分) (1)①NaClO3;Cl2;1:l;> (毎空l分)。 ②ad (2分,迭対一个得l分,有錯得0分) (2)反应①2ClO3-+SO2=SO42-+2ClO2(2分) 反应②2ClO2+ H2O2+2OH-=2ClO2-+O2↑+2H2O (2分) II. (10分) (1) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2分) (2)除去氯气中的氯化氢杂质(l分) (3)先变红,后褪色。(1分) (4)浓H2SO4 (l分) (5)2Fe+3Cl2=2FeCl3(2分) (6)尾气吸收,防止汚染坏境(1分,答出其中一点即可,其它表达正确也可得分) Cl2+2OH-=Cl-+ClO-+H2O(2分) 16. (12分) (1)KNO3(1分) NOCl遇水易水解,NO2与水反应(2分) (2) ①蒸留烧瓶(1分);②除去NO中的NO2 (2分);③红棕色气体完全消失 (1分) (3)①酸式(1分);溶液中恰好 出现砖红色沉淀且半分钟内不消失(2分) ②%(2分) 17.(13分) (1)加怏反应速率(1分);SrCO3+2HCl=SrCl2+2H2O+CO2↑ (2分) (2) 2Fe2++H2O2+2H+=2Fe3++ H2O (2分);能 (1分) (3)3.7 (1分); BD (1分); (4)Fe(OH)3、 BaSO4(2分) (5)温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃,氯化锶晶体中的結晶水也会失去(2分) (6) D (1分) 18. (13分) (1)检查装置气密性(1分) (2)c (1分) (3)氢氧化钠(1分) (4)Na2S2O5与水反应生成NaHSO3,NaHSO3在水中电离程度大于水解程度,使溶液是酸性(2分) (5)用pH汁测定(1分) (6)Na2SO3(1分) (7) 2NaHSO3=Na2S2O5+ H2O (2分) (8).由蓝色恰好变为无色,且半分中内不变色(2分) (9)47.5(c1V1-- c2V2)% (2分)查看更多