- 2021-05-27 发布 |
- 37.5 KB |
- 57页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【创新设计】高考化学二轮复习简易通知能提升课件:第3讲 两种重要的化学反应 (高考命题视角+考场失分防范+学科素养提升)
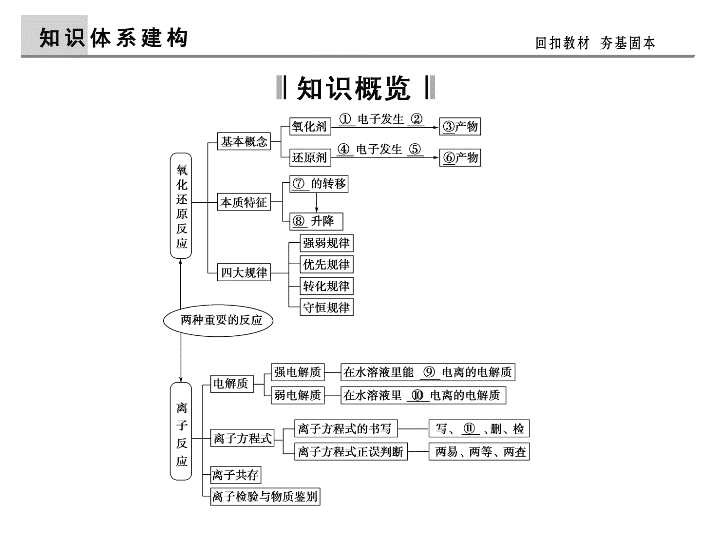
第3讲 两种重要的化学反应 【考纲点击】 1.了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。 2.初步掌握用化合价升降法进行氧化还原反应方程式的配平。 3.了解离子反应的概念、离子反应发生的条件。了解常见离子的检验方法。 4.能正确书写化学方程式、离子方程式,并能进行有关计算。 【自查自纠】 ①得到 ②还原反应 ③还原 ④失去 ⑤氧化反应 ⑥氧化 ⑦电子 ⑧化合价 ⑨完全 ⑩部分 ⑪拆 答案 电解是非自发的氧化还原反应,不遵守氧化还原反应的一般规 律。所以不能得出该结论。 2.离子方程式的正误判断的“两易、两等、两查”分别指什么意思? 答案 离子方程式的正误判断中的“两易”是易溶、易电离的物质 (可溶的强电解质包括强酸、强碱、大多数可溶性的盐)以实际参加反应的离 子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示;“两等” 是离子方程式两边的原子个数、电荷总数均应相等;“两查”是检查各项化 学计量数是否有公约数,是否漏写必要的反应条件。 知识链接 (1)氧化还原反应相关概念间的联系: 考点一 氧化还原反应的概念辨析及规律应用 角度1 氧化还原反应概念间的关系和本质[2013·山东理 综,28(2)] (2)元素化合价的变化是氧化还原反应的外观表现,是氧化还原反应 的判断依据,电子转移是氧化还原反应的实质。 知识链接 物质氧化性还原性的强弱取决于物质得失电子的难易程度与得失电 子的数目无关,可从反应“氧化剂+还原剂===氧化产物+还原产物”判断, 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物;也可从“热>冷 (温度)”“浓>稀(浓度)”、“易>难”(反应条件、剧烈程度),以及金属活动 性顺序表,元素在周期表中位置,原电池与电解池中物质或离子放电顺序等 角度判断。 角度2 氧化还原反应的强弱规律(2011·浙江,26) 角度发散 根据氧化还原反应的强弱规律考查氧化还原反应发生的顺序。 知识链接 守恒规律在氧化还原反应计算中的应用:对于一个完整的氧化还原 反应,化合价升降总数相等,得失电子总数相等,即n(氧化剂)×变价原子数 ×化合价变化值=n(还原剂)×变价原子数×化合价变化值。 解题关键:(1)找出氧化剂、还原剂和相应的还原产物、氧化产物及 其物质的量。(2)找准每摩尔原子或离子得失电子数。 角度3 氧化还原反应的有关计算[2012·浙江,26(3)] 1.(2013·上海,18)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+ 2KNO3―→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下 列判断正确的是 ( )。 A.生成42.0 L N2(标准状况) B.有0.250 mol KNO3被氧化 C.转移电子 的物质的量为1.25 mol D.被氧化的 N原子的物质的量为3.75 mol [高考印证] 解析 反应中化合价和电子转移为: 生成N2的量n(N2)=2 mol,标准状况下体积VN2=44.8 L,A项错误;被还 原KNO3的量n(KNO3)=0.25 mol,不是被氧化,B项错误;转移电子的量n(e -)=1.25 mol,C项正确;被氧化N的量n(N)(氧)=3.75 mol,D项正确。 答案 CD 1.(2013·杭州联考)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,振荡, 静置,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐 变浅,最后变成无色,生成物之一为HIO3。则有关该过程的说法不正确的是 ( )。 A.CCl4层由紫色变成无色的化学反应方程式为I2+5Cl2+ 6H2O===2HIO3+10HCl B.整个过程中每生成1 mol HIO3共转移6NA个电子 [应用体验] C.整个过程中的还原剂有KI、I2 D.若把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层 的颜色没有变化,则Cl2、HIO3、HBrO3的氧化性由强到弱的顺序是 Cl2>HBrO3>HIO3 解析 A中根据化合价升降原则确定生成物,并根据得失电子守恒配平,可 得I2+5Cl2+6H2O===2HIO3+10HCl,A正确;根据化合价变化规律可知B 正确;C中分析整个过程中化合价升高的都是碘元素,还原剂为KI和I2;D中 KI换成KBr时,得到的是溴单质,则其在CCl4中呈橙红色,继续滴加氯水时, 颜色不变,可知氯水不能将溴单质氧化成HBrO3,故氧化性强弱顺序为 HBrO3>Cl2>HIO3。 答案 D 知识链接 离子方程式正误判断的方法: 考点二 离子方程式的书写与正误判断 角度1 离子方程式的正误判断(2013·全国新课标Ⅱ,10) 知识链接 角度2 离子方程式的书写与配平[2013·北京理综,27(1) (2)] [高考印证] 解析 A项,不符合客观事实,盐酸与铁反应应生成Fe2+,错;B项,钠不 能从CuSO4溶液中置换铜,错;C项,HCO不能拆开,错。 答案 D [应用体验] 2.(2013·台州质量评估,14)下列离子方程式书写正确的是 ( )。 A. 在强碱溶液中,次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4: 3ClO-+2Fe(OH)3===2FeO2- 4 +3Cl-+H2O+4H+ B. Fe(NO3)3 溶液中加入过量的 HI 溶液:2Fe3++2I-===2Fe2+ + I2 C.FeSO4 溶液中加入酸性 K2Cr2O7 溶液:6Fe2++Cr2O2- 7 + 14H+===6Fe3++2Cr3++7H2O D.NaHCO3 溶液中加入过量的 Ba(OH)2 溶液:2HCO- 3 +Ba2+ +2OH-===BaCO3↓+2H2O+CO2- 3 解析 A项,强碱溶液中不能生成氢离子,错;B项,Fe3+氧化性比HNO3 弱,HNO3氧化I-,错;D项,NaHCO3溶液中加入过量的Ba(OH)2溶液生成 BaCO3、H2O和NaOH,错。 答案 C 知识链接 考点三 离子共存的判断 角度1 发生复分解反应使离子不能大量共存(2013·重庆理 综,10D) 复分解反应的条件主要指生成沉淀、气体、弱电解质,如 Ba2+与 CO2- 3 、SO2- 3 、SO 2- 4 等生成沉淀,H+与 CO2- 3 、HCO- 3 、 SO2- 3 、S2-等生成气体,H+与 OH-、ClO-、CH3COO-、F- 等生成弱电解质。 角度发散 发生络合反应的离子也不能大量共存,如Fe3+与SCN-因生成络合 离子[Fe(SCN)]2+而不能大量共存。 知识链接 溶液中常见的离子间发生的氧化还原反应(“√”表示能发生反应,“×” 表示不能发生反应,括号内注“H+”表示酸性条件) 角度2 发生氧化还原反应使离子不能大量共存(2013·广东 理综,8B) 知识链接 角度3 发生水解相互促进反应使离子不能大量共存 (2012·广东,7D) 角度4 挖掘题目中的隐含条件(2013·江苏,3AB) [高考印证] [应用体验] 知识链接 离子检验的基本步骤:(1)通过观察初步判断(固体,溶液的颜色等); (2)化学方法进一步确认(利用特征反应);(3)根据现象得出结论。 角度发散 在离子检验时除了考虑各离子的特征反应外,还要注意排除离子间 可能存在的干扰。 考点四 离子的检验、推断和鉴别 角度1 离子的检验(2013·福建理综,10D) 知识链接 离子推断题的解题关键在于掌握离子的特征反应以及离子间的共存 情况。注意离子推断的四项原则: 角度2 离子的推断(2012·浙江,13) 知识链接 物质鉴别时的注意事项:(1)“先取样,后操作”,若待检物是固体, 应先将其溶解再取样检验;取样时,取少量实验,防止污染试剂。(2)并列实 验,每次实验,都要另取新溶液,避免已加试剂干扰;若连续实验,注意试 剂的来源。(3)用一种试剂鉴别多种物质,所选试剂必能和被鉴别物质大多数 发生特征反应,且能产生不同的实验现象。(4)“先现象,后结论”,即根据 实验现象得出结论。 角度3 物质的鉴别(2013·浙江理综,13) 4.(2013·浙江理综,13)现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁) 的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了 如下实验: [高考印证] 已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。 该同学得出的结论正确的是 ( )。 A.根据现象1可推出该试液中含有Na+ B.根据现象2可推出该试液中并不含有葡萄糖酸根 C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ D.根据现象5可推出该试液中一定含有Fe2+ 解析 加入NaOH溶液后观察到黄色火焰,不能确定试液中含有Na+,A项 不正确;由于葡萄糖酸根中不含醛基,不能与银氨溶液发生银镜反应,现象 2不能说明任何问题,B不正确;Mg2+与NH3·H2O反应会产生沉淀,显然C 项正确;用H2O2氧化之前未检验是否含有Fe3+,D项不正确。 答案 C [应用体验] 知识链接 (1)具有氧化性的物质和具有还原性的物质间不一定都能发生反应, “两强相遇才反应”。(2)含同种元素的高价态物质与低价态物质反应时“价 态不交叉、不换位”且“无中间价态不反应”。(3)应用电子转移守恒计算时, 注意得失电子的原子(或离子)的数目。 防范1 不能正确使用氧化还原反应中的一些规律 [防范演练] 知识链接 正确书写和判断离子方程式的正误要注意:(1)要符合客观事实,如 Fe发生置换反应只能生成Fe2+,HNO3与金属反应不能生成H2。(2)合理拆 分化学式。只有强酸、强碱或易溶于水的盐才能拆成离子形式,而沉淀、 氧化物、弱电解质、气体等不能拆分。(3)注意题设条件及要求,如用量的 多少及试剂滴加顺序等。(4)注意反应前后电荷、质量、得失电子是否守恒。 (5)注意阴、阳离子的比例与它们形成化合物时的比例是否相符;(6)查等号、 可逆号是否应用恰当;(7)注意反应环境、物质的溶解性、反应的可能性。 防范2 不能正确书写和判断离子方程式的正误 [防范演练] 解析 A项,HClO为弱电解质,应写成分子式形式,错误;C项,铜为活泼 电极,而选项所给出反应是惰性电极电解CuSO4溶液时所发生的离子反应, 错误;D项,反应产物应为SO2、S、H2O,错误;B项正确。 答案 B 知识链接 (1)正确分辨溶液的酸碱性,特别要注意给出的c(H+)或c(OH-)是由 水电离出的还是溶液中的。(2)充分挖掘限制条件,如离子颜色、透明、溶 液的酸碱性、氧化还原反应、水解相互促进的离子、可能大量共存还是一 定能大量共存、不能大量共存等。 防范3 忽视离子大量共存的隐含条件 [防范演练] 所谓“守恒”思想就是以化学反应过程中存在的某些守恒关系,如原子 守恒、得失电子守恒或电荷守恒等作为依据,寻找某些特殊的等量关系。其 特点是抓住变化过程的始态和终态,忽略中间过程,利用其中某种不变量建 立关系式,从而简化思路,快速解题。 守恒思想在化学计算中的应用 1.质量守恒就是化学反应前后各物质的质量总和不变。依据该定律和有关 情况,可得出下列等式:(1)反应物的质量之和=生成物的质量之和。(2)反应 物减少的总质量=生成物增加的总质量。(3)溶液在稀释或浓缩过程中,原溶 质质量=稀释或浓缩后溶质质量(溶质不挥发、不析出)。 2.电荷守恒就是指阳离子所带的正电荷总数等于阴离子所带的负电荷总数。 它主要包括:(1)化合物的化学式中存在的正负化合价总数绝对值相等的原则; (2)离子反应前后净电荷数相等;(3)电解质溶液呈电中性,阳离子所带的正电 荷数等于阴离子所带的负电荷数。该法常用于计算溶液中已知多种离子的物 质的量(或浓度)来计算某一离子的物质的量(或浓度)等。 3.电子得失守恒指的是化学反应中(或系列化学反应中)氧化剂所得电子总数 与还原剂所失电子总数相等。即氧化剂的物质的量×变价元素的原子个数× 化合价的变化值=还原剂的物质的量×变价元素的原子个数×化合价的变化 值。该法常用于有关氧化还原反应、原电池、电解池的计算等。 在100 mL含等物质的量HBr和H2SO3的 溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶 液中的HBr和H2SO3的浓度都等于 ( )。 A.0.007 5 mol·L-1 B.0.008 mol·L-1 C.0.075 mol·L-1 D.0.08 mol·L-1 [应用体验]查看更多