- 2021-05-27 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版无机化学工艺流程作业
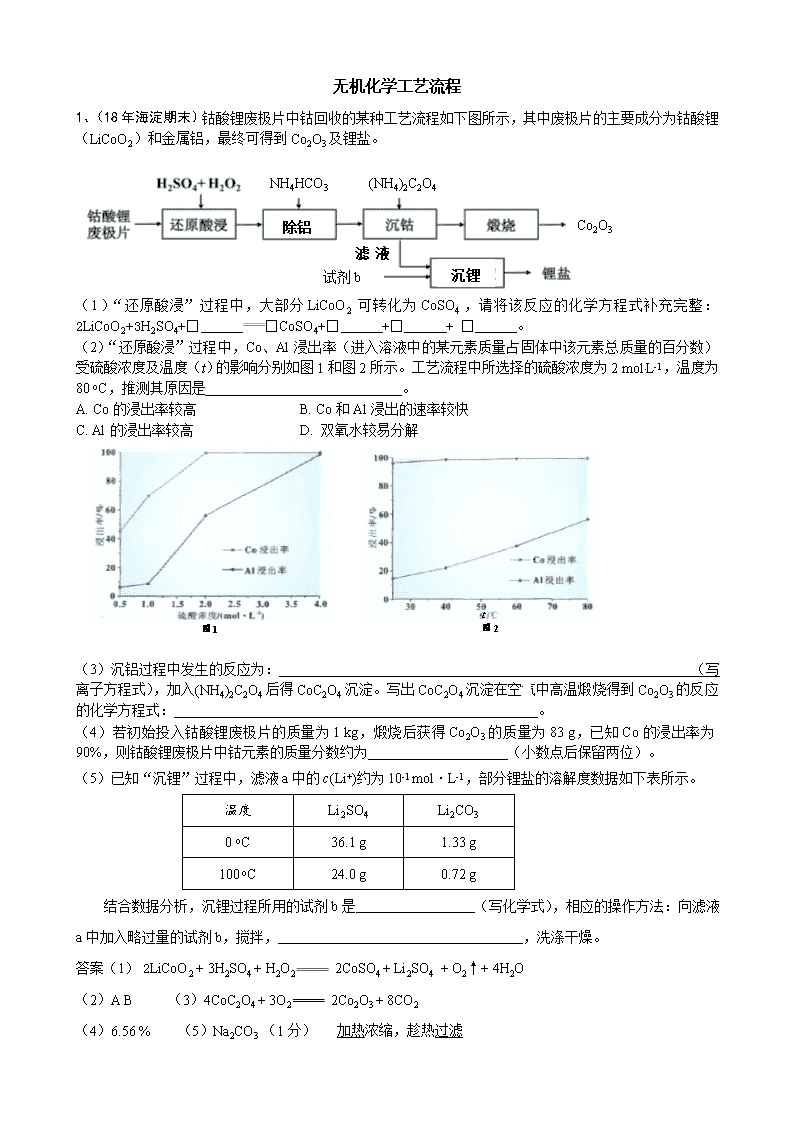
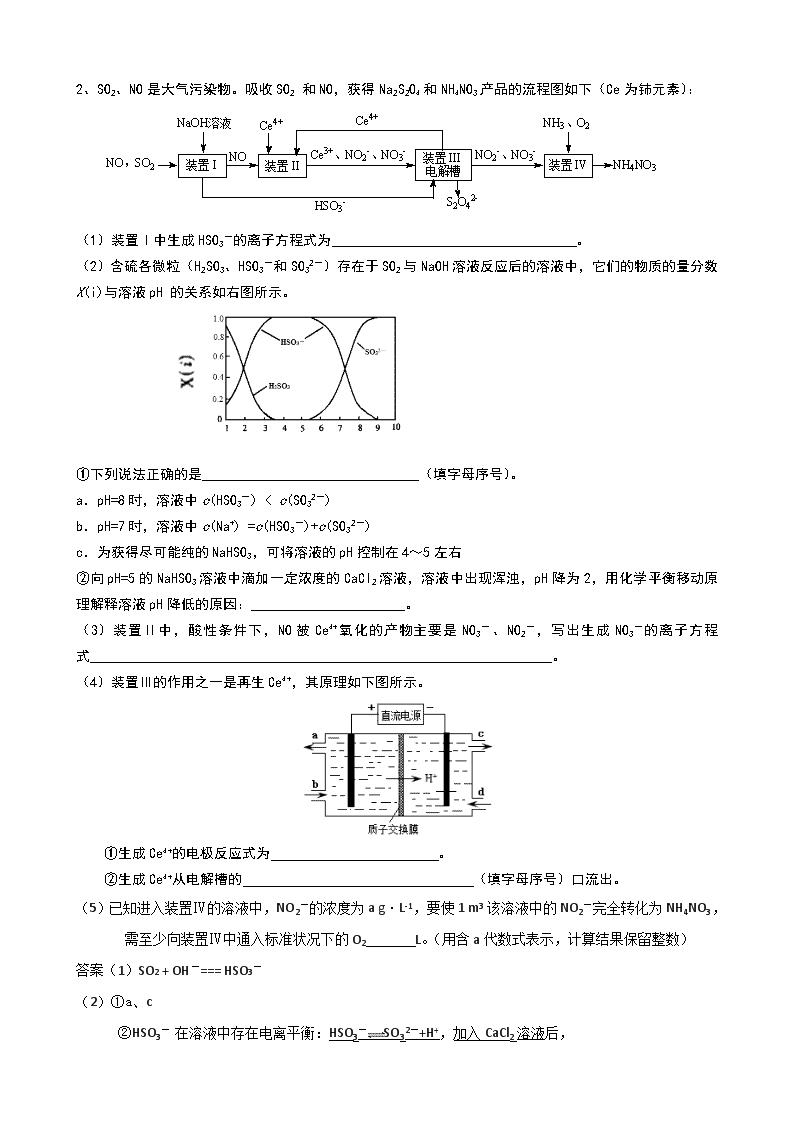
无机化学工艺流程 1、NH4HCO3 (NH4)2C2O4 沉锂 滤液a 试剂b Co2O3 除铝 (18年海淀期末)钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。 (1)“还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ □CoSO4+□ +□ + □ 。 (2)“还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是 。 A. Co的浸出率较高 B. Co和Al浸出的速率较快 C. Al的浸出率较高 D. 双氧水较易分解 t 图1 图2 (3)沉铝过程中发生的反应为: (写离子方程式),加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式: 。 (4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为 (小数点后保留两位)。 (5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。 温度 Li2SO4 Li2CO3 0 oC 36.1 g 1.33 g 100 oC 24.0 g 0.72 g 结合数据分析,沉锂过程所用的试剂b是 (写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌, ,洗涤干燥。 答案(1) 2LiCoO2 + 3H2SO4 + H2O2 2CoSO4 + Li2SO4 + O2↑+ 4H2O (2)A B (3)4CoC2O4 + 3O2 2Co2O3 + 8CO2 (4)6.56 % (5)Na2CO3 (1分) 加热浓缩,趁热过滤 2、SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素): (1)装置Ⅰ中生成HSO3-的离子方程式为 。 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。 ①下列说法正确的是 (填字母序号)。 a.pH=8时,溶液中c(HSO3-) < c(SO32-) b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-) c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右 ②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。 (3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。 (4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。 ①生成Ce4+的电极反应式为 。 ②生成Ce4+从电解槽的 (填字母序号)口流出。 (5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数) 答案(1)SO2 + OH-=== HSO3- (2)①a、c ②HSO3- 在溶液中存在电离平衡:HSO3-SO32-+H+,加入CaCl2溶液后, Ca2++SO32-=== CaSO3↓使电离平衡右移,c(H+)增大。 (3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+ (4)①Ce3+- e-=== Ce4+ ② a (5)243a(242a、244a、5600a /23都给分) 3富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略): c(Al3+) c(Fe3+) >1 (1)A12O3与H2SO4发生反应的离子方程式是________。 (2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明) ________。 (3)将溶液A电解得到液体聚合硫 酸铝铁。装置如图所示(阴离 子交换膜只允许阴离子通过, 电极为惰性电极) ① 阴极室的电极反应式是________。 ② 电解过程阳极室溶液pH的变化是________(填“增大”、“减小”或“不变”)。 ③ 简述在反应室中生成液体聚合硫酸铝铁的原理________。 答案(1)A12O3+6H+=2Al3++3H2O (2分) (2)2Fe2+ + H2O2+2H+ = 2Fe3++2H2O 补充Fe3+(2分) (3)① 2H++2e-=H2↑ (1分) ②减小 (1分) ③电解过程中反应室中的SO42--通过阴离子交换膜进入阳极室,阴极室中的OH-通过 阴离子交换膜进入反应室,生成聚合硫酸铝铁。(2分) 4、电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收: 溶液A 滤渣 ②调节pH 过滤 FeCl3溶液 (循坏利用) ③NaHCO3 滤液 Cu2(OH)2CO3 稀盐酸 蚀刻 废液 ①H2O2溶液 搅拌 请回答: (1)FeCl3—HCl溶液蚀刻铜板后的废液中含有的金属阳离子是 。 (2)FeCl3蚀刻液中加入盐酸的目的:可以 ,又可提高蚀刻速率。 (3)步骤①中加入H2O2溶液的目的是 。 (4)已知: 生成氢氧化物沉淀的pH Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀时 4.7 7.0 1.9 沉淀完全时 6.7 9.0 3.2 根据表中数据推测调节pH的范围是 。 (5)写出步骤②中生成CO2的一个离子方程式_ (已知Cu2(OH)2CO3不易溶于水)。 (6)写出步骤③生成Cu2(OH)2CO3的离子方程式___________________。 答案(1)Fe3+ 、Fe2+和Cu2+ (2)抑制氯化铁水解 (3)将Fe2+氧化成Fe3+,方便后续沉淀时除去 (4)[3.2,4.7)或3.2≤pH<4.7 (5)4H++Cu2(OH)2CO3 = 3H2O +2 Cu2++ CO2↑ 或4Fe3++3Cu2(OH)2CO3+3H2O = 4Fe(OH)3+6 Cu2++3 CO2↑ (6)2Cu2++4HCO3— = Cu2(OH)2CO3↓+H2O +3 CO2↑ 5.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下: 已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。 b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示: M(OH)n Ksp pH 开始沉淀 沉淀完全 Al(OH)3 1.9×10-33 3.43 4.19 Fe(OH)3 3.9×10-38 2.53 2.94 Ni(OH)2 1.6×10-14 7.60 9.75 回答下列问题: (1)根据表中数据判断步骤②依次析出的沉淀Ⅱ________和沉淀Ⅲ________(填化学式),则pH1________pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用________(填序号)。 A.pH试纸 B.石蕊指示剂 C.pH计 (2)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则步骤③的化学方程式是_______________________。 步骤③后,过滤沉淀所需的玻璃仪器有____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_______________ ______________________。 (3)④中阳极反应产生的气体E为________,验证该气体的试剂为_____________________。 (4)试写出步骤⑥的离子方程式:______________________________。 答案 (1)Fe(OH)3 Al(OH)3 < C (2)NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O↓+2NaCl 漏斗、玻璃棒和烧杯 玻璃棒划破滤纸、滤液超过滤纸边缘 (3)Cl2 湿润的淀粉-KI试纸 (4)2Ni(OH)2+2OH-+Cl2===2Ni(OH)3+2Cl- 6、无水氯化铝在生产、生活中应用广泛。 (1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为_________________________________________________________。 (2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下: 已知: 物质 SiCl4 AlCl3 FeCl3 FeCl2 沸点/℃ 57.6 180(升华) 300(升华) 1 023 ①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________________________________(只要求写出一种)。 ②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是___________________________________。 ③已知: Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1 2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1 由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 _____________________________________________________。 ④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_____________________________。 ⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 _________________________________________________。 答案 (1)Al3++3H2OAl(OH)3(胶体)+3H+ (2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率 ②Fe或铁 ③Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1 ④NaCl、NaClO、Na2CO3 ⑤除去FeCl3,提高AlCl3纯度 7、工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主 要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。 钛铁矿 硫酸 353K ① Fe3+ Fe2+ TiO2+ H+ SO42-残渣 铁粉 ② 滤渣 Fe2+ TiO2+ H+ SO42- 冷却结晶 ③ FeSO4·7H2O Fe2+ TiO2+ H+ SO42- 热水 ④ H2TiO3固体 煅烧 ⑤ 废液(主要含Fe2+、 H+、SO42-) TiO2 已知:TiOSO4遇水会水解。 (1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。 (2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。 a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异 (3)步骤②、③、④中,均需用到的操作是 (填操作名称)。 (4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理: 。 (5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰 (MnSO4,易溶于水),该反应的离子方程式为 。 (6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下 图所示装置获得金属钙,并以钙为还原剂,还 原二氧化钛制备金属钛。 ①写出阳极所发生反应的电极反应式: 。 ②在制备金属钛前后,CaO的总量不变,其原 因是(请结合化学用语解释) 。 答案:(1)2Fe3+ + Fe === 3Fe2+ (2)b (3)过滤 (4)溶液中存在平衡:TiO2+ + 2H2O H2TiO3 + 2H+,当加入热水稀释、升温后, 平衡正向移动,生成H2TiO3。 (3分) (说明:写出离子方程式或化学方程式得1分,从稀释和升温角度正确分析平衡移 动各得1分。) (5)MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O (6)① 2O2- - 4e- == O2↑(同时写出C + O2 == CO2不扣分) 8.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下: (1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。 ①生成Ca(ClO)2的化学方程式为____________________________________。 ②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。 A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解 (2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O 氯化完成后过滤。 ①滤渣的主要成分为_________(填化学式)。 ②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] ________1∶5(填“>”、“<”或“=”)。 (3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是________。 答案 (1)①2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ②AB (2)①CaCO3、Ca(OH)2 ②< (3)蒸发浓缩、冷却结晶 9、利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。流程如下: Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤; Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4; Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀; Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液; Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体; Ⅵ.测定K2Cr2O7固体的纯度。 已知:Cr2O72-(橙红色)+H2O2CrO42-(黄色)+2H+ (1)步骤Ⅰ中红褐色沉淀的化学式是 。 (2)步骤Ⅱ中加入Na2SO3的目的是 。 (3)步骤Ⅳ中反应的离子方程式是 。 (4)步骤Ⅴ中加入的物质A可以是 。(填序号) a.KOH b.K2CO3 c.H2SO4 d.SO2 (5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL 0.50 mol/L的FeSO4溶液,恰好使Cr2O72-完全转化为Cr3+。产品中K2Cr2O7的纯度是 。(注:K2Cr2O7的摩尔质量为294 g/mol) (6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是 ,溶液pH变小的原因是 。 答案(1)Fe(OH)3 (1分) (2)将+6价的Cr还原为+3价 (2分) (3)2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O (2分) (4)c (2分); (5)98% (2分) (6)BaCrO4 (2分); K2Cr2O7溶液中存在平衡:Cr2O72-(橙红色)+H2O2CrO42-(黄色)+2H+,加入Ba(NO3)2溶液后,产生BaCrO4沉淀,c (CrO42-)降低,平衡正向移动,c (H+)增大。(2分) 10、Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。 (1)举例说明向大气中排放SO2导致的环境问题: 。 (2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是。 (3)中和器中发生的主要反应的化学方程式是 。 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 (4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。 ①请结合Na2SO3的溶解平衡解释NaOH过量的原因 。 ②结晶时应选择的最佳操作是 (选填字母)。 a. 95~100℃加热蒸发,直至蒸干 b.维持95~100℃蒸发浓缩至有大量晶体析出 c.95~100℃加热浓缩,冷却至室温结晶 (5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是 、。 (6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。 ①滴定终点前反应的离子方程式是: ②成品中Na2SO3(M = 126 g/mol)的质量分数是 。 (1)酸雨(2)2CO32- + SO2 + H2O = 2HCO3- + SO32-(3)NaHSO3 + NaOH = Na2SO3 + H2O (4)①Na2SO3存在溶解平衡:Na2SO3(s) 2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动 ②b(5)BaCl2溶液稀盐酸(6)①IO3- + SO32- = + ②3xy×100% 11脱硫技术能有效控制SO2对空气的污染。 (1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是__ _。 (2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: ①向曝气池中通入空气的目的是____ ___。 ②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。 a.Cl- b.SO42- c.Br- d.HCO3- (3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨) ①图中a极要连接电源的(填“正”或“负”)___ ____极,C口流出的物质是_______。 ②SO32-放电的电极反应式为____ ___。 ③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___ ____。 答案(1)2SO2 +O2 +2CaCO3=2CaSO4+2CO2(2分) (2)①将H2SO3、HSO3-等氧化为SO42-(2分) ②bd(2分) (3)①负(1分) 硫酸(1分) ② SO32-–2e-+H2O=SO42-+2H+(2分) ③H2OH++OH—,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向 移动,碱性增强(2分) 12、某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下: 已知:有关金属离子生成氢氧化物沉淀所需的pH如下图: (1)滤渣1的主要成分为 。 (2)电解脱铜:金属铜在 极析出。 (3)①用离子方程式解释加入H2O2的作用 。 ②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。 (4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。 (5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下: ①A极的电极反应式为 和2H++2e-=H2↑。 ②B极附近pH会 (填“增大”、“减小”或 “不变”);用平衡移动原理解释B极附近pH变化的原因: 。 ③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。 答案(1)SiO2 (1分) (2)阴 (1分) (3)① 2H+ +H2O2 + 2Fe2+=== 2Fe3++ 2H2O ② Fe(OH)3、Al(OH)3 (答出1个给1分) (4)加热浓缩、冷却结晶 (5)①Ni2++2e-===Ni②减小 (1分) H2OH++OH- ,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低 ① 29.5 13、(18年海淀)太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下: (1) 下列说法中,正确的是______( 填字母序号)。 a.太阳能、风能都是清洁能源 b.太阳能电池组实现了太阳能到电能的转化 c.控制系统能够控制储能系统是充电还是放电 d.阳光或风力充足时,储能系统实现由化学能到电能的转化 (2 )全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A 的电极反应式为__ ___;充电时电极B 做__ ____极。 (3) 含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下: 已知溶液pH 范围不同时,钒的存在形式如下表所示: 钒的化合价 pH<2 pH>11 +4价 VO2+,VO(OH)+ VO(OH)3- +5价 VO2+ VO43- ①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为__ _____、__ _____;所得滤液1中,铝元素的存在形式为___ _____。 ②向碱性的滤液1( V的化合价为+4 )中加入H2O2的作用是________(用离子方程式表示)。 答案(1)abc(答对1~2个给1分) (2)VO2+ + e- + 2H+ VO2+ + H2O 阴 (3)①Fe2+ + 2OH- Fe(OH)2↓ 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3 AlO2-(此空1分) ② 2VO(OH)3- + H2O2 + 4OH- 2VO43-+ 6H2O 14、(18年海淀)铅精矿可用于冶炼金属铅,其主要成分为PbS。 I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。 (1)用铅精矿火法炼铅的反应的化学方程式为 。 (2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为 。 II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下: 已知:①不同温度下PbCl2的溶解度如下表所示。 温度(℃) 20 40 60 80 100 溶解度(g) 1.00 1.42 1.94 2.88 3.20 ②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡: PbCl2(aq) + 2Cl-(aq) PbCl42-(aq) (3)浸取液中FeCl3的作用是 。 (4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是 。 (5)将溶液3和滤液2分别置于右图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。 ①溶液3应置于 (填“阴极室”或“阳极室”)中。 ②简述滤液2电解后再生为FeCl3的原理: 。 ③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式为 。 答案(1)2PbS + 3O2 2PbO + 2SO2 (2)2NH3·H2O + SO2 2NH4+ + SO32- + H2O (3)使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣 (4)加水稀释使PbCl2(aq) + 2Cl-(aq) PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小 (5)①阴极室 ②阳极发生电极反应:Fe2+ - e- Fe3+(或2Cl- -2e- Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生 ③查看更多