- 2021-05-26 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学人教版选修3学案:2-2-1 价层电子对互斥理论 Word版含解析
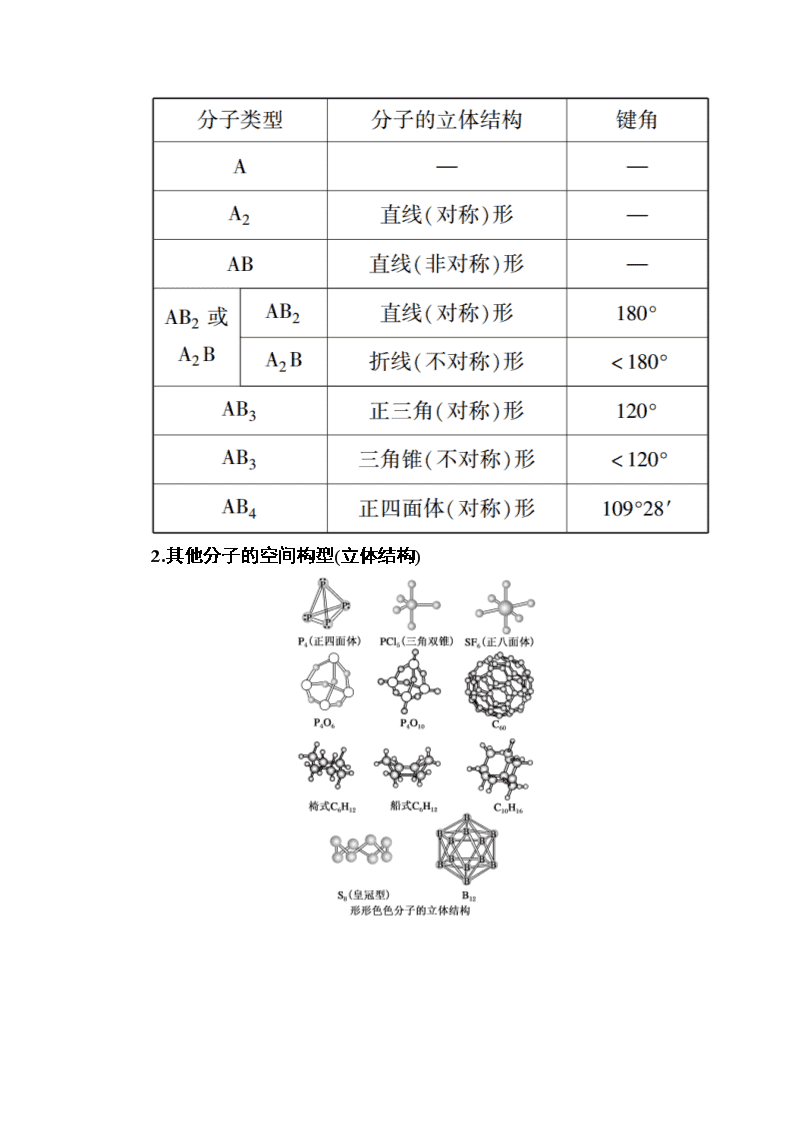
www.ks5u.com 第二节 分子的立体构型 第一课时 价层电子对互斥理论 [学习目标] 1.通过图片或模型认识共价分子结构的多样性和复杂性。 2.学会用价层电子对互斥模型来判断分子的立体构型。 一、形形色色的分子 1.三原子分子(AB2型) 2.四原子分子(AB3型) 3.五原子分子(AB4型) 最常见的为正四面体形,如CH4、CCl4等,键角为109°28′。 二、价层电子对互斥理论 1.内容 价层电子对互斥理论认为,分子的立体结构是“价层电子对”相互排斥的结果。价层电子对是指分子中的中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。 2.价层电子对数的确定 σ键电子对数可由分子式确定。而中心原子上的孤电子对数,确定方法如下: 中心原子上的孤电子对数=(a-xb); a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数。 3.VSEPR模型和分子的立体结构 H2O的中心原子上有2对孤电子对,与中心原子上的σ键电子对相加等于4,它们相互排斥形成四面体形VSEPR模型。略去VSEPR模型中的中心原子上的孤电子对,因而H2O的立体结构为V形。 知识点一 常见分子的立体构型 1.分子的键角和空间结构 2.其他分子的空间构型(立体结构) ①常见直线形分子:双原子分子、HCN结构式为(H—C≡N)、乙炔(H—C≡C—H)。 ②四原子分子中,CH2O分子中的C===O、C—H键的键长不同,其分子构型为等腰三角形;SO3、BF3为平面正三角形;P4(白磷)为正四面体形(),键角为60°。 ③AB4型分子或离子:CX4(X为卤素原子或氢原子)、SiCl4、SiH4、NH、SO。 五原子分子都是正四面体结构吗? 【点拨】 不是,如CH3Cl、CH2Cl2、CHCl3等,虽为四面体结构,但由于碳原子所连的四个原子不相同,四个原子电子云的排斥力不同,使四个键的键角不全相等,所以并不是正四面体结构。 【例1】 硫化氢(H2S)分子中,两个H—S键的夹角接近90°,说明H2S分子的空间构型为________;二氧化碳(CO2)分子中,两个C===O键的夹角为180°,说明CO2分子的空间构型为________;甲烷(CH4)分子中,任意两个C—H键的夹角都为109°28′,说明CH4分子的空间构型为________。 【提示】 本题考查利用已学知识分析分子的空间结构。解题时,要密切联系所学的化学键、键参数、元素的性质和递变规律等来解题。 【解析】 用键角可直接判断分子的空间构型。S、O同主族,因此H2S和H2O分子的空间构型相似,为V形。其他分子的空间构型参照知识点进行判断。 【答案】 V形 直线形 正四面体形 下列各组的几种分子中所有原子都可能处于同一平面的是( C ) A.CH4、CS2、BF3 B.CO2、H2O、NH3 C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3 解析:题中的CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子的所有原子不可能都在同一平面上,CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子都是平面形结构,故选C。 知识点二 价层电子对互斥理论 1.价层电子对互斥理论的基本要点 (1)在ABn型分子中,中心原子A的周围配置的原子或原子团的几何构型,主要决定于中心原子价电子层中电子对(包括成键电子对和未成键的孤电子对)的互相排斥作用,分子的几何构型主要采取电子对相互排斥作用最小的那种结构。 (2)ABn型分子中,A与B之间通过两对或三对电子(即通过双键或三键)结合而成,则价层电子对互斥理论把双键或三键作为一个电子对看待。 (3)价层电子对之间相互排斥作用大小的一般规律: 孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。 2.用价层电子对互斥理论确定分子或离子空间构型的方法 (1)运用价层电子对互斥理论判断主族元素间形成的ABn型或ABxCy型(A为中心原子)分子或离子的立体构型,一般需要经过以下三个步骤。 第一步:中心原子上价层电子对数的确定 方法一:中心原子上的价层电子对数=σ键电子对数+中心原子上的孤电子对数。 ①中心原子的σ键电子对数的求算:中心原子结合的原子数有几个,就有几对σ键电子对。如:NH中的σ键电子对数为4,CH2O中的σ键电子对数为3。 ②中心原子上的孤电子对数=(a-xb),式中a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数。如NO的中心原子为N,a=5+1=6,x=2,b=2,中心原子上的孤电子对数为1。若与中心原子结合的原子不止一种,则xb就是与中心原子结合的各原子达到稳定结构时所需的电子总数。如HCN中的xb=1+3=4,中心原子上的孤电子对数为0。 方法二:中心原子上的价层电子对数=(中心原子的价电子数+与中心原子结合的原子提供的电子数)。 计算时要注意以下几点: ①作为与中心原子结合的原子,卤素原子和氢原子提供1个电子,第ⅥA族元素的原子不提供电子; ②若是离子,在计算中心原子的价电子数时,还应加上阴离子的电荷数(绝对值)或减去阳离子的电荷数。如PO中P原子的价电子数为8,NH中N原子的价电子数为4。 ③若价电子数出现奇数时,可把这个单电子当做电子对看待。 第二步:价层电子对互斥(VSEPR)模型的确定 VSEPR模型与中心原子上价层电子对数的关系一般如下表所示。 注意:通常所说的分子的立体构型是指分子中原子的空间排布,不包括孤电子对。根据以上简单规则得到VSEPR模型后,略去孤电子对占据的空间结构,就是分子的立体构型。如H2O中,中心原子O的孤电子对数是2,σ键电子对数是2,价层电子对数是4,形成四面体结构,略去两对孤电子对占有的空间,H2O呈V形。同理,可知NH3呈三角锥形。 第三步:分子或离子的立体构型的确定 确定分子或离子的中心原子上的价层电子对数后,再依据上表,即可确定分子或离子的立体构型。 (2)用价层电子对互斥理论判断共价分子结构的实例 使用价层电子对互斥理论判断分子空间构型时需注意:价层电子对互斥构型是价层电子对的空间构型,而分子的空间构型指的是成键电子对的空间构型,不包括孤电子对。两者是否一致取决于中心原子上有无孤电子对(未用于形成共价键的电子对),当中心原子上无孤电子对时,两者的构型一致;当中心原子上有孤电子对时,两者的构型不一致。 应用价层电子对互斥模型如何将分子分类? 【点拨】 应用价层电子对互斥模型将分子分成两大类:一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的C原子,它们的立体构型可应用中心原子周围的原子数来预测;一类是中心原子上有孤电子对(未用于形成共价键的电子对)的分子,如H2O和NH3中心原子上的孤电子对也要占据中心原子周围的空间,并参与互相排斥,因而H2O分子呈V形,NH3分子呈三角锥形。 【例2】 用价层电子对互斥模型推测下列分子或离子的空间构型: BeCl2________,SCl2________,BF3________, PF3________,NH________,SO________。 【解析】 根据各分子的电子式和结构式,分析中心原子的孤电子对数,依据中心原子连接的原子数和孤电子对数,确定VSEPR模型和分子的空间构型。 【答案】 直线形 V形 平面三角形 三角锥形 正四面体形 三角锥形 填写下表,并列出中心原子孤电子对数的表达式: 解析:ABn型分子或离子中,σ键电子对数=n(配位原子数),中心原子的孤电子对数按表达式进行计算。由价层电子对数和分子(或离子)类型判断空间构型,即价层电子数为2,AB2型分子为直线形;价层电子对数为3,AB2型分子为V形,AB3型分子为平面三角形;价层电子对数为4,AB2型分子为V形,AB3型分子为三角锥形,AB4型分子为正四面体形。 1.下列有关价层电子对互斥理论的描述正确的是( C ) A.价层电子对就是σ键电子对 B.孤电子对数由分子式来确定 C.分子的立体构型是价层电子对互斥的结果 D.孤电子对数等于π键数 解析:价层电子对数是σ键数与孤电子对数之和,孤电子对数是指没有成键的价电子对数,其与中心原子价层电子总数、与中心原子结合的原子最多能接受的电子数及与中心原子结合的原子数有关,A、B、D项错误。 2.下列分子或离子的中心原子,带有一对孤电子对的是( D ) A.H2O B.BeCl2 C.CH4 D.PCl3 解析:方法1:选项中四种物质的电子式依次为: H2O有2对孤电子对,BeCl2和CH4没有孤电子对,PCl3有 一对孤电子对。 方法2:将选项中各物质的未知数据代入公式: 中心原子上的孤电子对数=(a-xb),经计算知,选项中原子上的孤电子对数依次为2、0、0、1。 3.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( D ) A.直线形;三角锥形 B.V形;三角锥形 C.直线形;平面三角形 D.V形;平面三角形 解析:H2S与H2O类似,中心原子S上有2对孤电子对,为了减小孤电子对的排斥作用,只能将H和孤电子对相间排列,H2S分子构型呈V形;BF3分子的中心原子B上无孤电子对,当分子构型呈平面三角形时,成键电子对之间的斥力最小,分子最稳定。故选D。 4.若ABn的中心原子A上没有未用于形成共价键的孤电子对,根据价层电子对互斥理论,下列说法正确的是( C ) A.若n=2,则分子的立体结构为V形 B.若n=3,则分子的立体结构为三角锥形 C.若n=4,则分子的立体结构为正四面体形 D.以上说法都不正确 解析:若中心原子A上没有未用于成键的孤电子对,则根据斥力最小的原则,当n=2时,分子的立体结构为直线形;当n=3时,分子的立体结构为平面三角形;当n=4时,分子的立体结构为正四面体形。 5.下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( B ) A.CO2 B.H2O C.CO D.CCl4 解析:CO2分子中每个O原子和C原子形成2对共用电子对,所以C原子的价层电子对数是2,且不含孤电子对,为直线形结构,VSEPR模型名称与分子立体构型名称一致;水分子中O原子的价层电子对数=2+×(6-2×1)=4,VSEPR模型名称为四面体形,因含有2对孤电子对,所以略去孤电子对后,其实际立体构型名称是V形,故VSEPR模型名称与分子立体构型名称不一致;CO的中心原子C原子形成3个σ键,中心原子上的孤电子对数=×(4+2-2×3)=0,所以CO的空间构型是平面三角形,VSEPR模型名称与分子立体构型名称一致;CCl4分子的中心原子C原子的价层电子对数=σ键个数+孤电子对数=4+×(4-1×4)=4,VSEPR模型为正四面体形结构,中心原子不含有孤电子对,分子立体构型为正四面体形结构,VSEPR模型名称与分子立体构型名称一致。 6.下列说法中正确的是( D ) A.NO2、SO2、BF3、NCl3 分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 B.P4和CH4都是正四面体形分子,且键角都为109°28′ C.NH的电子式为,离子呈平面正方形结构 D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 解析:NCl3分子的电子式为,分子中各原子都满足8电子稳定结构,A错误;P4为正四面体分子,但其键角为60°,B错误;NH为正四面体结构而非平面正方形结构,C错误;NH3分子电子式为,有一对未成键电子,由于未成键电子对成键电子的排斥作用,使其键角为107°,呈三角锥形,D正确。 7.(1)利用VSEPR推断分子或离子的立体结构。 PO四面体形;CS2直线形;AlBr3(共价分子)平面三角形。 (2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式: (3)按要求写出第二 周期非金属元素构成的中性分子的化学式。平面三角形分子BF3,三角锥形分子NF3,四面体形分子CF4。 解析:PO是AB4型,成键电子对是4,为四面体形。CS2是AB2型,成键电子对是2,是直线形。AlBr3是AB3型,成键电子对是3,是平面三角形。AB3型,中心原子无孤电子对的呈平面三角形,有一对孤电子对的呈三角锥形,所以分别是CH、CH。第二周期非金属元素构成的中性分子的化学式,呈三角锥形的是NF3,呈平面三角形的是BF3,呈四面体形的是CF4。 8.三原子分子或离子的常见立体构型有直线形与V形两种;四原子分子或离子的常见立体构型有平面三角形、三角锥形等;五原子分子或离子最常见的立体构型是四面体形;硫化氢分子中,两个H—S键的键角接近90°,H2S分子的空间构型为V形;二氧化碳分子是直线形分子,则分子中的键角呈180°;甲烷分子中,两个相邻C—H键的夹角是109°28′,说明CH4分子的空间构型为正四面体形。 解析:组成确定的微粒,其空间构型既与中心原子的σ键电子对数有关,也与中心原子是否存在孤电子对有关,由于这些微粒的中心原子有些有孤电子对,有些则没有,故它们的立体构型有所不同。查看更多